Недостаток белка: симптомы и диагностика
В статье мы расскажем:
- Зачем нужны белки
- Причины возникновения белковой недостаточности
- Симптомы дефицита белка в организме
- Диагностика дефицита белка
- Как восполнить дефицит белка
- Продукты богатые белком
Дефицит белка — повсеместная проблема, с которой изо дня в день сталкиваются в своей работе нутрициологи. Какие основные причины его возникновения и чем грозит организму недостаточность протеиновых молекул? На какие продукты стоит обратить внимание и что из биологически активных добавок следует добавить в свой рацион? Давайте разбираться.
Зачем нужны белки
Белки в человеческом теле выполняют множество функций. Прежде всего, это строительный материал — те кирпичики, на которых закладывается фундамент всех органов и тканей. Они создают каркас клеток — их цитоскелет, участвуют в формировании органелл движений — и кстати, благодаря последним лейкоциты способны выходить из системного кровотока в направлении очага воспаления. Именно коллаген соединительной ткани во многом придает структуру не только коже, но, скажем, и сосудам. В свою очередь, кератин входит в состав ногтей и волос.
Протеиновые молекулы осуществляют передачу сигналов, опосредуя межклеточные взаимодействия, транспортируют гормоны, жирные кислоты, образуют комплексы с самыми разными биологически активными веществами. Те из них, что не циркулируют в сыворотке, а встроены в плазматическую мембрану — избирательный барьер на границе внутри- и внеклеточной сред — являются важным фактором регуляции водно-солевого баланса: формируя ионные каналы, они способствуют входу в цитоплазму калия, натрия и некоторых других заряженных частиц.

Одна из наиболее важных функций, осуществляемых этим классом органических соединений, — это, несомненно, каталитическая. Все ферменты имеют белковую природу — и это опосредует строгие условия (включающие определенную температуру и рН среды), отклонения от которых в малейшую сторону приводят к своеобразному транспортному коллапсу на молекулярном и клеточном уровнях. Так, скажем, еще со школьных уроков биологии многие помнят: чрезмерное повышение температуры чревато денатурацией протеиновых молекул — в сущности, их разрушению. Здесь, как правило, понятно именно аналогия с глазуньей: только подумайте, какие “метаморфозы” происходят с куриным яйцом, стоит ему попасть на раскаленную сковородку.
Кроме того, большое количество гормонов также представлены полипептидами и белками — это позволяет выделить отдельным пунктом регуляторное воздействие: причем как местное, так и на уровне всего организма (взять хотя бы гормоны щитовидной железы, влияние которых начинается еще с клеточного метаболизма и заканчивается целыми системами органов).
Причины возникновения белковой недостаточности
Нарушение синтетической функции печени — центральной фабрики метаболизма. Именно здесь образуются белки плазмы крови: альбумины и большинство глобулинов, во многом опосредующие поддержание гомеостаза в организме.
Осуществляется это путем формирования онкотического давления: протеиновые молекулы в силу своей химической природы, притягивают воду, осуществляя, таким образом, контроль за водно-солевым обменом. Из этого можно сделать важное следствие: при низкой концентрации белков в сыворотке крови или же при их увеличении в межклеточной жидкости и тканях, что особенно характерно для воспалительных процессов, сопровождающихся повышением сосудистой проницаемости, развиваются отеки — вода выходит за пределы артерий и вен.
При заболеваниях, проявляющихся повреждением гепатоцитов (токсическими или инфекционными агентами), также возникают эдемы — причем преимущественно на нижней половине туловища и конечностях. Более подробно мы писали об этом в этой статье: https://miin.ru/blog/pitanie-pri-otekakh
Алиментарные факторы — голодание, приводящее в целом к белково-энергетической недостаточности, или же несбалансированная и некомпенсированная нутрицевтиками растительная диета, сопровождающаяся отсутствием в рационе незаменимых аминокислот — того субстрата для построения клеток и тканей, что организм не может воспроизвести самостоятельно, из подручных элементов и с помощью присутствующих ферментов.
Ниже мы привели небольшую таблицу с незаменимыми аминокислотами и теми продуктами, в которых они сконцентрированы. Надеемся, что это поможет вам грамотно организовать и подобрать подходящий именно вам тип питания.
куриное мясо и индейка
Фенилаланин
молоко и молочная продукция
Одна из наиболее частых патологий, приводящая к затруднению усвоения поступающего с пищей белка — сниженная кислотность желудочного сока.
Соляная кислота, вырабатываемая париетальными клетками слизистой, активирует протеолитические энзимы и, вдобавок, способствует набуханию белковых молекул, облегчая ферментативную обработку пищу. Также это мощный фактор неспецифической защиты, оказывающий сильное бактерицидное действие — в частности, и по отношению к простейшим, паразитическим червям, бактериям и вирусам.
Широкая популярность самостоятельного применения и частого назначения ингибиторов протонной помпы (“Омез”) стало причиной серьезного беспокойства ученых о вероятных последствиях их длительного приема не только на органы желудочно-кишечного тракта, но на и организм как таковой.
Кроме воздействия со стороны лекарственных препаратов, к уменьшению продукции соляной кислоты могут приводить поломки в фолатном цикле (а точнее в трех основных генах, осуществляющих его регуляцию: MTHFR, MTR, MTRR), так как именно он обеспечивает образование основного медиатора парасимпатической системы — ацетилхолина, стимулирующего, вдобавок, париетальные клетки желудка. При выявлении мутации необходима дополнительная поддержка организма, направленная на снижение концентрации накапливающегося в подобных условиях гомоцистеина — аминокислоты, известной своим повреждающим действием на эндотелий (внутреннюю выстилку сосуда) и занимающей не последнюю роль в патогенезе атеросклеротических повреждений.
С другой стороны, наравне с недостаточным образованием ацетилхолина, отмечается повышение медиатора воспаления — гистамина. Это происходит из-за нарушения процессов его обезвреживания, в норме осуществляемых реакциями метилирования. Учитывая, что и гистамин является активатором секреции желудочного сока, можно сделать закономерное заключение: влияние фолатного цикла на пищеварительную систему несколько неоднозначное. Логично предположить, что в условиях избыточного поступления этого биогенного амина, развиваются не только эрозивные поражения слизистой желудка, но и, вследствие увеличения проницаемости кишечной стенки, в системный кровоток попадают структурные элементы бактерий — наблюдается воспалительный процесс, причем не ограничивающийся сугубо ЖКТ.
Еще одной возможной причиной гипохлоргидрии является атрофический гастрит — аутоиммунное заболевание, сопровождающееся уменьшением числа функционирующих клеток вследствии их гибели при “атаках” антител сошедшей с ума иммунной системы, которая перестает четко разграничивать, где “свое”, а где “чужое”.
Повреждения слизистой желудка: язвы, гастриты, эрозии. Несмотря на широко закрепившееся в сознаниях людей убеждение, что воспаление эпителиальной выстилки сугубо осуществляется H.pylori, это нельзя сопоставить со стопроцентной истиной.
Во-первых, заражение происходит еще в глубоком детстве, поэтому само понятие об инфицировании в подростковом возрасте или взрослой жизни, скорее является эфемерной редкостью, чем правдой как таковой.
Во-вторых, все зависит именно от штамма бактерии: не все из них являются агрессивными (или, по меньшей мере, настолько сильно патогенными, чтобы проявилась клиническая манифестация и само воспаление слизистой желудка) — и это влечет за собой обязательную диагностику (хотя бы перед назначением 2-недельной антибиотикотерапии). Учитывая широкое распространение последней, что привело и без того к тотальной резистентности микрофлоры (населяющей и дистальные отделы тонкого, а также толстый кишечник человека) к хим.препаратам, а также бактериальное прошлое митохондрий, наших маленьких электростанций, самозабвенно продуцирующих энергию, решение о эрадикации хеликобактера должно быть хорошо обдумано врачом или нутрициологом, что прибег к более щадящей терапии нутрицевтиками.

Хеликобактер действительно приспосабливается (в отличие от большинства микроорганизмов) к неблагоприятным условиям желудочной среды: обладая специфическим ферментом, расщепляющим мочевину, он, путем выделения аммиака, защелачивает свое место обитания. Однако патология развивается лишь при его диссеминации — распространению из пилорического отдела, граничащего с двенадцатиперстной кишкой, по всему периметру желудка.
К поражению слизистой желудка зачастую приводит стресс: он сопровождается активацией симпатической нервной системы с последующим выбросом в кровь гормонов мозгового вещества надпочечников, что, воздействуя, в свою очередь, на секреторный аппарат почек, стимулируют выделение ими вазоконстриктора. Именно сужение просвета сосудов, в том числе и тех, что кровоснабжают желудок, приводит к последующему изъязвлению слизистой оболочки.
Нарушение расщепления и всасывания белков в кишечнике. Первое характерно для экзокринной недостаточности поджелудочной железы, при которой ее секреторные клетки перестают образовывать и выделять в кровь достаточное количество ферментов (причем не только протеолитических). Второе сопровождает синдром мальабсорбции и целиакию — еще одно аутоиммунное заболевание, переставшее, к сожалению, сегодня быть такой уж редкостью.
Нарушение желчеобразования и желчеоттока, что ведет к невозможности не только эмульгации жиров, но и активации панкреатических энзимов. Глистная инвазия, закупорка желчевыводящих путей конкрементами, снижение текучести этого секрета вследствие преобладания холестерина над остальными компонентами (желчными кислотами и фосфолипидами) — большое количество возможных причин обуславливают необходимость тщательной лабораторной и инструментальной диагностики, что выстраивают недостающие пазлы в клинической картине заболевания.
Заболевания почек: в норме белковые молекулы не фильтруются в первичную мочу в силу своих громоздких размеров. Однако, при повреждении почечного фильтра (образовании в нем “дыр”) отмечается массивная протеинурия, о чем свидетельствует выявление белков в общем анализе мочи.
Симптомы дефицита белка в организме
Одно из наиболее ярких проявлений недостаточного поступления и/или усвоения белков — появление отеков. Их развитие связано с закономерно возникающим сбоем водно-солевого обмена: в условиях сниженной концентрации протеинов в плазме крови, в норме удерживающих воду, последняя переходит в ткани, что сопровождается их последующим набуханием.
Кроме того, учитывая огромную роль белков в создании остова, каркаса всех клеток и органов, их дефицит приводит к нарушением структуры тканей: отмечается ломкость волос, ногтей, ухудшается качество кожи.
Наравне с пластической функцией, этот класс органических соединений выполняет и каталитическую. Уменьшение содержания пептидов приводит к снижению активности ферментов. В сущности, это настоящий транспортный коллапс на магистралях метаболизма: он замедляется, становиться вялотекущим.
Широкий спектр гормонов также обладает протеиновой природой — эндокринная система начинает страдать не меньше, чем все остальные. Характерны: отсутствие менструации, снижение продукции гормонов щитовидной железы (что подсыпает масло в и без того слабый огонь едва протекающих обменных процессов), замедление роста и развития из-за торможения синтеза гипофизом тропных гормонов — включая соматотропин.
Недостаток аминокислот обуславливает протеолиз тканевых белков — отмечается снижение мышечной массы, ее тонуса и силы.
Иными словами, нет такого органа, который не затрагивал бы дефицит белка — прогрессирует тотальная дисфункция на всех уровнях функционирования: от молекулярного до организменного.
Диагностика дефицита белка
Наиболее простым методом для первоначальной диагностики будет определение в биохимическом анализе крови такого показателя, как “общий белок”. Кроме того, необходимо установить уровень альбуминов в плазме крови — как правило, в условиях недостаточного поступления протеинов извне, печень компенсаторно увеличивает продукцию этой фракции.
Поскольку все ферменты, как уже ранее было сказано, имеют полипептидную основу, можно дополнительно опираться на АЛТ и АСТ — они достаточно часто назначаются специалистами по питанию и врачами. Однако здесь важно помнить все же о не менее главенствующей роли в функционировании данных энзимов витамина В6 и уметь правильно дифференцировать причины и факторы снижения этих показателей печеночной панели.

О нарушении процессов метилирования говорит повышение аминокислоты гомоцистеин в сыворотке крови — в таком случае, можно заподозрить полиморфизм в одном или нескольких генах-регуляторах фолатного цикла и сделать генетический тест. Несколько выше мы говорили о том, что эти “поломки” сопровождаются увеличением концентрации гистамина по причине снижения его обезвреживания — у пациентов отмечается аллергия, кожные высыпания и даже бронхиальная астма.
Низкую кислотность определяют путем проведения рН-метрии, обязательно сопровождающей фиброгастродуоденоскопию с взятием биопсийного материала — это принципиально важно для установления стадии процесса и профилактики развития в дальнейшем рака желудка. Из лабораторных тестов показательными будут следующие:
Аминокислоты в моче (тенденция к их снижению).
Уменьшение концентрации в крови металлов, всасывающихся в кислой среде: селена, марганца, цинка и магния.
Диагностика хеликобактера, обязательно проводимая с целью установления показаний для применения антибиотикотерапии, состоит из:
Определение антигенов бактерии в кале.
Дыхательные тесты с меченной мочевиной.
Определение антител в крови пациента.
Биопсия во время фиброгастродуоденоскопии с последующим гистологическим анализом.
В гастропанель, что довольно часто назначается для диагностики состояния слизистой желудка, входит, наравне с другими 3 биомаркерами, такой показатель как гастрин-17 — еще один стимулятор секреции соляной кислоты, вырабатываемый пилорическим отделом желудка. Его снижение указывает на высокую вероятность атрофического гастрита — аутоиммунного заболевания, сопровождающегося уменьшением количества функционирующих клеток эпителия.
О состоянии желчного пузыря, как возможного виновника нарушения активации ферментов поджелудочной железы (в том числе, и протеолитических) судят по:
Биохимическому анализу крови:
Прямой и непрямой билирубин.
ЛПВП, ЛПНП (дополнительно — апопротеин В).
Органическим кислотам в моче (для диагностики синдрома избыточного бактериального роста).
Увеличение числа колоний резидентов нашего кишечника сопровождается повышением активности процессов ферментации и, как следствие, — избыточной продукции газов. Это, в свою очередь, затрудняет секрецию панкреатического сока и желчи из-за повышенного в просвете кишечника давления.
Узи органов брюшной полости.
Как восполнить дефицит белка
Если белковая недостаточность не была вызвана алиментарными факторами, то первостепенное внимание должно быть направлено на причину, приводящую к их затрудненному расщеплению и всасыванию. Именно устранение этого этиологического фактора позволит обеспечить организм достаточным количеством протеинов — в противном случае, все съеденное попросту не будет усвоено.
Как правило, главенствующую роль занимает именно гипохлоргидрия — снижение секреции соляной кислоты париетальными клетками желудка. Если ее причиной является нарушение фолатного цикла, стоит начать работу именно с ним, принимая курс активных форм витаминов, задействованных в его механизмах:
При условии отсутствия поражения слизистой желудка, можно также рассмотреть употребление биологически активных добавок, стимулирующих секрецию соляной кислоты:
Йода, хлора и цинка.
Вдобавок, следует уменьшить или полностью исключить воздействие стрессовых факторов, приводящих к спазмированию сосудов. Повышайте тонус именно парасимпатической системы: как известно, именно блуждающему нерву подконтрольны процессы пищеварения. Принимайте ванны с магниевой солью, делайте расслабляющие практики вроде пилатеса, йоги, дыхательных упражнений.
В качестве адаптогенов для снижения уровня кортизола подойдут:
Изменение образа жизни играет ключевую роль в нормализации состояния всего организма. Больше двигайтесь — пускай 10 000 шагов станут для вас не чем-то сверхъестественным, а привычной, обыденной нормой. Элиминируйте максимально из своего рациона простые сахара: особенно, если причина нарушенной секреции пищеварительных соков кроется в синдроме избыточного грибкового или бактериального роста.
Ложитесь рано спать: в 23.00 уже начинается секреция мелатонина — гормона-антиоксиданта, отвечающего за молодость, красоту и активно противодействующего развитию оксидативного стресса. Кроме того, к циклам “сон-бодровствование” привязано и выделение других, не менее важных гормонов: ТТГ и соматотропина.
Белковая недостаточность
Белковая недостаточность – это болезненное состояние человеческого организма, которое связано либо с усиленным распадом белка, либо с его недостаточным поступлением и последующим усвоением. Действительно сильный дефицит поступления белков вместе с пищей может развиться у тех, кто недоедает долгое время, придерживается монодиет или же практикует вегетарианство. Вторичный дефицит белка связан с его повышенным распадом и наблюдается у людей, страдающих от различных заболеваний, включая наследственные нарушения обмена веществ, тяжелые инфекционные болезни, патологии почек и ожоги.
Организм использует белки в качестве строительного материала, поэтому даже при легкой форме белковой недостаточности, которая может проходить без всяких внешних симптомов, кожа становится слишком сухой, а рост волос и ногтей замедляется. При тяжелой форме дефицита белка нарушается нормальная работа всех систем и органов. Для детей белковая недостаточность особенно опасна: она может спровоцировать замедление роста, повлиять на формирование мышц и на развитие умственных способностей.
Крайне важно своевременно обнаруживать дефицит белка и устанавливать его причины: это позволит избежать осложнений, которые могут даже представлять угрозу жизни.
Симптомы недостатка белка
Легкие формы дефицита белка обычно проходят без всяких симптомов. Единственное исключение – наследственные дефициты определенных аминокислот, которые являются структурными компонентами белковых молекул. Характерные симптомы таких дефицитов обычно наблюдаются еще в раннем детстве.
Внешние симптомы белковой недостаточности:
- постоянно снижающийся вес;
- ногти становятся ломкими;
- волосы становятся ломкими, тускнеют, начинают выпадать;
- появляются отеки;
- кожа становится сухой и шелушится;
- появляется общая слабость.
Симптомы со стороны нервной системы:
- головные боли;
- перепады настроения;
- сильная утомляемость, вялость;
- бессонница;
- умственная активность снижается.
Симптомы со стороны костно-мышечной системы:
- слабость в мышцах;
- у детей замедляется рост;
- масса и видимый мышечный объем уменьшается;
- начинают болеть мышцы, реже – суставы.
Симптомы со стороны органов пищеварения:
- тошнота;
- боль живота, вздутие;
- повышается тяга к сладкому;
- нарушается стул (запор, который сменяет понос);
- печень увеличивается.
Кто в группе риска белковой недостаточности?
- Люди, живущие в странах с низким уровнем жизни;
- Вегетарианцы;
- Люди, которые соблюдают монодиету или же голодают, чтобы похудеть;
- Пациенты, страдающие от заболеваний почек;
- Пациенты, страдающие от заболеваний пищеварительных органов;
- Люди, обладающие наследственной предрасположенностью к различным нарушениям обмена белка;
- Люди, у которых дефицит веса связан с их профессией: гимнасты, модели, балерины;
- Люди старше 60 лет.
Диагностика белковой недостаточности
В первую очередь дефицит белка можно заподозрить у пациентов с низкой массой тела, а также у лиц с симптомами заболеваний, для которых дефицит белков характерен. Чтобы подтвердить данный диагноз, специалисты проводят различные исследования.
Лабораторные исследования, которые проводятся для диагностики дефицита белка:
- клинический анализ крови (код 2 и код 5);
- проба Реберга (код 749);
- креатинин (код 726) и мочевина (код 712) в суточной моче;
- белок общий в моче (код 713) и сыворотке (код 21) ;
- мочевина (код 19), креатинин (код 83) и белковые фракции (код 35) в сыворотке;
- копрограмма (код 765);
- глюкоза в плазме (код 73).
Дополнительные исследования, которые проводятся для диагностики дефицита белка:
- УЗИ органов брюшной полости (код 21314 или код 21313).
Лечение белковой недостаточности
При лечении белковой недостаточности основной упор делается на то, чтобы восполнить объем белка и нормализовать его обмен. Параллельно с этим специалисты лечат основную болезнь.
Само лечение может включать в себя следующие пункты:
- рекомендации сбалансированной богатой на белок диеты (в которой содержится необходимое количество животного белка). В рацион включается икра, рыба, яйца и мясо. Пациентам, страдающим от дефицита белка, который вызван сахарным диабетом, болезнями печени и почек, диету подбирает их лечащий врач, который учитывает особенности протекания основного заболевания. Иногда коррекции режима питания достаточно для того, чтобы вылечить легкую форму белковой недостаточности.
- медикаменты – пищеварительные ферменты, которые употребляют те пациенты, чей организм сам не справляется с выработкой достаточного количества таких ферментов.
Преэклампсия (гестоз) – симптомы и лечение
Что такое преэклампсия (гестоз)? Причины возникновения, диагностику и методы лечения разберем в статье доктора Дубовой А. А., акушера со стажем в 13 лет.


Определение болезни. Причины заболевания
Преэклампсия — осложнение второй половины беременности, при котором из-за увеличения проницаемости стенки сосудов развиваются нарушения в виде артериальной гипертензии, сочетающейся с потерей белка с мочой (протеинурией), отеками и полиорганной недостаточностью. [1]
По сути, причиной преэклампсии является беременность: именно при ней возникают патологические события, в конечном счете приводящие к клинике преэклампсии. У небеременных преэклампсии не бывает.
В научной литературе описывается более 40 теорий происхождения и патогенеза преэклампсии, а это указывает на отсутствие единых взглядов на причины ее возникновения. Установлено, что преэклампсии чаще подвержены молодые и нерожавшие женщины (от 3 до 10%). [2] У беременных с планируемыми вторыми родами риск ее возникновения составляет 1,4-4%. [3]
Пусковым моментом в развитии преэклампсии в современном акушерстве считается нарушение плацентации. Если беременность протекает нормально, с 7 по 16 неделю эндотелий (внутренняя оболочка сосуда), внутренний эластичный слой и мышечные пластинки участка спиральных артерий, вытесняется трофобластом и фибриносодержащим аморфным матриксом (составляющие предшественника плаценты — хориона). Из-за этого понижается давление в сосудистом русле и создается дополнительный приток крови для обеспечения потребностей плода и плаценты. Преэклампсия связана с отсутствием или неполным вторжением трофобласта в область спиральных артерий, что приводит к сохранению участков сосудистой стенки, имеющей нормальное строение. В дальнейшем воздействие на эти сосуды веществ, вызывающих вазоспазм, ведет к сужению их просвета до 40% от нормы и последующему развитию плацентарной ишемии. При нормальном течении беременности до 96% из 100-150 спиральных артерий матки претерпевают физиологические изменения, при преэклампсии же — всего 10%. Исследования подтверждают, что наружный диаметр спиральных артерий при патологической плацентации вдвое меньше, чем должно быть в норме. [4] [5]
Симптомы преэклампсии
Раньше в отечественном акушерстве то, что сейчас называется термином «преэклампсия», называлось «поздний гестоз», а непосредственно под преэклампсией понимали тяжелую степень позднего гестоза. Сегодня в большинстве регионов России перешли на классификацию, принятую ВОЗ. Ранее говорили о так называемом ОПГ-гестозе (отеки, протеинурия и гипертензия).
1. Артериальная гипертензия
Преэклампсия характеризуется систолическим АД>140 мм рт. ст. и/или диастолическим АД>90 мм рт. ст., измеряется дважды с интервалом 6 часов. По меньшей мере два повышенных значения АД являются основанием для диагностики АГ во время беременности. Если есть сомнения, рекомендуется провести суточное мониторирование АД (СМАД).
2. Протеинурия
Чтобы диагностировать протеинурию, необходимо выявить количественное определение белка в суточной порции (в норме при беременности — 0,3 г/л). Клинически значимая протеинурия во время беременности определена как наличие белка в моче ≥ 0,3 г/л в суточной пробе (24 часа) либо в двух пробах, взятых с интервалом в 6 часов; при использовании тест-полоски (белок в моче) — показатель ≥ «1+».
Умеренная протеинурия — это уровень белка > 0,3 г/24 часа или > 0,3 г/л, определяемый в двух порциях мочи, взятой с интервалом в 6 часов, или значение «1+» по тест-полоске.
Выраженная протеинурия — это уровень белка > 5 г/24 часа или > 3 г/л в двух порциях мочи, взятой с интервалом в 6 часов, или значение «3+» по тест-полоске.
Чтобы оценить истинный уровень протеинурии, нужно исключить наличие инфекции мочевыделительной системы, а патологическая протеинурия у беременных является первым признаком полиорганных поражений. [1]
3. Отечный синдром
Триада признаков, описанная Вильгельмом Цангемейстером в 1912 г. (ОПГ-гестоз), сегодня встречается лишь в 25-39%. Наличие отеков в современном акушерстве не считается диагностическим критерием преэклампсии, но важно, когда нужно оценить степень ее тяжести. Когда беременность протекает нормально, отеки встречаются в 50-80% случаев, амбулаторное ведение безопасно для лёгкого отечного симптома. Однако генерализованные, рецидивирующие отеки зачастую являются признаком сочетанной преэклампсии (нередко на фоне патологии почек). [6]
Американский врач-хирург и художник-иллюстратор Фрэнк Генри Неттер, которого справедливо прозвали «Микеланджело медицины», очень наглядно изобразил основные проявления преэклампсии. [7]
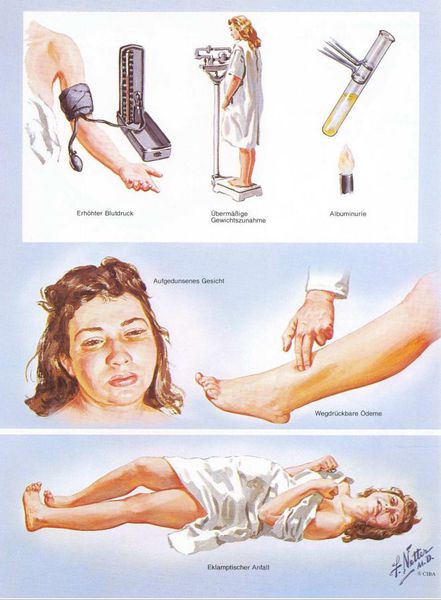
Патогенез преэклампсии
В ответ на ишемию при нарушении имплантации (см. рисунок) начинают активно вырабатываться плацентарные, в том числе антиангиогенные факторы и медиаторы воспаления, повреждающие клетки эндотелия. [8] Когда компенсаторные механизмы кровообращения на исходе, плацента с помощью прессорных агентов активно «подстраивает» под себя артериальное давление беременной, при этом временно усиливая кровообращение. В итоге этого конфликта возникает дисфункция эндотелия. [9]
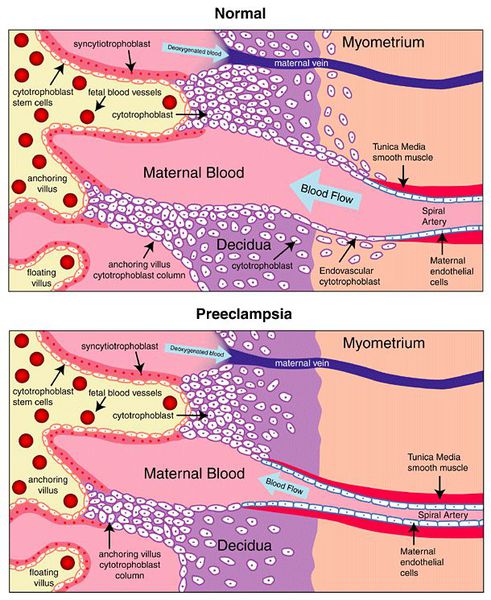
При развитии плацентарной ишемии активируется большое количество механизмов, ведущих к повреждению эндотелиальных клеток во всем организме, если процесс генерализуется. В результате системной эндотелиальной дисфункции нарушаются функции жизненно важных органов и систем, и в итоге мы имеем клинические проявления преэклампсии.
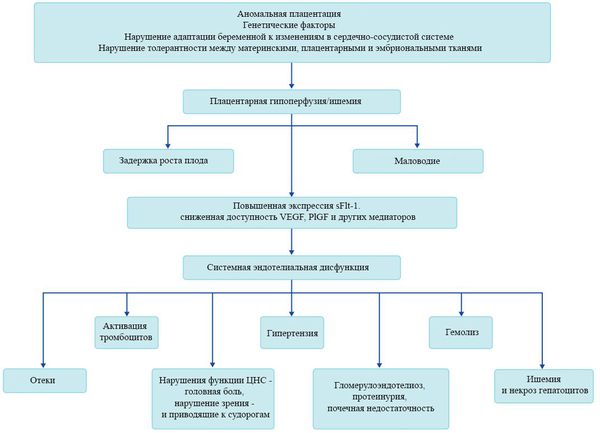
Нарушение плацентарной перфузии из-за патологии плаценты и спазма сосудов повышает риск гибели плода, задержки внутриутробного развития, рождения детей малых для срока и перинатальной смертности. [10] Кроме того, состояние матери нередко становится причиной прерывания беременности на раннем этапе — именно поэтому дети, родившиеся от матерей с преэклампсией, имеют более высокий показатель заболеваемости респираторным дистресс-синдромом. Отслойка плаценты очень распространена среди больных преэклампсией и связана с высокой перинатальной смертностью.
Классификация и стадии развития преэклампсии
| Умеренная преэклампсия | Сочетание двух основных симптомов: I. Систолическое АД 141-159 мм рт. ст. и/или диастолическое АД,91-99 мм рт. ст. при двукратном измерении с интервалом 6 часов II. Содержание белка в суточной моче 0,3 гр. и более |
|---|---|
| Тяжелая преэклампсия | I. Цифры АД 160/100 мм рт. ст. и выше, измеренного как минимум дважды с интервалом 6 часов в горизонтальном положении беременной и/или II. Протеинурия 5 грамм в сутки и более или 3 грамма в отдельных порциях мочи, полученных дважды с разницей 4 часа и более и/или присоединение к симптомам умеренной преэклампсии хотя бы одного из следующих: – олигурия, 500 мл в сутки и менее; – отек легких или дыхательная недостаточность, (цианоз); – боль в эпигастрии или правом подреберье, тошнота, рвота, ухудшение функции,печени; – церебральные нарушения (головная боль, нарушение сознания, ухудшения зрения — фотопсии); – тромбоцитопения (ниже 100х109/мл); – выраженная задержка роста плода; – начало до 32-34 недель и наличие признаков фетоплацентарной недостаточности. |
| Диагноз тяжелой преэклампсии устанавливается при наличии: – двух основных критериев тяжелой степени (АГ и протеинурия) или – одного основного критерия любой степени и дополнительного критерия. | |
Осложнения преэклампсии
Основные осложнения преэклампсии:
- гипертоническая энцефалопатия;
- геморрагический инсульт;
- субарахноидальное кровоизлияние;
- преждевременная отслойка плаценты (7-11%);
- ДВС-синдром (8%);
- острая гипоксия плода (48%) и внутриутробная гибель плода;
- отек легких (3-5%);
- легочно-сердечная недостаточность (2-5%);
- аспирационная пневмония (2-3%);
- нарушения зрения;
- острая почечная недостаточность (5-9%);
- гематома печени (1%);
- HELLP-синдром (10-15%);
- послеродовый психоз.
Диагностика преэклампсии
Диагностика преэклампсии заключается прежде всего в установлении наличия указанных выше симптомов. В ряде случаев представляет сложность дифференциальная диагностика преэклампсии и существовавшая до беременности артериальная гипертензия.
Дифференциальная диагностика гипертензивных осложнений беременности
| Клинические признаки | Хроническая гипертензия | Преэклампсия |
|---|---|---|
| Возраст | часто возрастные (более 30 лет) | часто молодые ( [1] |
- При умеренной преэклампсии беременную следует госпитализировать, чтобы уточнить диагноз и провести тщательный мониторинг ее состояния и плода, но при этом возможно продолжение вынашивания до 37 недель. При ухудшении состояния матери и плода показано родоразрешение.
- При тяжелой преэклампсии нужно сначала стабилизировать состояние матери, а затем решать вопрос о родоразрешении, желательно после проведения профилактики респираторного дистресс-синдрома плода, если беременность менее 34 недель.
2. Антигипертензивная терапия
Цель лечения — поддерживать АД в пределах, которые сохраняют на нормальном уровне показатели маточно-плодового кровотока и снижают риск развития эклампсии.
Антигипертензивную терапию следует проводить, постоянно контролируя состояние плода, потому что снижение плацентарного кровотока провоцирует у него прогрессирование функциональных нарушений. Критерием начала антигипертензивной терапии является АД ≥ 140/90 мм рт. ст.
Основные лекарственные средства, используемые для лечения АГ в период беременности:
- Метилдопа (допегит) — антигипертензивный препарат центрального действия, α2-адреномиметик (препарат первой линии);
- Нифедипин — блокатор кальциевых каналов (препарат второй линии);
- β-адреноблокаторы: метопролол, пропранолол, соталол, бисопролол;
- По показаниям: верапамил, клонидин, амлодипин.
3. Профилактика и лечение судорог
Для профилактики и лечения судорог основным препаратом является сульфат магния (MgSO4). Показанием для противосудорожной профилактики является тяжелая преэклампсия, если есть риск развития эклампсии. При умеренной преэклампсии — в отдельных случаях решает консилиум, потому что при этом повышается риск кесарева сечения и есть ряд побочных эффектов. Механизм действия магния объясняется нарушением тока ионов кальция в гладкомышечную клетку.
Кроме того, необходимо контролировать водный баланс, уделять внимание лечению олигурии и отека легких при их возникновении, нормализации функции ЦНС, реологических свойств крови, улучшение плодового кровотока.
Прогноз. Профилактика
Сегодня до 64% смертей от преэклампсии предотвратимы.
Основные факторы качественной и своевременной помощи:
- выявление женщин, входящих в группу высокого риска;
- качественное ведение беременности до клинических появлений осложнения беременности;
- адекватная тактика после клинической манифестации акушерского осложнения.
К сожалению, сегодня нет достаточно чувствительных и специфичных тестов, которые бы обеспечивали раннюю диагностику/выявление риска развития преэклампсии.
Факторы риска развития преэклампсии: [2]
1. антифосфолипидный синдром;
2. заболевания почек;
3. преэклампсия в анамнезе;
4. предстоящие первые роды;
5. хроническая гипертензия;
6. сахарный диабет;
7. жительницы высокогорных районов;
8. многоплодная беременность;
9. сердечно-сосудистые заболевания в семье (инсульты/инфаркты у близких родственников);
10. системные заболевания;
12. преэклампсия в анамнезе у матери пациентки;
13. возраст 40 лет и старше;
14. прибавка массы тела при беременности свыше 16 кг.
Установлено, что для преэклампсии характерен недостаточный ангиогенез — процесс образования сосудов. [11] В нем участвуют около 20 стимулирующих и 30 ингибирующих ангиогенез факторов, их список постоянно пополняется. Наиболее изучен и представляют особый интерес с точки зрения исследования патогенеза преэклампсии два проангиогенных фактора: сосудисто-эндотелиальный фактор роста (VEGF) и плацентарный фактор роста (PlGF), антиангиогенный фактор — Fms-подобная тирозинкиназа (Flt-1) и ее растворимая форма (sFlt-1).
Повышение содержания этого sFlt-1 с одновременным снижением VEGF и PlGF начинается за 5-6 недель до клинических проявлений преэклампсии. [12] Данный факт позволяет прогнозировать развитие преэклампсии у женщин из группы риска в первом триместре беременности. Однако другими исследователями отмечено, что несмотря на высокую чувствительность теста (96%), изолированное определение sFlt-1 не может быть использовано при диагностике преэклампсии из-за низкой специфичности. Таким образом, обнаружение изменений в соотношении уровня PlGF и sFlt-1 в течение беременности может сыграть важную вспомогательную роль для подтверждения диагноза преэклампсии.
Сегодня существуют коммерческие наборы, которые позволяют проводить иммуноферментное исследование, чтобы определить вероятность развития преэклампсии, на основании определения содержания PlGF (DELFIA Xpress PlGF kit, PerkinElmer; США), предложены скрининговые тесты для прогнозирования и ранней диагностики преэклампсии, основанные на определении соотношения sFlt-1 и PlGF (Elecsys sFlt-1/PlGF, Roche, Швейцария).
Из-за нарушения инвазии трофобласта увеличивается сосудистое сопротивление в маточной артерии и снижается перфузия плаценты. Повышение пульсационного индекса и систолодиастолического отношения в маточной артерии в 11-13 недель беременности является лучшим предиктором преэклампсии, и его настоятельно рекомендуется использовать в клинической практике у беременных из группы риска.
Из-за того, что исчерпывающая информация об этиологии и патофизиологии преэклампсии отсутствует, разработка эффективных профилактических мер представляет определенные трудности.
Сегодня доказан прием только 2 групп препаратов для профилактики преэклампсии: [1] [2]
• Аспирин в низких дозах (75 мг в день), начиная с 12 недель до родоразрешения. При этом необходимо брать письменное информированное согласие пациентки, поскольку согласно инструкции по применению, прием аспирина противопоказан в первом триместре.
• Беременным с низким потреблением кальция (
Норма общего анализа крови во время беременности. Гемоглобин, тромбоциты, гематокрит, эритроциты и лейкоциты при беременности. Клинический анализ крови во время беременности. Гематологические изменения при беременности.

Нормы анализа крови при беременности: краткое содержание статьи
- Значимыми гематологические изменениями в течение беременности являются физиологическая анемия, нейтрофилия, умеренная тромбоцитопения, повышение факторов свертывания крови и снижение фибринолиза.
- К 6-12 неделям беременности объем плазмы крови повышается примерно на 10-15 %. Самые быстрые темпы увеличения объема плазмы крови отмечаются в период с 30 по 34 недели беременности, после чего объем плазмы изменяется незначительно.
- Количество эритроцитов начинает увеличиваться на 8-10 неделях беременности и к концу беременности увеличивается на 20-30% (250-450 мл) относительно нормального уровня для небеременных женщин к концу беременности Значительное увеличение объема плазмы относительно увеличения количества гемоглобина и объема эритроцитов приводит к умеренному снижению уровня гемоглобина (физиологическая анемия беременных), что наблюдается у здоровых беременных.
- У беременных женщин возможно незначительное снижение количества тромбоцитов по сравнению со здоровыми небеременными женщинами.
- Количество нейтрофилов начинает расти на втором месяце беременности и стабилизируется во втором или третьем триместрах, в это время количество лейкоцитов. Абсолютное количество лимфоцитов не изменяется.
- Уровень некоторых факторов свертывания крови меняется в течение беременности.

В данной статье описаны гематологические изменения, происходящие во время беременности, наиболее важными из которых являются:
- Повышение объема плазмы крови и уменьшение гематокрита
- Физиологическая анемия, низкий гемоглобин
- Повышенные лейкоциты при беременности
- Нейтрофилия
- Умеренная тромбоцитопения
- Повышение прокоагулянтных факторов
- Уменьшение фибринолиза
Анализы, упоминаемые в статье
| Общий анализ крови | Подсчет ретикулоцитов | Гемостазиограмма |
| АЧТВ | Протромбиновое время | Антитромбин III |
| Протеин С | Агрегация с ристоцетином | Сывороточное железо |
| Ферритин | Трансферрин | Фибриноген |
| Антигрупповые антитела | Резус-антитела | Эритропоэтин |
Как сдать анализы крови и получить скидку 5%? Зайдите в интернет-магазин лабораторий ЦИР!
Объем плазмы крови
К 6-12 неделям беременности объем плазмы крови повышается примерно на 10-15 %. Самые быстрые темпы увеличения объема плазмы крови отмечаются в период с 30 по 34 недели беременности, после чего объем плазмы изменяется незначительно. В среднем объем плазмы крови увеличивается на 1100-1600 мл в триместр, и в результате объем плазмы за беременность увеличивается до 4700-5200 мл, что на 30 до 50% выше объема плазмы у небеременных женщин.
В течение беременности активность ренина плазмы крови имеет тенденцию повышаться, при этом уровень предсердного натрийуретического пептида несколько снижается. Это говорит о том, что увеличение объема плазмы вызвано недостаточностью сосудистой системы, к которой приводит системная вазодилатация (расширение сосудов во всем организме) и увеличение сосудистой емкости. Так как изначально увеличивается именно объем плазмы крови, то его воздействие на почечные и предсердные рецепторы приводит к противоположным воздействиям на гормональный фон (снижение активности ренина плазмы и увеличение натрийуретического пептида). Эта гипотеза также подтверждается наблюдением, что повышение потребления натрия не влияет на дальнейшее увеличение объема плазмы крови.
После родов объем плазмы сразу снижается, но вновь повышается через 2-5 дней, возможно из-за увеличения секреции альдостерона, происходящей в это время. Затем объем плазмы вновь постепенно снижается: через 3 недели после родов он все ещё повышен на 10-15% относительно нормального уровня для небеременных женщин, но обычно полностью приходит норме через 6 недель после родов.
Эритроциты при беременности, СОЭ при беременности
Количество эритроцитов начинает увеличиваться на 8-10 неделе беременности и к концу беременности увеличивается на 20-30% (250-450 мл) относительно нормального уровня для небеременных, в особенности у женщин, принимавших препараты железа во время беременности. Среди беременных, не принимавших препараты железа, количество эритроцитов может увеличиваться только на 15-20%. Продолжительность жизни эритроцитов немного снижается в течение нормальной беременности.
Уровень эритропоэтина при нормальной беременности повышается на 50% и его изменение зависит от наличия осложнений беременности. Повышение эритропоэтина в плазме приводит к увеличению количества эритроцитов, которые частично обеспечивают высокие метаболические требования в кислороде в течение беременности.
У женщин, не принимающих препараты железа, средний объем эритроцитов снижается во время беременности и в третьем триместре в среднем составляет 80-84 фл. Однако, у здоровых беременных и у беременных с умеренным дефицитом железа средний объем эритроцитов увеличивается примерно на 4 фл.
СОЭ при беременности увеличивается, что не имеет диагностического значения.
Анемия при беременности, гемоглобин при беременности, гематокрит при беременности, низкий гемоглобин при беременности
Снижение гемоглобина при беременности
Значительное увеличение объема плазмы относительно увеличения количества гемоглобина и объема эритроцитов приводит к умеренному снижению уровня гемоглобина (физиологическая анемия или низкий гемоглобин у беременных), что наблюдается у здоровых беременных. Самая большая разница между темпами роста объема плазмы крови и количества эритроцитов в материнском кровотоке, формируется в течение конца второго, начале третьего триместра (снижение гемоглобина обычно происходит в 28-36 недель беременности). Концентрация гемоглобина повышается благодаря прекращению увеличения объема плазмы и продолжения повышения количества гемоглобина. Наоборот, отсутствие появления физиологической анемии является фактором риска мертворождения.
Анемия при беременности
Установление четкого определения анемии у беременных женщин достаточно сложно, т.к. оно складывается из связанных с беременностью изменений в объеме плазмы крови и количества эритроцитов, физиологическими различиями в концентрации гемоглобина между женщинами и мужчинами и частотой использования препаратов железа при беременности.
- Центр профилактики и контроля заболеваний определил анемию, как уровень гемоглобина меньше, чем 110 г/л (гематокрит меньше 33%) в первом и третьем триместрах и менее, чем 105 г/л (гематокрит менее 32%) во втором триместре.
- ВОЗ определила анемию у беременных, как снижение гемоглобина меньше 110 г/л (11 г/дл) или гематокрит меньше 6,83 ммоль/л или 33%. Тяжелая анемия беременных определяется уровнем гемоглобина меньше 70 г/л и нуждается в медицинском лечении. Очень тяжелая анемия определяется уровнем гемоглобина меньше 40 г/л и нуждается в неотложной медицинской помощи в связи с риском застойной сердечной недостаточности.
Женщины со значением гемоглобина ниже этих уровней считаются анемичными и должны подвергаться стандартным анализам (общий анализ крови с оценкой мазка периферической крови, подсчет ретикулоцитов, сывороточное железо, ферритин, трансферрин). Если при обследовании отклонений не выявлено, то гемоглобин, сниженный до уровня 100 г/л можно считать физиологической анемией с большим разнообразием факторов, влияющих на нормальный уровень гемоглобина у конкретного человека.
Хроническая тяжелая анемия наиболее распространена у женщин в развивающихся странах. Снижение материнского гемоглобина ниже 60 г/л приводит к уменьшению объема амниотической жидкости, вазодилатации мозговых сосудов плода и изменение частоты сердечного ритма плода. Также повышается риск преждевременных родов, самопроизвольных выкидышей, рождения детей с низким весом и мертворождения. Кроме того, тяжелая анемия (гемоглобин меньше 70 г/л) повышает риск материнской смертности. Нет данных, что анемия повышает риск врожденных аномалий плода.
Тяжелая хроническая анемия обычно связана с недостаточным запасом железа (из-за недостаточного потребления с пищей или кишечных глистных инвазий), дефицитом фолатов (из-за недостаточного потребления и хронических гемолитических состояний, таких как малярия). Таким образом, предупреждение хронической анемии и улучшение исход беременности возможно при применении пищевых добавок и использовании мер контроля за инфекциями.
Проведение переливания крови и эритроцитарной массы (в тех местах, где доступно безопасное переливание крови) является разумным агрессивным лечением тяжелой формы анемии, особенно если есть признаки гипоксии плода.
Признаки физиологической анемии беременных исчезают через 6 недель после родов, когда объем плазмы возвращается к норме.
Потребность в железе
При одноплодной беременности потребность в железе составляет 1000 мг за беременность: примерно 300 мг для плода и плаценты и, примерно, 500 мг, если таковые имеются, для увеличения количества гемоглобина. 200 мг теряется через кишечник, мочу и кожу. Так как у большинства женщин нет адекватного запаса железа для обеспечения потребностей во время беременности, то железо обычно назначают в составе мультивитаминов, или как отдельный элемент. В целом, у женщин, принимающих препараты железа, концентрация гемоглобина выше на 1 г/дл, чем у женщин, не принимающих железо.
Потребность в фолатах
Ежедневная потребность в фолатах для небеременных женщин составляет 50-100 мкг. Повышение количества эритроцитов во время беременности приводит к увеличению потребностей в фолиевой кислоте, что обеспечивается увеличением дозы фолиевой кислоты до 400-800 мкг в сутки, для предотвращения дефектов нервной трубки у плода.
Тромбоциты при беременности
В большинстве случаев, количество тромбоцитов во время неосложненной беременности остается в пределах нормы для небеременных женщин, но так же у беременных женщин возможно и снижение количества тромбоцитов по сравнению со здоровыми небеременными женщинами. Количество тромбоцитов начинает расти сразу после родов и продолжает увеличиваться в течение 3-4 недель, пока не вернется к нормальным значениям.
Тромбоцитопения при беременности
Наиболее важное в акушерстве изменение в физиологии тромбоцитов при беременности – это тромбоцитопения, которая может быть связана с осложнениями беременности (тяжелая преэклампсия, HELLP-синдром), медикаментозными расстройствами (иммунная тромбоцитопения) либо может являться гестационной тромбоцитопенией.
Гестационная или случайная тромбоцитопения протекает бессимптомно в третьем триместре беременности у пациенток без предшествующей тромбоцитопении. Она не ассоциирована с материнскими, плодными или неонатальными осложнениями и спонтанно разрешается после родов.
Лейкоциты при беременности
При беременности наблюдается лейкоцитоз, в основном связанный с повышением циркулирующих нейтрофилов. Количество нейтрофилов начинает расти на втором месяце беременности и стабилизируется во втором или третьем триместрах, в это время количество лейкоцитов увеличивается с 9*10^9 /л до 15*10^9/л. Количество лейкоцитов снижается до референсного интервала для небеременных женщин к шестому дню после родов.
В периферической крови у беременных женщин может быть небольшое количество миелоцитов и метамиелоцитов. По данным некоторых исследований наблюдается увеличение количества юных форм нейтрофилов во время беременности. Тельца Доли (голубое окрашивание цитоплазматических включений в гранулоцитах) считаются нормой у беременных женщин.
У здоровых женщин при неосложненной беременности не происходит изменений абсолютного количества лимфоцитов и нет значительных изменений в относительном количестве Т- и В-лимфоцитов. Число моноцитов обычно не изменяется, число базофилов может немного снижаться, а число эозинофилов может несколько повышаться.
Факторы свертывания крови и ингибиторы
При нормальной беременности происходят следующие изменения уровней факторов свертывания крови, приводящие к физиологической гиперкоагуляции:
- Из-за гормональных изменений при беременности снижается активность общего протеин S антигена, свободного протеин S антигена и протеина S.
- Устойчивость к активированному протеину С повышается во втором и третьем триместрах. Данные изменения были выявлены при проведении тестов первого поколения с использованием чистой плазмы крови (т.е. не лишенной фактора V), однако этот тест редко применяется клинически и имеет лишь исторический интерес.
- Фибриноген и факторы II, VII, VIII, X, XII и XIII повышаются на 20-200%.
- Повышается фактор фон Виллебранда.
- Повышается активность ингибиторов фибринолиза, TAF1, PAI-1 и PAI-2. Так же заметно повышается уровень PAI-1.
- Уровни антитромбина III, протеина С, фактора V и фактора IX чаще всего остаются без изменений или повышаются незначительно.
Конечный результат данных изменений – повышение тенденции к тромбообразованию, увеличение вероятности венозных тромбозов в течение беременности и, особенно, в послеродовый период. Наряду с сокращением миометрия и повышением уровня децидуального тканевого фактора, гиперкоагуляция защищает беременную от чрезмерного кровотечения во время родов и отделения плаценты.
АЧТВ остается в норме в течение беременности, но может немного снижаться. Протромбиновое время может укорачиваться. Время кровотечения не изменяется.
Сроки нормализации активности свертывания крови в послеродовый период могут варьировать в зависимости от факторов, но все должно вернуться в нормальные рамки через 6-8 недель после родов. Гемостазиограмму не нужно оценивать ранее, чем через 3 месяца после родов и после завершения лактации для исключения влияния факторов беременности.
Влияние факторов приобретенной либо наследственной тромбофилии на беременность является сферой для исследований.
Послеродовый период
Гематологические изменения, связанные с беременностью, возвращаются в нормальные рамки через 6-8 недель после родов. Скорость и характер нормализации изменений, связанных с беременностью, конкретных гематологических показателей описаны выше в разделе, посвященном каждому параметру.
Что сдавать при подозрении на анемию: гемоглобин или ферритин?
Наиболее распространенные симптомы анемии встречаются у многих людей, однако большинство «списывает» их на хроническую усталость, планируя выспаться в отпуске или на праздниках. Игнорируя первые признаки анемии, можно сильно навредить своему организму. В этой статье мы расскажем, какие анализы помогут в её диагностике и в чём их отличия.
Что такое анемия?
Анемия, которую также называют малокровием, проявляется у человека снижением в крови уровня белка гемоглобина и/или снижением количества переносящих кислород красных кровяных клеток – эритроцитов. При развитии анемии в организме постепенно наступает кислородное голодание, а после истощения всех внутренних резервов железа начинается медленное нарушение работы всех систем организма.
Если врач ставит диагноз анемия, то это также означает наличие в организме скрыто протекающих патологических процессов, поскольку анемия не является самостоятельным заболеванием, а лишь указывает на другие проблемы. Условно говоря, анемию можно назвать «симптомом» инфекционного, воспалительного, онкологического или другого заболевания.
Причины и классификация анемии
Врачи классифицируют много видов анемии, которые для простоты понимая можно разделить на три группы.
К первой относятся состояния кровопотери, когда человек в результате несчастного случая потерял очень много крови или в организме происходит желудочно-кишечное или другое хроническое кровотечение. Ко второй категории анемии относятся состояния, при которых нарушается производство нормальных эритроцитов и синтез гемоглобина. К третьей – когда происходит ускоренное разрушение эритроцитов по каким-либо причинам.
Наиболее распространенной в мире считается железодефицитная анемия, которая составляет около 70-90% от всех случаев. К другим причинам развития анемии можно отнести дефицит витамина В12 и А, фолиевой кислоты, острые и хронические воспаления, а также другие патологические процессы в организме, которые влияют на синтез гемоглобина.
Симптомы, которые могут указывать на анемию
Для большинства видов анемии на первых этапах развития болезни в основном характерны следующие внешние симптомы:
- быстрая утомляемость,
- хроническая усталость,
- сонливость в течение дня,
- одышка, нарушение сердечного ритма,
- бледность и сухость кожных покровов,
- шум в ушах,
- головокружение и «мушки» перед глазами,
- ломкость ногтей, сильное выпадение волос и другие.
Лабораторная диагностика анемии
Различные показатели в анализе могут указывать на дефицит железа в организме, однако установить диагноз анемия можно только по комплексу лабораторных исследований. Обычно при подозрении на анемию пациенту назначается общий и биохимический анализы крови, где главными показателями являются:
Железо сыворотки – этот показатель отражает количество железа в кровотоке, резервный уровень запасов железа в тканях;
Ферритин – биомаркер железодефицитных состояний. В белке ферритине скапливаются запасы железа, которые не были использованы эритроцитами. Уровень этого резерва очень важно знать, поскольку истощение запасов постепенно приводит к развитию анемии. Хорошая новость заключается в том, что снижение ферритина происходит постепенно и ранняя диагностика человеку не допустить прогрессирования анемии;
Трансферрин – укажет на метаболизм железа, причину и вид развивающейся анемии;
Витамин В12 – поможет выяснить, всасывается ли поступающее из пищи железо. Длительный дефицит В12 опасен, поскольку витамин необходим для формирования клеток крови и правильной работы нервной системы;
Общая железосвязывающая способность сыворотки (ОЖСС) – определяет количество железа в организме и его взаимосвязи с другими белками. ОЖСС считается стабильным показателем, которые указывает на циркуляцию железа независимо от питания в течение дня (в течение суток уровень железа меняется, поэтому важно правильно интерпретировать общую «картину» в организме);
Показатели уровня гемоглобина и эритроцитов – среднее количество гемоглобина в эритроцитах. Изменения в этих показателях являются первыми «звоночками» для пациента и врача о патологических изменениях в организме.
В зависимости от общего состояния и жалоб пациента врач может назначить выполнение отдельных показателей крови или всего комплекса анализов.
«Симптомы анемии часто принимают за хроническую усталость или переутомление, однако важно быть на чеку: выявить ее и начать терапию. Ферритин – самый важный показатель при диагностике анемий» – комментирует эксперт по лабораторной диагностике LabQuest Латынина Юлия Сергеевна.
Профилактика и лечение анемии
Ранние стадии железодефицита можно скорректировать специальной диетой и приемом витаминов, однако важно вовремя обнаружить проблему, правильно подобрать дозировку витаминов и изменить рацион в сторону продуктов, богатых железом – мяса, рыбы и морепродуктов, яиц (желтков), бобовых, злаковых, орехов, семечек, свежих фруктов и овощей, а также сухофруктов.
Нередко для улучшения всасываемости железа из пищи врач назначает прием комплекса витаминов, который ускорит лечебный процесс. Рацион считается основным источником железа, однако организм не всегда может усвоить необходимое ему количество железа.
Тяжелые формы анемии лечатся комплексно и помимо витаминов и изменения рациона включает лекарственную терапию.
В лаборатории LabQuest можно провести полное обследование организма, если вы заподозрили у себя признаки анемии. По результатам выполняется бесплатная интерпретация выполненных анализов врачом-экспертом лабораторной диагностики.
Почечная недостаточность: симптомы, стадии, лечение
Почечная недостаточность – острое или хроническое заболевание, при котором нарушаются фильтрационная, выделительная и другие функции почек с развитием многочисленных сбоев в работе всего организма. При этом происходит отравление собственными токсичными продуктами обмена веществ, попавшими в кровь – уремия. Патология, особенно при стремительном развитии, может угрожать жизни больного и требует скорейшего лечения.
Распространенность хронической болезни почек во всем мире в среднем составляет 13,4%. В России почечная недостаточность встречается у 36% лиц старше 60 лет и у 16% граждан трудоспособного возраста.
Причины
Хроническая форма заболевания чаще всего развивается как осложнение других патологий. Ранее основной причиной почечной недостаточности считался гломерулонефрит. В настоящее же время ведущее место занимают гипертоническая болезнь и сахарный диабет, приводящие к поражению мелких сосудов, питающих почки, и стойкому нарушению кровообращения в них.
Острая почечная недостаточность (ОПН) более чем в половине случаев связана с травмой или перенесенными операциями на органах малого таза. Развивается она также при неправильном приеме лекарственных препаратов, нарушении работы сердца, кровотечениях и шоке, генерализованной аллергической реакции, обезвоживании, циррозе, отравлении, аутоиммунных и инфекционных болезнях, онкологии, переливании несовместимой крови.
Предрасполагают к нарушению работы почек следующие факторы:
- плохая экология;
- особенности питания;
- мужской пол;
- возраст старше 60 лет;
- избыточный вес;
- вредные привычки – табакокурение, злоупотребление алкоголем;
- генетическая предрасположенность;
- прием некоторых медикаментов;
- инфекционные и паразитарные поражения;
- хронические заболевания сердечно-сосудистой (в том числе – повышенное артериальное давление), мочевыделительной и эндокринной систем;
- нарушение жирового обмена, дислипидемия, гиперхолестеринемия, метаболический синдром.
Симптомы почечной недостаточности
Почки не только очищают кровь от токсинов и выводят их из организма, но также регулируют водно-солевой баланс, контролируют уровень артериального давления, тонус сосудов, концентрацию гемоглобина, помогают в сохранении здоровья опорно-двигательного аппарата и сердца. Учитывая такое многообразие функций органа, почечная недостаточность проявляется многочисленными симптомами, выраженность которых зависит от стадии и формы заболевания.
При остром повреждении почек на начальной стадии имеются лишь проявления основного заболевания. Далее следует самая тяжелая, олигурическая стадия, продолжительностью до 3-х недель, со снижением суточного объема мочи менее 500 мл. Первым признаком болезни становится резкое уменьшение или прекращение мочеиспускания.
Состояние часто обратимо (если обратимо основное заболевание или состояние, приведшее к ОПН) и при правильном лечении переходит в полиурическую стадию почечной недостаточности с восстановлением объема мочи. При этом самочувствие пациента нормализуется, но может развиваться обезвоживание организма и присоединиться инфекция. Стадия полного восстановления продолжается от шести месяцев до года. При выраженных нарушениях состояние переходит в хроническую форму.
Хроническая почечная недостаточность (ХПН) развивается медленно, в течение нескольких месяцев и даже лет, и приводит к стойким изменениям в органе. На начальном этапе специфических симптомов обычно не бывает, но иногда человек может заметить снижение объема выделяемой мочи. Либо единственным проявлением патологии может быть никтурия – частое ночное мочеиспускание.
По мере прогрессирования заболевания и присоединения уремии появляются и другие симптомы:
- апатия, общая слабость;
- жажда;
- неприятный вкус во рту;
- расстройство сна;
- ухудшение памяти;
- тошнота.
При отсутствии эффективного лечения присоединяются неврологические расстройства – непроизвольные подергивания мышц, снижение скорости реакций, а также обильная рвота, диарея, одышка, раздражение кожи и слизистых оболочек.
Осложнения
Болезнь осложняется появлением артериальной гипертензии, анемии, перикардита, аритмии и сердечной недостаточности, остеопороза, подагры, энцефалопатии, язвенной болезни желудка и двенадцатиперстной кишки, атеросклероза сосудов с развитием инфаркта и инсульта, синдрома беспокойных ног.
У детей почечная недостаточность приводит к задержке роста костной ткани.
Развитие почечной недостаточности у женщин во время беременности сопряжено с невынашиванием плода или формированием у него врожденных пороков.
Без лечения ХПН может закончиться смертью пациента от сердечно-сосудистых осложнений или уремической комы.
Диагностика
При первичном обследовании врач собирает анамнез заболевания, уточняя жалобы и давность симптомов. Далее проводятся осмотр кожных покровов, пальпация и поколачивание пальцами поясничной области.
Диагноз почечной недостаточности выставляется на основании следующих лабораторных и инструментальных исследований:
- Общий анализ мочи. Метод позволяет установить причину заболевания. Примесь крови, наличие эритроцитов в биоматериале свидетельствуют о мочекаменной болезни, гломерулонефрите, инфекции, новообразовании или травме. Лейкоциты указывают на инфекционный либо аутоиммунный процесс. Также может снижаться плотность мочи, присутствовать белок и восковидные цилиндры в ней.
- Клинический анализ крови. Повышение лейкоцитов и СОЭ говорит об инфекционном процессе, а уменьшение количества эритроцитов и гемоглобина в крови свидетельствует о сопутствующей почечной недостаточности анемии.
- Биохимический анализ крови. Увеличение в сывороточной крови мочевины и креатинина служит основным признаком почечной недостаточности. Эти вещества образуются в процессе распада белков и могут выводиться из организма исключительно с мочой. Прогрессирующий рост концентрации креатинина является главным диагностическим критерием тяжести заболевания. Сахарный диабет – одна из наиболее частых причин ХПН, однако и без эндокринных заболеваний при дисфункции почек есть склонность к умеренному повышению глюкозы в крови. Значительное увеличение уровня калия сопровождает выраженное нарушение функции почек, а высокая концентрация мочевой кислоты характерна для подагры и может привести к развитию мочекаменной болезни. Также в анализах крови при почечной недостаточности часто снижены альбумин, кальций, повышены триглицериды, щелочная фосфатаза, фосфор и холестерин.
- Биопсия почек. В сложных диагностических случаях может осуществляться забор небольшой части почечной ткани, которая подвергается последующему осмотру через микроскоп. Метод позволяет обнаружить характерные гистологические признаки ХПН – замещение клубочков почек рубцовой тканью.
- Ультразвуковое исследование органов малого таза. Важное место в диагностике почечной недостаточности занимает УЗИ почек. При ХПН отмечается их уменьшение (сморщивание) вместе с истончением наружного слоя. Также метод применяется для обнаружения новообразований, камней или кист.
- Компьютерная и магнитно-резонансная томография брюшной полости. Более точный способ визуализации опухолей, кист и конкрементов размером даже менее 5 мм.
Лечение почечной недостаточности
Обязательно проводятся диагностика и лечение патологии, послужившей причиной почечной недостаточности, а также устранение факторов риска.
Важную роль в терапии заболевания играют общие мероприятия, направленные на сохранение функции пораженного органа:
- Ограничение потребления жидкости.
- Отказ от приема ряда медикаментов.
- Коррекция питания. Диета при почечной недостаточности предполагает ограничение продуктов и напитков с повышенным содержанием натрия, фосфора, калия. Это поваренная соль, молочные продукты, печень, бобовые, орехи. Количество потребляемого белка также строго дозируется.
Консервативное лечение почечной недостаточности назначается врачом по результатам анализов. Для восстановления водно-солевого баланса внутривенно через капельницу вводятся специальные растворы. При задержке жидкости могут применяться мочегонные препараты. Также проводится терапия средствами, улучшающими кровообращение в органах малого таза, препаратами эритропоэтина, витамином D.
При выраженном или длительном нарушении фильтрационной функции почек пациенту показано аппаратное очищение крови – гемодиализ. Процедура проводится регулярно и позволяет убрать из организма токсичные вещества. Альтернативой выступает перитонеальный диализ, при котором в брюшную полость вводится с последующим удалением специальный раствор, забирающий на себя вредные вещества.
В случае тяжелого течения хронической почечной недостаточности выполняется операция по трансплантации почки. После пересадки проводится курс терапии препаратами, подавляющими иммунитет, чтобы не произошло отторжения донорской ткани.
Физиологические изменения показателей крови при беременности
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Изменение показателей коагулограммы и клинического анализа крови.
Изменения в коагулограмме (№№ 1, 2, 3, 4, 190, 164, 194)* беременной это физиологический процесс, связанный с появлением маточно-плацентарного круга кровообращения. Данный процесс связан с эволюционными, приспособительными реакциями организма беременной женщины. Организм женщины готовиться к затратам во время вынашивания плода и возможной кровопотери во время родов. При физиологическом течении беременности повышается активность прокоагулянтного звена. Уже на 3-м месяце беременности повышается фибриноген (это фактор I (первый) свёртывающей системы плазмы) и достигает максимальных значений накануне родов. Поэтому гинекологи обоснованно рекомендуют контролировать данный показатель во время беременности (1 раз в триместр, при наличии отклонений данных показателей чаще, 1 раз в неделю). В конце III триместра беременности в сыворотке повышается концентрация фибриногена, что может соответствовать усилению процессов внутрисосудистого свёртывания крови в маточно-плацентарном кровотоке.
Одновременно с повышением фибриногена и активности внешнего пути коагуляции повышается и активность внутреннего механизма свёртывания крови, при этом отмечается укорочение АЧТВ. Изменяются во время беременности и другие звенья системы гемостаза, такие как ингибитор свёртывания – антитромбин III, который имеет белковую структуру и обладает способностью ингибировать два и более факторов свёртывания фибринолиза и систему комплимента. По мере развития беременности происходит постепенное снижение активности антитромбина III. У беременных женщин, начиная с ранних сроков беременности, уровень D-димера в крови постепенно повышается. К концу срока беременности значения его могут быть в 3 – 4 раза выше исходного уровня. Волчаночный антикоагулянт не должен вырабатываться в норме у беременной. У беременных могут наблюдаться незначительные изменения общего анализа крови (№5)*. Такие показатели как гемоглобин, гематокрит могут снижаться во второй половине беременности, а лейкоциты повышаться (№119)*.
Изменения биохимических показателей
При беременности снижение общей концентрации белка в плазме крови обусловлено как частичным разведением, в результате задержки жидкости в организме, так и понижением концентрации альбумина (№10)*. Снижение альбумина обусловлено усиленным расходованием его на биосинтетические процессы. Однако нельзя исключить фактор повышения проницаемости сосудов и перераспределение жидкости и белка в межклеточном пространстве, нарушение гемодинамики. Изменение концентрации белков крови обнаруживаются и на протеинограмме. В первый и во второй триместр беременности уменьшается альбумин, что связано с физиологической гиперволемией. В третьем триместре выявляется увеличение альфа-1-глобулиновой фракции (№29)*, альфа-фетопротеина (№ 92)*. Альфа-2-глобулиновая фракция (№29)* может повышаться за счет белков, связанных с беременностью (начинают повышаться с 8-12 недели беременности и достигают максимума в III триместре). Бетта-глобулины (№29)* увеличиваются из-за роста концентрации трансферрина (№50)*. Также в большинстве случаев наблюдается незначительное увеличение уровня гамма-глобулинов (№29)*.
Незначительные изменения С-реактивного белка (№43)*, наблюдаемые чаще в ранние сроки беременности, могут быть реакцией организма на процессы пролиферации (усиленного деления клеток). Изменение объёма циркулирующей крови (ОЦК) и кровоснабжения почек приводит к изменениям азотовыделительной функции почек. Происходит задержка и накопление азотистых веществ, при этом количество мочевины (№26)* снижается, особенно в поздние сроки беременности в связи с повышением утилизации белка (положительный азотистый баланс).
Креатинин (№22)* снижается максимально в I – II триместре (его концентрация может снижаться почти в 1,5 раза), что связано с ростом объёма мышечной массы матки и плода. Уровень мочевой кислоты (№27)* чаще снижен за счёт усиления кровоснабжения почек, но даже незначительные нарушения функции почек могут привести к повышению данного показателя, и это расценивается как симптомы токсемии.
Существенно изменяется во время беременности липидный обмен (профиль №53) *. Так как усиливаются окислительные процессы, происходит повышенная утилизация холестерина в надпочечниках, плаценте. Это приводит к компенсаторной транзиторной гиперхолестеринемии, характеризующаяся увеличением показателей холестерола, ЛПВП. Уровень ЛВПП практически не изменяется. Повышение уровня эстрогенов приводит к гипертриглицеридемии, чему способствует гипопротеинемия, функциональный холестаз. При этом усиливается отложение жира в молочных железах, подкожно-жировой клетчатке, данный процесс также связан с увеличением перехода углеводов в жиры за счёт повышения выработки инсулина.
Показатель, отражающий уровень эндогенной секреции инсулина это С-пептид (№148)*. Показатели глюкозы (№16)* могут меняться незначительно, не достигая при этом уровня гипергликемии. Так как во время беременности повышается скорость клубочковой фильтрации и повышается проницаемость эпителия почечных канальцев, то периодически может наблюдаться глюкозурия (физиологическая). Чаще глюкозурия появляется на сроке беременности 27 – 36 недели. Особенностями минерального обмена у здоровых беременных по сравнению с небеременными женщинами является задержка в организме солей натрия, калия, хлора (№39)*, фосфора (№41)*, именно изменения показателей фосфора в организме беременной связано с повышением щёлочной фосфатазы (№36)*. Это обусловлено изменениями во время беременности со стороны костной ткани и изменениями со стороны печени. Как известно, во время беременности повышается потребность в солях кальция, которые необходимы для формирования скелета плода, и у мамы может наблюдаться дефицит кальция (№37)*. Гипокальциемия у беременных может проявляться в судорогах мышц, спастических явлениях. Повышение потребления железа во время беременности может приводить к анемии. Характеризуется данное состояние снижением железа (№48)*, ферритина (№51)*, витаминов: В12 (№117)*, фолиевой кислоты (№118)*. Изменения в эндокринной системе
Гипофиз, особенно передняя доля, увеличивается. Гормоны гипофиза АКТГ (№100)*, пролактин (№61)* играют большую роль в изменении обменных процессов организма беременной. Поэтому эти гормоны могут быть повышены. Плацента, также обладает гормональной активностью. В ней вырабатывается прогестерон (№63)*, эстриол свободный (№134)*, б-ХГЧ (№66)*, данные гормоны схожи по своему действию с соматотропином (№99)*. Претерпевает изменения и щитовидная железа, она несколько увеличивается, и в первой половине беременности отмечается её гиперфункция. Наблюдается повышение Т4 свободного (№55)*, при нормальных показателях Т4 (№54)*. Также отмечается усиление функции паращитовидных желёз относительным повышением паратгормона (№102)*. Выработка ФСГ (№59)* во время беременности снижается.
* – Номера исследований в Независимой лаборатории ИНВИТРО.
При подготовке статьи использовались данные «Бюллетеня Лабораторной Службы» №9, 2001 г.
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.


