Плазменные и клеточные факторы свертывания крови
В свертывании крови принимает участие комплекс белков, находящихся в плазме (плазменные факторы гемокоагуляции), большинство из которых является проферментами. В отличие от тромбоцитарных факторов они обозначаются римскими цифрами.
Плазменные факторы свертывания крови
1, или фибриноген, белок образуется в печени.Под влиянием тромбина переходит в фибрин
II, или протромбин, гликопротеид образуется в печени в присутствии витамина К.Под влиянием проторомбиназы переходит в тромбин (фактор II a)
III, или тромбопластии, состоит из белка апопротеина III и комплекса фосфолипидов. Входит в состав мембран многих тканей, является матрицей для развертывания реакций, направленных на протромбиназы по внешнему механизму.
IV, или ион Са², участвует в образовании комлексов, входит в состав протромбиназы, способствует агрегации тромбоцитов. Связывает гепарин. Принимает участие в ретракции сгустка и тромбоцитарной пробки. Тормозит фибринолиз.
V, или акцелератор-глобулин, белок образется в печени. Активируется тромбином (фактор IIa), Создает оптимальные условия для взаимодействия фактора Ха и протромбина (фактор II)
(VI, исключен из классификации)
VII, или проконвертин. Гликопротеид. Образуется в печени под влиянием витамина К. Принимает участие в формировании протромбиназы по внешнему механизму. Активируется факторами Xlla, Ха, 1Ха, II а и при взаимодействии с тромбопластином (фактор III)
VIII, или антигемофильный глобулин (АГГ), антигемофильный глобулин А. Гликопротеид. Синтезируется в печени, селезенке, лейкоцитах. Образует комплексную молекулу с фактором Виллебранда (FW) и специфическим антигеном. Активируется тромбином. Создает оптимальные условия для взаимодействия факторов 1Ха и X. При его отсутствии возникает заболевание гемофилия А
VIII: FW. Компонент комплекса фактора VIII: Образуется эндотелиальными клетками. Обеспечивает устойчивость фактора VIII: С в кровотоке и необходим для адгезии тромбоцитов. При его недостатке развивается болезнь Виллебранда, сопровождающаяся нарушением сосудисто-тромбоцитарного гемостаза
IX, или Кристмас-фактор, антигемофильный фактор В. Гликопротеид. Образуется в печени под влиянием витамина К. Активируется факторами Xla, VIIa и IIа. Переводит фактор Х в Ха. При его отсутствии возникает заболевание гемофилия В
X, или Стюарт Прауэр-фактор. Гликопротеид. Образуется в печени, под влиянием витамина К. Фактор Ха, являясь протромбиназой, активируется факторами VIla и 1Ха. Переводит фактор II в IIа
XI, или плазменный предшественник тромбопластина. Гликопротеид. Предполагают, что образуется в печени. Активируется фактором ХIIа, калликреином совместно с высокомолекулярным кининогеном (ВМК)
XII, или фактор Хагемана. Белок. Предполагают, что образуется эндотелиальными клетками, лейкоцитами, макрофагами. Активируется отрицательно заряженными поверхностями, адреналином, калликреином. Запускают внешний и внутренний механизм образования протромбиназы и фибринолиза, активирует фактор XI и прекалликреин
XIII, или фибринстабилизирующий фактор (ФСФ), фибриназа. Глобулин. Синтезируется фибробластами и мега-кариоцитами. Стабилизирует фибрин. Необходим ддя нормального течения репаративных процессов
Фактор Флетчера или прекалликреин. Белок. Участвует в активации фактора XII, плаз-миногена и ВМК
Фактор Фитцджеральда, высокомолекулярный кининоген (ВМК). Образуется в тканях. Активируется калликреином, принимает участие в активации факторов XII, XI и фибринолиза.
Активация плазменных факторов происходит главным образом за счет протеолиза и сопровождается отщеплением пептидных ингибиторов. Активное состояние фактора обозначается присоединением к его номеру буквы «а» (фактор IIа, Va, VIla и т.д.). Плазменные факторы делят на 2 группы: витамин К-зависимые (образуются преимущественно в печени под влиянием витамина К) и витамин К-независимые (для синтеза которых витамин К не требуется).
В эритроцитах обнаружены многие соединения, аналогичные тромбоцитарным факторам. Важнейшим из них является фосфолипидный фактор, или частичный тромбопластин (напоминает фактор Рз), который входит в состав мембраны. Кроме того, эритроциты содержат большое количество АДФ, фибриназу и другие факторы. При травме сосуда около 1% наименее стойких эритроцитов вытекающей крови разрушается, что способствует образованию тромбоцитарной пробки и фибринового сгустка.
Особенно велика роль эритроцитов в свертывании крови в случае их массового разрушения (переливание несовместимой крови, резус-конфликт матери и плода, гемолитические анемии и др.)
Лейкоциты содержат факторы свертывания, получившие наименование лейкоцитарных. В частности, моноциты и макрофаги при стимуляции антигеном синтезируют белковую часть тромбопластина — апопротеин III, что значительно ускоряет свертывание крови. Эти же клетки являются продуцентами витамин К-зависимых факторов свертывания — II, VII, IX и X. Приведенные факторы являются одной из основных причин возникновения диссеминированного (распространенного) внутрисосудисгого свертывания крови (ДВС-синдром) при многих воспалительных и инфекционных заболеваниях, что значительно отягощает течение патологического процесса, а иногда служит причиной смерти больных.
Важная роль в процессе свертывания крови отводится тканевым факторам, к которым в первую очередь относится тромбопластин (фактор ‘3). Концентрация тромбопластина высока в коре большого мозга, легких, плаценте и стимулированном антигенами эндотелии сосудов. При разрушении тканей и стимуляции эндотелия большое количество тромбопластина поступает в кровоток, что может вызывать развитие ДВС-синдрома.
Что такое гемостазиограмма?
Что такое гемостазиограмма?
Система свертывания крови. Лабораторная диагностика нарушений гемостаза. Интерпретация результатов. Особенности гемостаза во время беременности. Молекулярно-генетические анализы. Функция тромбоцитов.
Анализы на свертываемость крови важны для выявления возможных нарушений в системе гемостаза, а также для оценки эффективности проводимой терапии, подбора дозы и контроля терапии для предотвращения осложнений. Только с помощью лабораторной диагностики можно поставить точный диагноз и адекватно оценить действие лекарств.
Качественная лабораторная диагностика очень важна для принятия правильного решения лечащим врачом. Мы используем реактивы зарубежного производства высокого качества, проводим внутренний контроль качества и участвуем в программах внешнего контроля качества. Комплексные тесты формируются совместно с врачами-клиницистами, которые являются нашими строгими экспертами. Мы выдаем не только результаты, но и развернутое заключение врача-лаборанта по гемостазиограмме, определению волчаночного антикоагулянта, агрегации тромбоцитов.
Необходимость в проведении исследований гемостаза может возникнуть у человека любого возраста и пола! Наша лаборатория проводит обследование женщин, готовящихся к беременности и беременных; женщин, принимающих противозачаточные препараты; пациентов, получающие терапию препаратами аспирина и гепарина. Поэтому мы обеспечиваем отличное качество исследований, которое высоко ценится врачами-клиницистами.
Наша лаборатория предлагает различные виды исследования гемостаза. Выполняются как скрининговые тесты, такие как базовая коагулограмма, так и сложные исследования, например, индуцированная агрегация тромбоцитов.
Анализы берутся во всех клиниках ЦИР, что удобно для наших пациентов. А результаты анализов можно получить по электронной почте или с курьером.
Система гемостаза осуществляет две основные функции: поддержание крови в жидком виде внутри сосудов с одной стороны, и с другой стороны быстрое реагирование на повреждение сосудов (образование тромбов для остановки кровотечения). В свертывании крови участвуют: сосудистая стенка, клетки крови, белки плазмы крови. Система плазменного гемостаза состоит из трех взаимосвязанных систем – системы свертывания (коагуляции), противосвертывающей системы (антикоагулянтной) и системы фибринолиза (растворения тромба).
Показатели коагуляции характеризуют каскад, приводящий к образованию фибрина – белка, составляющего основу тромба. Запуск свертывания может происходить в результате активации внутреннего и внешнего путей.
Нарушения свертывания крови:
- гипокоагуляция – снижение свертывания крови, проявляется кровоточивостью,
- гиперкоагуляция – повышение свертывания крови, проявляется тромбозами,
- тромбофилия – склонность к образованию тромбов.
Оценка свертывания крови: гемостазиограмма (коагулограмма). Содержание клеточных элементов крови. Клеточные элементы (тромбоциты, эритроциты, лейкоциты) обеспечивают формирование первичной пробки в зоне повреждения. Активация клеточных элементов является важным фактором запуска плазменного звена гемостаза. Включение отдельных показателей общего анализа крови в гемостазиограмму помогает правильно интерпретировать отклонения в анализе и клиническую картину.
Скрининговые тесты для исследования плазменного звена гемостаза – АЧТВ, протромбиновое время, протромбин по Квику, МНО, тромбиновое время, фибриноген.
АЧТВ или АПТВ (активированное частичное или парциальное тромбопластиновое время) – оценка внутреннего пути свертывания крови, активатором являются фосфолипиды. АЧТВ – это время, необходимое для свертывания плазмы при добавлении факторов внутреннего пути (кальция, фосфолипидов и каолина).
Удлинение АЧТВ наблюдается при дефиците факторов свертывания XII, XI, IX, VIII, кининогена, прекалликреина, факторов V, X, протромбина и фибриногена, антифосфолипидном синдроме, ДВС-синдроме.
Укорочение АЧТВ наблюдается при гиперкоагуляции, в том числе, во время беременности, в 1 фазе ДВС-синдрома.
Свойство АЧТВ удлиняться при избытке гепарина дает возможность наблюдать за терапией препаратами гепаринового ряда. Адекватное удлинение АЧТВ – до 2,5 раз. При изменении важное значение имеет контроль АЧТВ при коррекции нормальной плазмой. Так, коррекция повышенного АЧТВ нормальной плазмой говорит о том, что в плазме снижена концентрация факторов свертывания крови. Отсутствие коррекции может говорить о наличии ингибиторов свертывания крови (например, волчаночного антикоагулянта).
Протромбиновое время – время, необходимое для свертывания плазмы при добавлении кальция и тканевого фактора. Метод воспроизводит внешний путь свертывания крови с оценкой так называемого протромбинового комплекса – факторов VII, X, протромбина. Во внешнем пути принимают участие витамин К-зависимые факторы свертывания, поэтому ПВ используется для оценки терапии непрямыми антикоагулянтами.
Существует два стандартных способа представления результатов этого теста:
Протромбин по Квику отражает содержание факторов свертывания в процентах, служит для оценки внешнего пути свертывания.
МНО (INR) – международное нормализованное отношение. Проводится сравнение свертывания крови пациента со специальной плазмой, нормализованной по международному стандарту, что позволяет с большей степенью достоверности оценивать состояние внешнего пути плазменного гемостаза у пациента. Это имеет важное значение для оценки действия лекарств и подбора дозы.
Удлинение ПВ (ПВ и МНО повышаются, Протромбин по Квику снижается) может указывать на врожденный дефицит факторов II, V, VII, X, заболевания печени с нарушением её функции, дефицит витамина К (мальабсорбция, холестаз, особенности питания, дисбактериоз кишечника), лечением непрямыми антикоагулянтами, снижение или изменение структуры фибриногена.
Укорочение ПВ (ПК и МНО снижаются, Протромбин по Квику повышается) указывает на гиперкоагуляцию, в т.ч. при беременности и после родов, а также при приёме некоторых противозачаточных средств.
Фибриноген – белок крови, который синтезируется в печени. При запуске свертывания крови фибриноген полимеризуется с образованием фибрина. Повышение концентрации фибриногена свидетельствует о состоянии тромбофилии, наблюдается при ожогах, в последние месяцы беременности, после родов, при инфаркте миокарда, после хирургических вмешательств. Кроме того, уровень фибриногена повышен при воспалительных процессах, стрессе. Снижение количества фибриногена бывает наследственным и приобретенным (нарушение функции печени).
Тромбиновое время (ТВ) – время, в течение которого из фибриногена образуется фибрин. Этот показатель оценивается скоростью свертывания крови при добавлении тромбина. Скорость образования фибрина зависит от количества и качества фибриногена и присутствия в крови антикоагулянтов.
ТВ увеличивается при снижении концентрации фибриногена и изменениях его молекулы, присутствии ингибиторов фибринообразования, аутоантител к тромбину, парапротеинемии, повышенном содержании продуктов деградации фибриногена/фибрина, наличии гепарина и других состояниях. Снижение ТВ наблюдается в первой стадии ДВС-синдрома и значительном повышении фибриногена в крови.
Таким образом, грамотная комплексная оценка результатов АЧТВ, показателей протромбинового времени, тромбинового времени и фибриногена позволяет выявить наличие тех или иных нарушений, оценить эффективность проводимой терапии, заподозрить риск тромбозов или кровотечений, позволяет назначить необходимые препараты и не допустить передозировки лекарств.
Антикоагулянтная система. Случайный запуск механизма свертывания не допускает специальная система, в которую входит несколько важных белков: антитромбин III, протеин С и протеин S. Адекватная работа противосвертывающей системы является важным условием поддержания жидкого состояния крови внутри сосудов. Снижение активности факторов противосвертывающей системы может быть причиной тяжелых тромботических осложнений. В нашей лаборатории проводится определение антитромбина III и протеина С.
Особенности свертывания крови во время беременности
Во время беременности появляется третий круг кровообращения – плацентарный. Плацента является органом, который разделяет организмы матери и плода. Особенностью является то, что в плаценте отсутствует капиллярное звено со стороны матери. Прямо из спиральных артерий кровь матери поступает в межворсинчатое пространство и ворсины хориона омываются материнской кровью. Через вены децудиальной оболочки кровь возвращается обратно в кровоток матери. То есть плацента представляет собой границу взаимодействия двух организмов, агрессивную фазу, которая приводит к активации тромботических механизмов. Скрытые тенденции нарушения гемостаза проявляются в артериях плаценты с большей степенью вероятности и приводят к дополнительному избыточному свертыванию крови. Многие осложнения беременности возникают из-за тромбоза спиральных артерий. При беременности возрастает активность факторов внутреннего пути свертывания крови, что проявляется укорочением АЧТВ. При беременности повышается количество фибриногена, повышается уровень РКМФ и D-димеров. Несмотря на эти изменения, при нормальной беременности патологической активации гемостаза не наблюдается, эти изменения относятся к адаптивным. Оценку свертывания крови желательно проводить на разных сроках беременности. Очень важно, чтобы первое исследование свертывание крови проводилось на ранних сроках беременности. Тогда вероятность рисков при своевременном назначении лекарств будет минимальна. Избыточное свертывание крови приводит к увеличению отложения фибрина в плаценте и преждевременному старению плаценты. Назначение специфической терапии позволяет затормозить этот процесс и не допустить преждевременного старения плаценты.
Гемостазиограмма является скрининговым анализом и отражает состояние свертывания крови в момент сдачи крови. Поэтому гемостазиограмма может не показать те риски, механизмы которых еще не включились. Для оценки рисков тромбофилии, которая является причиной невынашивания беременности, тяжелого гестоза, инфаркта миокарда, инсульта и других тромбозов, требуется проведение других исследований. Особую опасность в акушерско-гинекологической практике представляют скрытые наследственные факторы риска нарушений свертывания крови. В момент зачатия каждый из нас получает генетический материал от родителей. В этом генетическом материале могут быть переданы гены, наличие которых связано с повышенным риском того или иного состояния. Если оба родителя передают такой ген, это состояние называется гомозиготностью, если только один – гетерозиготностью. Для некоторых генов достаточно гетерозиготного состояния, для влияния других – гомозиготного. Для того, чтобы узнать, есть ли патологические гены и в каком они состоянии (гетеро- или гомозиготном), проводятся молекулярно-генетические исследования.
В Лаборатории ЦИР для оценки рисков развития патологии в системе гемостаза проводятся такие молекулярно-генетические исследования:
- Полиморфизм генов системы гемостаза – 12 факторов, в том числе, часто встречающиеся лейденская мутация (ф.V), мутация гена протромбина, мутация МТГФР.
- Полиморфизм генов сосудистого тонуса. Сосуды играют важную роль в развитии тромбозов и повышения артериального давления (гипертонии). Оценка рисков повышения артериального давления обязательно проводится при невынашивании беременности, антенатальной гибели плода, при наличии артериальной гипертензии у женщины или у родственников.
- Полиморфизм генов функции эндотелия. Выстилка сосудов – эндотелий – также играет огромную роль в свертывании крови. Именно эндотелий является поверхностью, где формируется тромб. В норме в эндотелии вырабатываются вещества, препятствующие ненужному свертыванию крови. Но при нарушении выработки этих веществ возникают тромбозы. Вам нужно сдать эти анализы, если Вы ответите «да» хотя бы на один из этих пунктов:
- При наличии в прошлом двух и более остановок развития плода на ранних сроках беременности
- при нескольких неудачных попытках IVF (ВРТ, ЭКО, ИКСИ и др.)
- при наличии в прошлом тяжелых осложнений беременности (тяжелых форм позднего токсикоза внутриутробной гибели плода, задержки развития плода)
- при обнаружении повышения уровня антифосфолипидных антител и/или повышения уровня гомоцистемна
- при наличии в прошлом нарушений свертывания крови (тромбозы) при наличии родственников с тромботическими осложнениями в возрасте до 50 лет (тромбозы глубоких вен, тромбоэмбопия легочной артерии, инсульт, инфаркт миокарда, внезапная смерть)
Плазменные и клеточные факторы свертывания крови
В свертывании крови принимает участие комплекс белков, находящихся в плазме (плазменные факторы гемокоагуляции), большинство из которых является проферментами. В отличие от тромбоцитарных факторов они обозначаются римскими цифрами.
Плазменные факторы свертывания крови
1, или фибриноген, белок образуется в печени.Под влиянием тромбина переходит в фибрин
II, или протромбин, гликопротеид образуется в печени в присутствии витамина К.Под влиянием проторомбиназы переходит в тромбин (фактор II a)
III, или тромбопластии, состоит из белка апопротеина III и комплекса фосфолипидов. Входит в состав мембран многих тканей, является матрицей для развертывания реакций, направленных на протромбиназы по внешнему механизму.
IV, или ион Са², участвует в образовании комлексов, входит в состав протромбиназы, способствует агрегации тромбоцитов. Связывает гепарин. Принимает участие в ретракции сгустка и тромбоцитарной пробки. Тормозит фибринолиз.
V, или акцелератор-глобулин, белок образется в печени. Активируется тромбином (фактор IIa), Создает оптимальные условия для взаимодействия фактора Ха и протромбина (фактор II)
(VI, исключен из классификации)
VII, или проконвертин. Гликопротеид. Образуется в печени под влиянием витамина К. Принимает участие в формировании протромбиназы по внешнему механизму. Активируется факторами Xlla, Ха, 1Ха, II а и при взаимодействии с тромбопластином (фактор III)
VIII, или антигемофильный глобулин (АГГ), антигемофильный глобулин А. Гликопротеид. Синтезируется в печени, селезенке, лейкоцитах. Образует комплексную молекулу с фактором Виллебранда (FW) и специфическим антигеном. Активируется тромбином. Создает оптимальные условия для взаимодействия факторов 1Ха и X. При его отсутствии возникает заболевание гемофилия А
VIII: FW. Компонент комплекса фактора VIII: Образуется эндотелиальными клетками. Обеспечивает устойчивость фактора VIII: С в кровотоке и необходим для адгезии тромбоцитов. При его недостатке развивается болезнь Виллебранда, сопровождающаяся нарушением сосудисто-тромбоцитарного гемостаза
IX, или Кристмас-фактор, антигемофильный фактор В. Гликопротеид. Образуется в печени под влиянием витамина К. Активируется факторами Xla, VIIa и IIа. Переводит фактор Х в Ха. При его отсутствии возникает заболевание гемофилия В
X, или Стюарт Прауэр-фактор. Гликопротеид. Образуется в печени, под влиянием витамина К. Фактор Ха, являясь протромбиназой, активируется факторами VIla и 1Ха. Переводит фактор II в IIа
XI, или плазменный предшественник тромбопластина. Гликопротеид. Предполагают, что образуется в печени. Активируется фактором ХIIа, калликреином совместно с высокомолекулярным кининогеном (ВМК)
XII, или фактор Хагемана. Белок. Предполагают, что образуется эндотелиальными клетками, лейкоцитами, макрофагами. Активируется отрицательно заряженными поверхностями, адреналином, калликреином. Запускают внешний и внутренний механизм образования протромбиназы и фибринолиза, активирует фактор XI и прекалликреин
XIII, или фибринстабилизирующий фактор (ФСФ), фибриназа. Глобулин. Синтезируется фибробластами и мега-кариоцитами. Стабилизирует фибрин. Необходим ддя нормального течения репаративных процессов
Фактор Флетчера или прекалликреин. Белок. Участвует в активации фактора XII, плаз-миногена и ВМК
Фактор Фитцджеральда, высокомолекулярный кининоген (ВМК). Образуется в тканях. Активируется калликреином, принимает участие в активации факторов XII, XI и фибринолиза.
Активация плазменных факторов происходит главным образом за счет протеолиза и сопровождается отщеплением пептидных ингибиторов. Активное состояние фактора обозначается присоединением к его номеру буквы «а» (фактор IIа, Va, VIla и т.д.). Плазменные факторы делят на 2 группы: витамин К-зависимые (образуются преимущественно в печени под влиянием витамина К) и витамин К-независимые (для синтеза которых витамин К не требуется).
В эритроцитах обнаружены многие соединения, аналогичные тромбоцитарным факторам. Важнейшим из них является фосфолипидный фактор, или частичный тромбопластин (напоминает фактор Рз), который входит в состав мембраны. Кроме того, эритроциты содержат большое количество АДФ, фибриназу и другие факторы. При травме сосуда около 1% наименее стойких эритроцитов вытекающей крови разрушается, что способствует образованию тромбоцитарной пробки и фибринового сгустка.
Особенно велика роль эритроцитов в свертывании крови в случае их массового разрушения (переливание несовместимой крови, резус-конфликт матери и плода, гемолитические анемии и др.)
Лейкоциты содержат факторы свертывания, получившие наименование лейкоцитарных. В частности, моноциты и макрофаги при стимуляции антигеном синтезируют белковую часть тромбопластина — апопротеин III, что значительно ускоряет свертывание крови. Эти же клетки являются продуцентами витамин К-зависимых факторов свертывания — II, VII, IX и X. Приведенные факторы являются одной из основных причин возникновения диссеминированного (распространенного) внутрисосудисгого свертывания крови (ДВС-синдром) при многих воспалительных и инфекционных заболеваниях, что значительно отягощает течение патологического процесса, а иногда служит причиной смерти больных.
Важная роль в процессе свертывания крови отводится тканевым факторам, к которым в первую очередь относится тромбопластин (фактор ‘3). Концентрация тромбопластина высока в коре большого мозга, легких, плаценте и стимулированном антигенами эндотелии сосудов. При разрушении тканей и стимуляции эндотелия большое количество тромбопластина поступает в кровоток, что может вызывать развитие ДВС-синдрома.
Плазменные и клеточные факторы, участвующие в процессе свертывания крови

Препараты факторов свертывания крови (ФСК) используются в качестве заместительной терапии при дефиците эндогенных факторов свертывания крови в организме человека. По данным Всемирной федерации гемофилии (ВФГ), количество больных, страдающих гемофилией в мире, приближается к 500 тысячам человек, в том числе в России – около 14 000 человек [5]. Наиболее распространенные виды гемофилии связаны с дефицитом плазменного антигемофильного глобулина А (фактор VIII) или плазменного тромбопластинового компонента (фактор Кристмаса, фактор IX).
Для лечения гемофилии различных этиологий применяют препараты плазменных или рекомбинантных факторов крови в виде концентрированных монопродуктов или комплексных препаратов, включающих несколько факторов свертывания.
Концентраты ФСК, полученные из плазмы крови человека по данным ВФГ характеризуются высокой степенью клинической эффективности и представляют наименьшую опасность для применения у пациентов [5].
Преимуществом и отличительной особенностью плазменных факторов по сравнению с их рекомбинантными аналогами является гомологичность активных компонентов, входящих в состав препарата, что снижает риск развития аллергических реакций при их применении.
В Российской государственной фармакопее XIII издания представлены требования к оценке качества плазменных ФСК [3]. В то же время действующие нормативные документы, отражающие критерии оценки эффективности отдельных препаратов крови, вирусной безопасности плазменных продуктов и риск трансмиссионных заболеваний не содержат единых требований к объему и содержанию инструкций по медицинскому применению (ИМП). В связи с этим показания по применению данные препаратов, а также информация об их безопасности, могут значительно отличаться в отношении для плазменных ФСК одной группы, разработанных и зарегистрированных различными производителями. Учитывая это, анализ имеющейся информации и гармонизация требований, предъявляемых к качеству, эффективности и безопасности плазменных ФСК является актуальной задачей.
Цель данного исследования – проведение аналитический обзора номенклатуры плазменных ФСК, зарегистрированных в Российской Федерации, анализа имеющейся информации об эффективности и безопасности данных препаратов, проведенный на основании действующих инструкций по медицинскому применению, нормативно-технической документации по оценке безопасности лекарственных препаратов биологического происхождения.
На сегодняшний день в Российской Федерации зарегистрировано 24 препарата плазменных ФСК (таблица).
Зарегистрированные препараты плазменных факторов свертывания крови
Группа препаратов фактора VII
Бакстер АГ, Австрия
Группа препаратов фактора VIII
8 производителей, Россия
Грифолз Терапьютикс Инк. , США
Реколи НВ, Нидерландские Антиллы
Октафарма Фармацевтика Продуктионсгес м.б.Х., Австрия
Институто Грифолз С.А., Испания
СиЭсЭл Беринг ГмбХ, Германия
Биотест Фарма ГмбХ, Германия
Кедрион С.п.А., Италия
Бакстер Хелскэа Корпорейшн, США
Гематологический научный центр РАМН Учреждение, Россия
Группа препаратов фактора IX
Октафарма Фармацевтика Продуктионсгес м.б.Х, Австрия
СиЭсЭл Беринг ГмбХ, Германия
Кедрион С.п.А., Италия
Био Продактс Лаборатори, Великобритания
Гематологический научный центр РАМН Учреждение, Россия
Препараты фактора Виллебранда
ЛФБ БИОМЕДИКАМЕНТС, Франция
СиЭсЭл Беринг ГмбХ, Германия
Октафарма Фармацевтика Продуктионсгес м.б.Х, Австрия
Препараты факторов свертывания крови II, VII, IX и X в комбинации
Бакстер АГ, Австрия
СиЭсЭл Беринг ГмбХ, Германия
Уман Комплекс Д.И.
Из всех применяемых плазменных препаратов ФСК к препаратам отечественного производства относятся 3: Агемфил А, Агемфил В и Криопреципитат, выпускаемый производителями 8 регионов России (Самара, Белгород, Уфа, Астрахань, Оренбург, Воронеж, Мордовия, Краснодар). Остальные препараты ФСК, из числа плазменных (Коэйт-ДВИ, ЛонгЭйт, Октанат, Фанди, Бериате, Гемоктин, Эмоклот Д.И., Гемофил М, Иммунат, Октанайн, Мононайн, Анимафикс, Репленин-ВФ, Иммунин, Вилфактин, Гемате П, Вилате, Протромплекс, Уман Комплекс Д.И., Фактор VII), производятся зарубежными компаниями (США, Германия, Италия, Австрия, Испания, Нидерланды, Великобритания, Швеция, Франция).
Большинство из указанных препаратов ФСК человека внесены в перечень жизненно необходимых и важнейших лекарственных препаратов для оказания медицинской помощи и включены в федеральную программу «Семь нозологий» [1, 2].
Наиболее часто в практическом здравоохранении для остановки кровотечения при гемофилии А используются плазменные концентраты фактора VIII высокой степени очистки: Иммунат, Коэйт-ДВИ, Эмоклот, Гемоктин, Октанат, Бериате, Гемофил М. При гемофилии В чаще применяют плазменные концентраты фактора IX – Аймафикс-ДИ, Уман-комплекс-ДИ, Иммунин, Октанайн, Агемфил-В, Мононайн [4].
В соответствии с руководствами мировых регуляторов ЕМА и FDA основными факторами риска применения плазменных факторов являются вирусная контаминация и трансмиссивные заболевания, а также остаточное содержание в препарате нецелевых примесных компонентов плазмы (6, 13). В связи с этим возникает необходимость о представлении информации о возможных рисках применения препаратов ФСК следует привести в соответствующих разделах ИМП.
Фактор свертывания крови VII – витамин К-зависимый фактор нормальной человеческой плазмы, активирует факторы свертывания крови IX и X, в результате чего последовательно образуются факторы IХа и Ха. Применение данного препарата может временно устранить дефект свертывания крови у больных с дефицитом фактора VII [10, 12].
Препарат Фактор VII был изначально разработан для применения при кровотечениях, осложняющих течение гемофилии у пациентов с аллоантителами (ингибиторами) в отношении экзогенного фактора VIII или IX. В настоящее время препарат успешно используется в клинической практике. При этом FDA расценивает препарат для больных с гемофилией как орфанный [12].
Фактор свертывания крови VII показан для применения в следующих случаях:
– профилактика и лечение нарушений свертывания крови, вызванных изолированной наследственной недостаточностью фактора VII;
– профилактика нарушений свертывания крови, вызванных изолированной наследственной недостаточностью Фактора VII при кровотечениях в анамнезе и остаточном уровне фактора VII ниже, чем 25 % от нормального содержания (0,25 МЕ/мл).
Применение препарата не рекомендовано «детям до 6 лет», ввиду отсутствия результатов клинических исследований в данной возрастной группе [10].
При лечении больных препаратом Фактор VII существует риск возникновения тромбоза или диссеминированного внутрисосудистого свертывания, в связи с этим за пациентами необходимо установить медицинское наблюдение. Из-за риска тромбоэмболических осложнений следует соблюдать осторожность при применении более высоких доз препарата.
Рекомендуемые дозировки препарата Фактор VII являются ориентировочными и не подтверждены результатами клинических исследований. Отсутствие конкретных оценочных показателей, характеризующих состояние предполагаемого риска кровотечения и тромбоэмболических осложнений, затрудняет проведение адекватных мероприятий по профилактике и лечению нарушений свертывания крови, вызванных изолированной наследственной недостаточностью фактора VII.
ФСК VIII – циркулирует в крови в виде комплекса из трех субъединиц, участвующего в формировании коагуляционной активности VIII К, основного антигенного маркера VIII АГ и фактора Виллебранда VIII (фВ). Введение препаратов ФСК VIII обеспечивает увеличение содержания специфического белка плазмы – фактора VIII свертывания крови и временно устраняет дефект гемокоагуляции у больных с гемофилией А при наследственной и приобретенной формах, обусловленных сниженным содержанием или отсутствием VIII фактора в плазме крови [7].
К препаратам фактора свертывания крови VIII относятся 22 препарата, из которых 17 плазменных. Перечень плазменных препаратов факторов свертывания крови представлен препаратами отечественного производства: Криопреципитат и Агемфил А, а также препаратами зарубежного производства: Коэйт-ДВИ, ЛонгЭйт, Фанди, Бериате, Гемоктин, Эмоклот Д.И., Гемофил М, Иммунат (см. табл.).
В соответствии с имеющимися рекомендациями в руководствах ВФГ, ЕМА и действующими ИМП [5, 7] препараты фактора свертывания крови VIII показаны для применения в следующих случаях:
– лечение и профилактика кровотечений у больных классической гемофилией (гемофилия А);
– приобретенная коагулопатия с ингибиторами к фактору VIII.
Перечень показаний для отечественного препарата Агемфил А несколько шире и включает: лечение и профилактику кровотечений при проведении экстренного или планового хирургического вмешательства, а также при кровотечениях другой этиологии, при которых имеется резкое уменьшение содержания фактора VIII в плазме.
Для препарата Криопреципитат дополнительно указана в качестве показаний к применению болезнь Виллебранда-Юргенса. Вместе с тем эффективность препарата Агемфил при лечении этого заболевания не оценивалась. В ИМП препарата Бериате его применение не показано при болезни Виллебранда-Юргенса в связи с отсутствием в препарате VIII фВ в терапевтических концентрациях.
Отдельные препараты фактора VIII, например отечественный препарат Агемфил А, имеют возрастные ограничения по применению, что связано с отсутствием информации об эффективности и безопасности препарата для детей.
При сопоставлении действующих ИМП для зарубежных и отечественных препаратов, обращают на себя внимание различия, с объема информации, представленной в разделах, характеризующих безопасность применения препаратов фактора VIII. В частности для препарата Гемофил М раздел ИМП «Противопоказания» содержит информацию о противопоказаниях применения препарата при чувствительности к мышиному белку, что связано с технологией получения препарата. В ИМП отечественный препарата Агемфил А противопоказания ограничиваются индивидуальной непереносимостью. Для Криопреципитата дополнительно указывается на необходимость использования глюкокортикостероидных препаратов и проведение контроля частоты сердечных сокращений до и после инфузии препарата.
Для других препаратов ФСК VIII разделы «Противопоказания» и «Особые указания» в ИМП также имеют некоторые особенности по объему и содержанию.
Фактор свертывания крови IX оказывает гемостатическое действие, повышает концентрацию фактора IX в плазме, восстанавливает гемостаз у пациентов с его дефицитом. Активная форма фактора IX – фактор IXa – в комбинации с фактором VIII активирует фактор Х, который способствует переходу протромбина в тромбин и образованию фибринового сгустка. Увеличивает концентрацию в плазме витамин K-зависимых факторов коагуляции (II, VII, IX и X). При уменьшении плазменного фактора IX ниже 5 % от нормы резко возрастает риск спонтанных геморрагий, а содержание выше 20 % от нормы обеспечивает удовлетворительный гемостаз [5, 8].
В данную группу входят 7 препаратов, из которых 6 плазменных: Октанайн , Мононайн, Аимафикс, Репленин-ВФ, Иммунин и один – Агемфил В – отечественного производства.
В соответствии с рекомендациями руководств ВФГ, ЕМА и действующими ИМП [5, 8] препараты фактора свертывания крови IX применяются по следующим показаниям:
– лечение и профилактика кровотечений у пациентов с гемофилией В;
– приобретенный дефицит фактора IX.
При этом в ИМП препарата факторов свертывания крови IX отечественного производства не включено показание: приобретенный дефицит фактора IX. В ИМП зарубежных препаратов данной группы перечень показаний соответствует рекомендациям ЕМА.
Обращают на себя внимание различия в изложении разделов «Противопоказания» и «Особые указания» для отечественного и зарубежного препарата «Мононайн». В ИМП препарата Агемфила В указаны синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром), острый тромбоз, острый инфаркт миокарда, дефицит фактора VII, острая печеночная недостаточность. Противопоказания для препарата «Мононайн» ограничиваются риском тромбоза и ДВС-синдромом.
Фактор Виллебранда восстанавливает адгезию тромбоцитов к сосудистому субэндотелию на месте повреждения, обеспечивая первичный гемостаз, что проявляется в уменьшении времени кровотечения. Фактор Виллебранда способствует отсроченной коррекции сопутствующего дефицита фактора VIII (продуцируемого организмом пациента), стабилизирует содержание этого фактора, предотвращая его быструю деградацию [5, 9].
Эти факторы представляют различные по структуре гликопротеины, которые циркулируют в крови в форме нековалентно связанного комплекса. Оба фактора необходимы для нормального гемостаза. Активированный фактор VIII является кофактором активации фактора коагуляции IX, который в свою очередь активирует фактор Х. Фактор Виллебранда способствует, за счет образования комплекса с фактором VIII, увеличению времени циркуляции последнего в крови. Кроме того, фактор Виллебранда имеет самостоятельное значение в системе гемостаза, увеличивая сродство тромбоцитов к коллагену, что приводит к их агрегации в области повреждения сосуда. Дефицит фактора VIII и фактора Виллебранда приводит к развитию двух различных наследственных заболеваний: гемофилии А и болезни Виллебранда.
В Российской Федерации зарегистрированы 4 комбинированных плазменных препарата фактора Виллебранда и фактора VIII зарубежного производства.
Препараты фактора Виллебранда применяются в соответствии с рекомендациями руководств ВФГ и ЕМА [5, 9] по следующим показаниям:
– лечение и профилактика кровотечений у пациентов с болезнью Виллебранда, в т.ч. применение перед плановым и экстренным хирургическим или инвазивным вмешательством для уменьшения кровопотери;
– лечение и профилактика кровотечений или кровопотери во время операций у пациентов с болезнью Виллебранда, если монотерапия с десмопрессином не эффективна или противопоказана.
ФАКТОРЫ СВЕРТЫВАНИЯ КРОВИ II, VII, IX и X В КОМБИНАЦИИ (ПРОТРОМБИНОВЫЙ КОМПЛЕКС).
Применение препарата протромбинового комплекса человека обеспечивает увеличение уровней витамин К-зависимых факторов свертывания в плазме и может временно устранить коагуляционные нарушения у пациентов с недостаточностью одного или нескольких этих факторов, входящих в состав препарата [5].
Препараты протромбинового комплекса в соответствии с рекомендациями ВФГ и ЕМА применяются по следующим показаниям [5, 11]:
– лечение и профилактика кровотечений у пациентов с приобретенными дефицитами факторов свертывания крови, входящих в состав протромбинового комплекса;
– врожденные дефициты одного из витамин К-зависимого фактора свертывания крови в тех случаях, когда препарат очищенного специфического фактора свертывания крови недоступен;
– предоперационная профилактика при приобретенном или врожденном дефиците протромбинового комплекса.
К противопоказаниям препаратов протромбинового комплекса относятся:
– повышенная чувствительность к активным ингредиентам или к любому из вспомогательных веществ;
– аллергическая реакция на гепарин в анамнезе;
Также для препарата Уман Комплекс Д.И. в ИМП имеется информация применения с осторожностью у новорожденных детей, а также при заболеваниях печени (без указания этиологии) и при инфаркте миокарда в анамнезе. Для аналогичного препарата Коаплекс такая информация в ИМП отсутствует.
Заключение
На российском рынке представлены все основные группы плазменных факторов свертывания крови, зарегистрированные в мире. Оценка их качества и основных показателей (активности, подлинности и чистоты) проводится в соответствии с частными фармакопейными статьями, а безопасность гарантируется наличием государственной системы обращения препаратов крови, обеспечивающей соблюдение надлежащих условий при разделении, хранении и транспортировке плазмы, скрининг доноров крови, в том числе оценка риска заражения прионами, выполнением современных требований по обеспечению вирусной безопасности препаратов крови [6, 13].
В тоже время отсутствие единых требований приводит к несогласованности объема и полноты информации, терминологии действующих ИМП препаратов ФСК, информирующих пациента и врача об эффективности и безопасности применения того или иного препарата. Выработка требований к эффективности и безопасности плазменных ФСК, гармонизация действующих ИМП необходимы для обеспечения возможности обоснованного выбора того или иного препарата с целью лечения пациентов разных возрастных групп, имеющих различный анамнез и степень тяжести заболевания.
Плазменные и клеточные факторы, участвующие в процессе свертывания крови
ЛЕКЦИЯ № 18. Физиология гемостаза
1. Структурные компоненты гемостаза
Гемостаз – сложная биологическая система приспособительных реакций, обеспечивающая сохранение жидкого состояния крови в сосудистом русле и остановку кровотечений из поврежденных сосудов путем тромбирования. Система гемостаза включает следующие компоненты:
1) cосудистую стенку (эндотелий);
2) форменные элементы крови (тромбоциты, лейкоциты, эритроциты);
3) плазменные ферментные системы (систему свертывания крови, систему фибринолиза, клекреин-кининовую систему);
4) механизмы регуляции.
Функции системы гемостаза.
1. Поддержание крови в сосудистом русле в жидком состоянии.
2. Остановка кровотечения.
3. Опосредование межбелковых и межклеточных взаимодействий.
4. Опсоническая – очистка кровяного русла от продуктов фагоцитоза небактериальной природы.
5. Репаративная – заживление повреждений и восстановления целостности и жизнеспособности кровеносных сосудов и тканей.
Факторы, поддерживающие жидкое состояние крови:
1) тромборезистентность эндотелия стенки сосуда;
2) неактивное состояние плазменных факторов свертывания крови;
3) присутствие в крови естественных антикоагулянтов;
4) наличие системы фибринолиза;
5) непрерывный циркулирующий поток крови.
Тромборезистентность эндотелия сосудов обеспечивается за счет антиагрегантных, антикоагулянтных и фибринолитических свойств.
1) синтез простациклина, который обладает антиагрегационным и сосудорасширяющим действием;
2) синтез оксида азота, обладающего антиагрегационным и сосудорасширяющим действием;
3) синтез эндотелинов, которые сужают сосуды и препятствуют агрегации тромбоцитов.
1) синтез естественного антикоагулянта антитромбина III, который инактивирует тромбин. Антитромбин III взаимодействует с гепарином, образуя антикоагуляционный потенциал на границе крови и стенки сосуда;
2) синтез тромбомодулина, который связывает активный фермент тромбин и нарушает процесс образования фибрина за счет активации естественного антикоагулянта протеина С.
Фибринолитические свойства обеспечиваются синтезом тканевого активатора плазминогена, который является мощным активатором системы фибринолиза. Различают два механизма гемостаза:
1) сосудисто-тромбоцитарный (микроциркулярный);
2) коагуляционный (свертывание крови).
Полноценная гемостатическая функция организма возможна при условии тесного взаимодействия этих двух механизмов.
2. Механизмы образования тромбоцитарного и коагуляционного тромба
Сосудисто-тромбоцитарный механизм гемостаза обеспечивает остановку кровотечения в мельчайших сосудах, где имеются низкое кровяное давление и малый просвет сосудов. Остановка кровотечения может произойти за счет:
1) сокращения сосудов;
2) образования тромбоцитарной пробки;
3) сочетания того и другого.
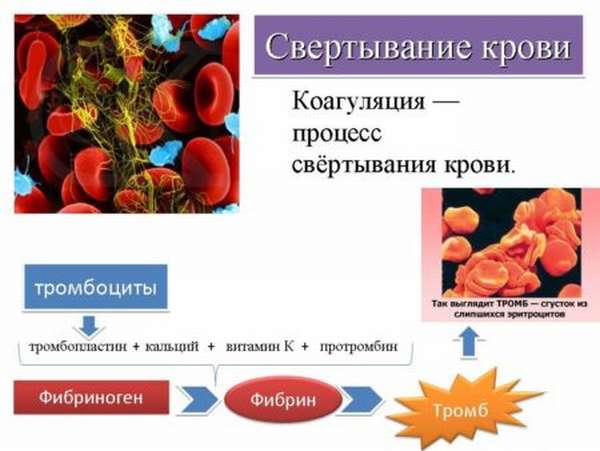
Сосудисто-тромбоцитарный механизм обеспечивает остановку кровотечения благодаря способности эндотелия синтезировать и выделять в кровь биологически активные вещества, изменяющие просвет сосудов, а также адгезивно-агрегационной функции тромбоцитов. Изменение просвета сосудов происходит за счет сокращения гладкомышечных элементов стенок сосудов как рефлекторным, так и гуморальным путем. Тромбоциты обладают способностью к адгезии (способностью прилипать к чужеродной поверхности) и агрегацией (способностью склеиваться друг с другом). Это способствует образованию тромбоцитарной пробки и запускает процесс свертывания крови. Остановка кровотечения за счет сосудисто-тромбоцитарного механизма гемостаза осуществляется следующим образом: при травме происходит спазм сосудов за счет рефлекторного сокращения (кратковременный первичный спазм) и действия биологически активных веществ на стенку сосудов (серотонина, адреналина, норадреналина), которые освобождаются из тромбоцитов и поврежденной ткани. Этот спазм вторичный и более продолжительный. Параллельно происходит формирование тромбоцитарной пробки, которая закрывает просвет поврежденного сосуда. В основе ее образования лежит способность тромбоцитов к адгезии и агрегации. Тромбоциты легко разрушаются и выделяют биологически активные вещества и тромбоцитарные факторы. Они способствуют спазму сосудов и запускают процесс свертывания крови, в результате которого образуется нерастворимый белок фибрин. Нити фибрина оплетают тромбоциты, и образуется фибрин-тромбоцитарная структура – тромбоцитарная пробка. Из тромбоцитов выделяется особый белок – тромбостеин, под влиянием которого происходит сокращение тромбоцитарной пробки и образуется тромбоцитарный тромб. Тромб прочно закрывает просвет сосуда, и кровотечение останавливается.
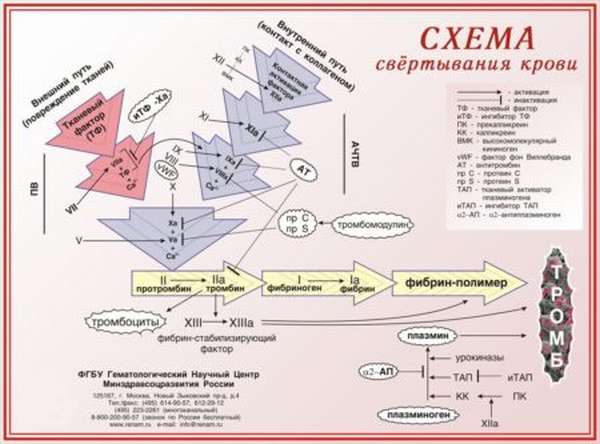
Коагуляционный механизм гемостаза обеспечивает остановку кровотечения в более крупных сосудах (сосудах мышечного типа). Остановка кровотечения осуществляется за счет свертывания крови – гемокоагуляции. Процесс свертывания крови заключается в переходе растворимого белка плазмы крови фибриногена в нерастворимый белок фибрин. Кровь из жидкого состояния переходит в студнеобразное, образуется сгусток, который закрывает просвет сосуда. Сгусток состоит из фибрина и осевших форменных элементов крови – эритроцитов. Сгусток, прикрепленный к стенке сосуда, называется тромбом, он подвергается в дальнейшем ретракции (сокращению) и фибринолизу (растворению). В свертывании крови принимают участие факторы свертывания крови. Они содержатся в плазме крови, форменных элементах, тканях.
3. Факторы свертывания крови
В процессе свертывания крови принимают участие много факторов, они называются факторами свертывания крови, содержатся в плазме крови, форменных элементах и тканях. Плазменные факторы свертывания крови имеют наибольшее значение.
Плазменные факторы свертывания крови – белки, большинство из которых ферменты. Они находятся в неактивном состоянии, синтезируются в печени и активируются в процессе свертывания крови. Существует пятнадцать плазменных факторов свертывания крови, основными из них являются следующие.
I – фибриноген – белок, переходящий в фибрин под влиянием тромбина, участвует в агрегации тромбоцитов, необходим для репарации тканей.
II – протромбин – гликопротеид, переходящий в тромбин под влиянием протромбиназы.
IV – ионы Ca участвуют в образовании комплексов, входит в состав протромбиназы, связывает гепарин, способствует агрегации тромбоцитов, принимает участие в ретракции сгустка и тромбоцитарной пробки, тормозят фибринолиз.
Дополнительными факторами, ускоряющими процесс свертывания крови, являются акцелераторы (с V по XIII факторы).
VII – проконвертин – гликопротеид, принимающий участие в формировании протромбиназы по внешнему механизму;
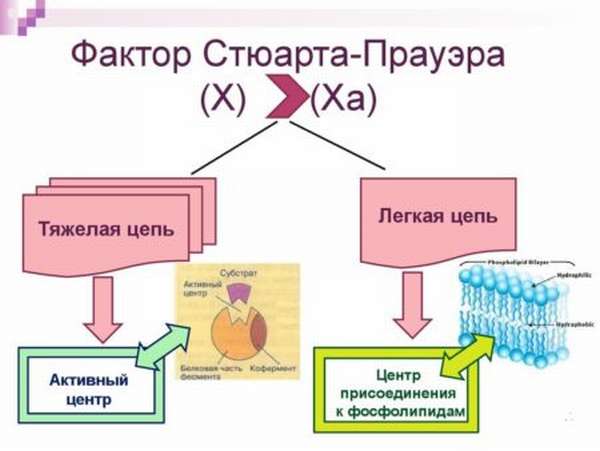
X – фактор Стюарта—Прауэра – гликопротеид, являющийся составной частью протромбиназы.
XII – фактор Хагемана – белок, активируется отрицательно заряженными поверхностями, адреналином. Запускает внешний и внутренний механизм образования протромбиназы, а также механизм фибринолиза.
Факторы клеточной поверхности:
1) тканевой активатор, индуцирующий свертывание крови;
2) прокоагулянтный фосфолипид, выполняющий функцию липидного компонента тканевого фактора;
3) тромбомодулин, связывающий тромбин на поверхности эндотелиальных клеток, активирует протеин С.
Факторы свертывания крови форменных элементов.
1) фосфолипидный фактор;
2) большое количество АДФ;
Лейкоцитарные – апопротеин III, значительно ускоряющий свертываемость крови, способствующий развитию распространенного внутрисосудистого свертывания крови.
Тканевым фактором является тромбопластин, который содержится в коре головного мозга, в легких, в плаценте, эндотелии сосудов, способствует развитию распространенного внутрисосудистого свертывания крови.
4. Фазы свертывания крови
Свертывание крови – это сложный ферментативный, цепной (каскадный), матричный процесс, сущность которого состоит в переходе растворимого белка фибриногена в нерастворимый белок фибрин. Процесс называется каскадным, так как в ходе свертывания идет последовательная цепная активация факторов свертывания крови. Процесс является матричным, так как активация факторов гемокоагуляци происходит на матрице. Матрицей служат фосфолипиды мембран разрушенных тромбоцитов и обломки клеток тканей.
Процесс свертывания крови происходит в три фазы.
Сущность первой фазы состоит в активации X-фактора свертывания крови и образовании протромбиназы. Протромбиназа – это сложный комплекс, состоящий из активного X-фактора плазмы крови, активного V-фактора плазмы крови и третьего тромбоцитарного фактора. Активация X-фактора происходит двумя способами. Деление основано на источнике матриц, на которых происходит каскад ферментативных процессов. При внешнем механизме активации источником матриц является тканевый тромбопластин (фосфолипидные осколки клеточных мембран поврежденных тканей), при внутреннем – обнаженные коллагеновые волокна, фосфолипидные осколки клеточных мембран форменных элементов крови.
Сущность второй фазы – образование активного протеолитического фермента тромбина из неактивного предшественника протромбина под влиянием протромбиназы. Для осуществления этой фазы необходимы ионы Ca.
Сущность третьей фазы – переход растворимого белка плазмы крови фибриногена в нерастворимый фибрин. Эта фаза осуществляется три 3 стадии.
1. Протеолитическая. Тромбин обладает эстеразной активность и расщепляет фибриноген с образованием фибринмономеров. Катализатором этой стадии являются ионы Ca, II и IX протромбиновые факторы.
2. Физико-химическая, или полимеризационная, стадия. В ее основе лежит спонтанный самосборочный процесс, приводящий к агрегации фибрин-мономеров, который идет по принципу «бок в бок» или «конец в конец». Самосборка осуществляется путем формирования продольных и поперечных связей между фибринмономерами с образованием фибрин-полимера (фибрина-S) Волокна фибрина-S легко лизируются не только под влиянием плазмина, но и комплексных соединений, которые не обладают фибринолитической активностью.
3. Ферментативная. Происходит стабилизация фибрина в присутствии активного XIII фактора плазмы крови. Фибрин-S переходит в фибрин-I (нерастворимый фибрин). Фибрин-I прикрепляется к сосудистой стенке, образует сеть, где запутываются форменные элементы крови (эритроциты) и образуется красный кровяной тромб, который закрывает просвет поврежденного сосуда. В дальнейшем наблюдается ретракция кровяного тромба – нити фибрина сокращаются, тромб уплотняется, уменьшается в размерах, из него выдавливается сыворотка, богатая ферментом тромбином. Под влиянием тромбина фибриноген вновь переходит в фибрин, за счет этого тромб увеличивается в размерах, что способствует лучшей остановке кровотечения. Процессу ретракции тромба способствует тромбостенин – контрактивный белок кровяных пластинок и фибриноген плазмы крови. С течением времени тромб подвергается фибринолизу (или растворению). Ускорение процессов свертывания крови называется гиперкоагуляцией, а замедление – гипокоагуляцией.
5. Физиология фибринолиза
Система фибринолиза – ферментативная система, расщепляющая нити фибрина, которые образовались в процессе свертывания крови, на растворимые комплексы. Система фибринолиза полностью противоположна системе свертывания крови. Фибринолиз ограничивает распространение свертывания крови по сосудам, регулирует проницаемость сосудов, восстанавливает их проходимость и обеспечивает жидкое состояние крови в сосудистом русле. В состав системы фибринолиза входят следующие компоненты:
1) фибринолизин (плазмин). Находится в неактивном виде в крови в виде профибринолизина (плазминоген). Он расщепляет фибрин, фибриноген, некоторые плазменные факторы свертывания крови;
2) активаторы плазминогена (профибринолизина). Они относятся к глобулиновой фракции белков. Различают две группы активаторов: прямого действия и непрямого действия. Активаторы прямого действия непосредственно переводят плазминоген в активную форму – плазмин. Активаторы прямого действия – трипсин, урокиназа, кислая и щелочная фосфатаза. Активаторы непрямого действия находятся в плазме крови в неактивном состоянии в виде проактиватора. Для его активации необходимы лизокиназа тканей, плазмы. Свойствами лизокиназы обладают некоторые бактерии. В тканях находятся тканевые активаторы, особенно много их содержится в матке, легких, щитовидной железе, простате;
3) ингибиторы фибринолиза (антиплазмины) – альбумины. Антиплазмины тормозят действие фермента фибринолизина и превращение профибринолизина в фибринолизин.
Процесс фибринолиза проходит в три фазы.
Во время I фазы лизокиназы, поступая в кровь, приводят проактиватор плазминогена в активное состояние. Эта реакция осуществляется в результате отщепления от проактиватора ряда аминокислот.
II фаза – превращение плазминогена в плазмин за счет отщепления липидного ингибитора под действием активатора.
В ходе III фазы под влиянием плазмина происходит расщепление фибрина до полипептидов и аминокислот. Эти ферменты получили название продуктов деградации фибриногена / фибрина, они обладают выраженным антикоагулянтным действием. Они ингибируют тромбин и тормозят процесс образования протромбиназы, подавляют процесс полимеризации фибрина, адгезию и агрегацию тромбоцитов, усиливают действие брадикинина, гистамина, ангеотензина на сосудистую стенку, что способствует выбросу из эндотелия сосудов активаторов фибринолиза.
Различают два вида фибринолиза – ферментативный и неферментативный.
Ферментативный фибринолиз осуществляется при участии протеолитического фермента плазмина. Происходит расщепление фибрина до продуктов деградации.
Неферментативный фибринолиз осуществляется комплексными соединениями гепарина с тромбогенными белками, биогенными аминами, гормонами, совершаются конформационные изменения в молекуле фибрина-S.
Процесс фибринолиза идет по двум механизмам – внешнему и внутреннему.
По внешнему пути активация фибринолиза идет за счет лизокиназ тканей, тканевых активаторов плазминогена.
Во внутреннем пути активации принимают участие проактиваторы и активаторы фибринолиза, способные превращать проактиваторы в активаторы плазминогена или же действовать непосредственно на профермент и переводить его в плазмин.
Значительную роль в процессе растворения фибринового сгустка играют лейкоциты в силу своей фагоцитарной активности. Лейкоциты захватывают фибрин, лизируют его и выделяют в окружающую среду продукты его деградации.
Процесс фибринолиза рассматривается в тесной связи с процессом свертывания крови. Их взаимосвязи осуществляются на уровне общих путей активаций в реакции ферментного каскада, а также за счет нервно-гуморальных механизмов регуляции.
Плазменные и клеточные факторы, участвующие в процессе свертывания крови
Кровь, как одна из самых важных субстанций в организме человека, должна постоянно пребывать в жидком состоянии и определенном объеме – 3500-5000 мл. Но в случае травмирования внутренних органов или ранения кровопотери неизбежны. Особенность крови – это возможность свертываться: механически срабатывает процесс остановки кровотечения, а кровь из жидкости превращаться в желеобразную субстанцию, а затем в твердую. Так происходит тромбообразование – временное явление, которое наблюдается только при внешних повреждениях сосудов. После выполнения миссии кровь возвращается в прежнее, жидкое, состояние. Так происходит процесс преобразования гемостаз. Именно на него оказывают влияние факторы свертывания крови.
Замедление гемостаза, как и любой сбой, чреват развитием заболеваний, опасных для человека. Значительные кровопотери могут привести к инсульту, инфаркту, тромбозу.
Свертываемость, или коагуляция, защищает организм от кровопотерь. Нарушение гемокоагуляции ведет к запуску патологий, препятствующих нормальной свертываемости, активируют которую 3 фермента: протромбин, тромбин и фибрин. Чтобы восстановить нормальное кровообращение, тромб или сгусток должен превратиться в изначальное, жидкое, состояние.
- Роль гемокоагуляции
- Факторы
- Именные факторы без порядкового номера
- Зависимые и независимые от витамина К факторы
- Что еще может повлиять на свертываемость?
Роль гемокоагуляции
Тромбоцитарный процесс сложный и поэтапный. Гемокоагуляция – это реакция, способная защитить организм при повреждении сосудов от значительных кровопотерь. В противном случае наступит внезапная смерть. Ведь плохая свертываемость чревата кровотечением, остановить которое затруднительно.
Если свертываемость в норме, то даже при сильном повреждении сосудов кровь свернется за 7 минут. Сформируется тромб, который убережет организм от кровопотерь и остановит кровотечение. Механизм гемокоагуляции заключается в:
- образовании тромбоцитарного сгустка,
- выработке фибрина волокнистого нитевидного вещества, способствующего образованию тромба,
- вовлечении в процесс плазменного белка – фибриногена.
Так происходит цепная реакция. Активируются факторы интенсивного свертывания крови и вступают в реакцию с ионами кальция, преобразуя фибриноген и тромбин в нерастворимые желеобразные вещества. Фибрин преобразуется в длинную тонкую сеть, и при попадании в нее форменных кровяных клеток появляется тромб.
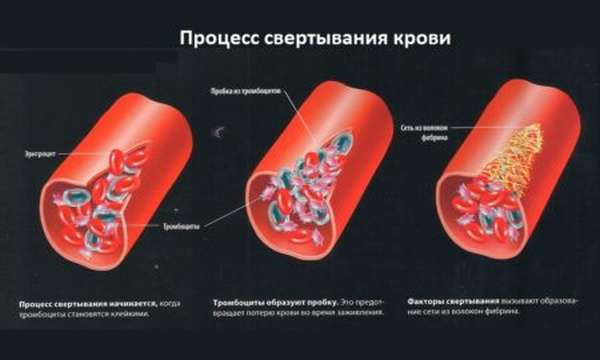
Факторы
Факторы, помогающие поддерживать механизм свертывания крови, взаимодействуют для образования фибрина, способствующего тромбообразованию. С учетом общепринятых норм элементы составляют классификацию, и каждый фактор (преимущественно в составе из белка) имеет свой порядковый номер.
- Первый – фибриноген (белок) преобразовывается в фибрин при взаимодействии с тромбином в таких органах как печень, селезенка, костный мозг.
- Второй – протромбин, синтезировать который при совместном участии с витамином К начинают клетки печени. При недостатке витамина К протромбин образуется не полностью, и свертываемость крови нарушается. Активный тканевой белок, вступая во взаимодействие с ионами кальция, преобразовывается в протромбин.
- Тромбопластин, или тканевый белок, содержащийся в печени, почках, легких, головном мозге. Принимает участие в свертываемости крови, провоцирует синтез 10 фактора, тесно контактируя с протромбином и факторами свертываемости под номером 4 и 7.
- Ионы кальция – незаменимый элемент, принимающий участие практически на всех этапах коагуляции. Пребывает в сыворотке и не выводится из организма. Даже при недостатке кальция в крови процесс свертываемости нарушен не будет, но у могут возникать судороги.
- Проакцелерин белок, созревающий в клетках печени. Считается самостоятельным, поскольку независим от витамина К и способен повлиять на 10 фактор, сыграть непосредственную роль в формировании и выпуске необходимого количества тромбина.
- Акцелерин играет немаловажную роль в превращении крови из жидкого состояния в сгусток.
- Седьмой фактор – выработка белка проконвертина, вступающего во взаимодействие с 6 фактором и оказывающего влияние на фактор 8 свертываемости крови. Но при его недостатке в крови (менее 5% от нормы) процесс гемостаза приостанавливается.
- Глобулин антигемофильный А начинает синтез в почках, лейкоцитах, селезенке и печени. Это довольно сложный гликопротеин, содержание которого в крови должно составлять не менее 0,01 г/л для нормального синтеза. Белок участвует в коагуляции на начальном этапе.
- Девятый – глобулин антигемофильный В с началом синтеза в печени. Довольно устойчив и может долго пребывать в крови. Это В-глобулин, участвующий в тромбообразования, активируя 10 фактор.
- Тромбопоэтин, или гликопротеин, элемент с началом развития в неактивной фазе в клетках печени, принимающий активное участие в гемостазе. Но зависим от витамина К и связь поддерживает именно с ним. Тромбопоэтин считается важным звеном в кратком начальном этапе гемостаза, так как превращает неактивную форму в активную.
- Элемент Розенталя, или антигемофильный фактор, активирующий предшествующий этап.
- Двенадцатый фактор – элемент Хагемана, или контактный, синтез которого происходит в клетках печени как фильтрующего органа, но система свертываемости крови может быть нарушена при недостатке элемента от нормы на 1%. Именно данный фактор запускает свертывание крови и считается завершающим этапом при формировании конечного процесса гемостаза.
- Фактор под номером тринадцать – фибриназа конечный элемент, вступающий во взаимодействие с тромбином, находится в лейкоцитах, эритроцитах, тромбоцитах, клетках мышц и легких. Формирует кровяной сгусток и считается завершающим этапом при ускорении коагуляционного процесса.
Так происходит поэтапный сосудисто-тромбоцитарный гемостаз, в котором должны участвовать все факторы по цепочке. В конце процесса наступает фибринолиз – рассасывание образовавшегося тромба.
На начальном этапе тромбоциты прилипают к поврежденному месту, проявляя адгезивные свойства. Далее активируются и гранулируются пораженные тромбоциты. В последнюю очередь прилипают к поврежденным тромбоцитам здоровые кровяные тельца, связывают их и превращают в гранулы. Так в виде цепной реакции происходит свертывание крови – переход растворимого белка фибриногена в нерастворимый – фибрин. В итоге получается довольно устойчивый и прочный фибриновый тромб.
Именные факторы без порядкового номера
Коагуляционная цепь была бы неполной, а активация не произошла бы по цепочке с последовательностью всех факторов свертываемости крови, если бы на помощь не приходили факторы скорости свертываемости крови:
- виллебранда с выработкой и синтезом в эндотелии – внутреннем слое сосудистой стенки и тромбоцитах. Этот антигеморрагический сосудистый фактор считается связующим и транспортирующим, способен повысить активацию седьмого элемента, а при повреждении тканей усиливать функции антигемофильнного фактора А типа в гетерозиготной форме.
- флетчера молекула с синтезом в печени, принимающая активное участие в запуске 9, 11 фактора. Элемент Флетчера при недостаточном количестве не приведет к нарушению коагуляции.
- фитцджеральда, не приводящий к нарушению гемостаза, но активирующий белковый ион 11 фактор. Без его участия или при дефиците процесс нарушается.
При дефиците любого из данных факторов свертывания крови развивается нарушение, спровоцированное приобретенными либо наследственными факторами, которое может проявиться как у младенца, так и во взрослом возрасте. Недостаток в крови некоторых компонентов, например: протромбина, может значительно повлиять на свертываемость крови внутри сосуда. Для полного свертывания принимают участие присоединяющиеся при коагуляции красные пластиночные клетки – кровяные тельца.
На самом деле комбинация свертывания крови довольно сложная. Но превращение крови жизненно необходимо организму при вступлении подчас в неравную борьбу с внешними раздражителями, вирусами, инфекцией.
Зависимые и независимые от витамина К факторы
Процесс тромбообразования не пройдет нормально, если в организме недостаточно витамина К. Полностью зависимые от витамина К факторы свертываемости крови:
- 2 фактор – протромбин, превращающийся из фермента протромбиназы и принимающий участие в образовании фибринового сгустка,
- 7 фактор проконвертин в виде смеси из активированного и не активированного конвертина, участвующих в преобразовании протромбиназы, может появиться только в результате многоэтапного синтеза клетками печени,
- 9 фактор свертывания крови – протромбиназа, активирующий 10 фактор и зависящий от витамина К. Недостаток протромбиназы приводит к сбою всех процессов гемостаза и повышению кровоточивости,
- 10 фактор Стюарта-Прауэра с активацией 3, 5 и 10 факторов – это антигемофильный глобулин, основная функция которого преобразование протромбиназы.
Независимые от витамина К факторы:
- 1 фактор фибриноген,
- 3 фактор тромбопластин,
- 4 фактор кальций,
- 5 фактор лабильная субстанция,
- 6 фактор глобулин сывороточный,
- 8 фактор гемофильный глобулин А класса.
Что еще может повлиять на свертываемость?
Коагуляционный гемостаз сложный ферментативный процесс, при котором происходит последовательная активация всех этапов свертываемости крови. И растворимый белок фибрин преобразуется в прочный и нерастворимый фибриновый тромб.
Повлиять на схему коагуляции, привести к нарушению гемостаза и снижению свертываемости крови может множество внешних и внутренних причин. К основным внутренним патологиям относятся:
- нехватка кальция и витамина К в организме,
- болезни печени, почек,
- прием препаратов для разжижения крови,
- заболевания генетического характера.
Не менее опасны патологии с повышенной свертываемостью крови, когда в сосудах образуется тромб. Отмирать ткани артерии в сердце, легких. И все может закончиться летальным исходом. Провоцируют повышение свертываемости:
- сахарный диабет,
- беременность,
- стресс,
- ряд заболеваний: гипертензия артериальная, атеросклероз, обезвоживание организма,
- сбой гормонов: повышение эстрогена либо тестостерона,
- наследственная мутация или предрасположенность.
Если свертываемость не попадает под норматив, то пациенты, получив неприятную новость, проходят лечение у врача-гематолога. Важно как можно быстрее привести свертываемость крови в норму, но сделать расшифровку ответов исследования и принять решение о методах регуляции должен специалист. Возможно назначение антикоагулянтов (Октаплекс), проведение аспириновой терапии, после чего сдать повторный анализ методом Инвитро.
Не стоит паниковать при выявлении нарушений свертываемости. Это означает лишь то, что нужно начать заботиться о здоровье. Не принимать лекарства для разжижения крови без согласования с врачом, своевременно сдавать анализы на биохимию для выяснения причин антисвертываемости.
Гемокоагуляция – важнейший процесс в организме. При повреждении стенок сосудов помогает избежать кровопотерь. В норме свертываемость внутри сосуда происходит за 7 минут. При свертываемости крови за пределами сосуда может возникнуть коагулопатия – патология, причиной которой становится дефицит ряда факторов свертываемости крови – 8, 11, 9, 10, 5, 7. Кроме того, можно назвать причины, приобретенные и связанные с физиологией крови (синдром ДВС, прием препаратов с фибринолитическим воздействием, иммунных ингибиторов), способных негативно повлиять на факторы времени свертывания крови, привести к угнетению протромбина и его дефициту в крови.
Подробную характеристику факторов свертывания крови можно узнать из видеоролика:
Также интересную информацию о процессе тромбообразования можно узнать из следующего видео:
Система гемостаза
Диагностика и методы исследования
 Равновесие между свертывающими и противосвертывающими процессами в крови – необходимое условие существования нашего организма. Нарушение этого равновесия приводит к тяжелым последствиям: кровотечению или тромбообразованию. Поддерживается данный баланс системой гемостаза – одной из важнейших функциональных систем организма, которая решает две «противоположные» задачи:
Равновесие между свертывающими и противосвертывающими процессами в крови – необходимое условие существования нашего организма. Нарушение этого равновесия приводит к тяжелым последствиям: кровотечению или тромбообразованию. Поддерживается данный баланс системой гемостаза – одной из важнейших функциональных систем организма, которая решает две «противоположные» задачи:
• поддерживает жидкое состояние крови в обычных условиях;
• останавливает кровотечение при повреждении сосуда.
Свёртывающая система крови (гемостаз) нужна для остановки кровотечения, чтобы избежать значительных кровопотерь при повреждении сосудов. Механизмы гемостаза реализуются при любом повреждении эндотелия сосудистой стенки, вызванном физическими, гемодинамическими, химическими факторами, а также воспалительными процессами, действием иммунных комплексов, нарушением метаболизма (атеросклероз, коллагенозы) и др.
Свертывание крови является жизненно необходимым: мутации в генах основных белков свертывания, как правило, летальны. Система гемостаза удерживает абсолютное первенство среди множества систем нашего организма как главная непосредственная причина летальных исходов: люди болеют разными болезнями, но умирают почти всегда от нарушений системы свертывания крови.

Если причина известна, почему же с ней нельзя бороться? Разумеется, бороться можно и нужно: постоянно создаются новые методы диагностики и терапии нарушений системы свертывания. Но проблема заключается в том, что свертывание крови — крайне сложный и во многом еще загадочный биохимический процесс, который запускается при повреждении кровеносной системы и ведет к превращению жидкой плазмы крови в студенистый сгусток, который как пробка затыкает рану и останавливает кровотечение.
Система гемостаза состоит из десятков белков, которые взаимодействуют в сотнях реакций друг с другом, со стенками сосудов, с клетками крови. Нарушения этой системы крайне опасны и могут привести к кровотечению, тромбозу или другим патологиям, которые совместно отвечают за львиную долю смертности и инвалидности в современном мире. Здесь мы рассмотрим устройство этой системы и расскажем о самых современных методах ее исследования.
I. Система свертываемости крови
По современным представлениям, в остановке кровотечения задействованы:
1) сосудисто-тромбоцитарный гемостаз (первичный), в котором принимают участие стенки сосудов, тромбоциты и, отчасти, эритроциты;
2) плазменный гемостаз (вторичный) – когда в процесс свертывания крови включаются белки плазмы (плазменные факторы свертывания крови).
Такое деление гемостаза достаточно условно, так как в организме эти два звена свертывающей системы крови тесно взаимосвязаны.
1. Первичный гемостаз (сосудисто-тромбоцитарный)
Обеспечивает остановку кровотечения из мелких сосудов и сосудов с низким артериальным давлением.
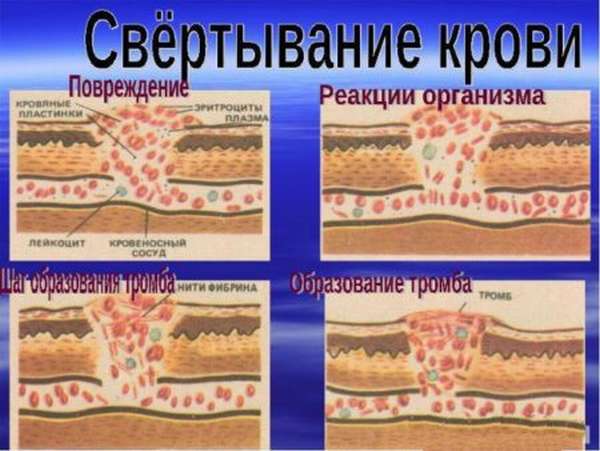
Триггер – повреждение сосудистой стенки и обнажение волокон коллагена – запускает события, которые следуют одно за другим следующим образом.
 Реакция кровеносного сосуда
Реакция кровеносного сосуда
1) Спазм – моментальное рефлекторное сужение сосуда.
Реакция тромбоцитов
2) Адгезия – тромбоциты, благодаря наличию рецепторов к коллагену, прилипают к внутренней стенке сосуда в месте повреждения. Такая стабилизация не дает току крови смывать сгусток тромбоцитов со стенки сосуда.
3) Активация – форма тромбоцитов изменяется, на их поверхности образуются отростки.
4) Агрегация – тромбоциты в большом количестве слипаются, набухают и образуют все более крупный агрегат – рыхлый тромбоцитарный сгусток.
Таким образом, место повреждения сосуда закрывается очень плотной многослойной пробкой (белый тромб), который формируется в течение 3-5 минут. Обычно этого достаточно, чтобы остановить кровотечение у здорового человека при повреждении мелких сосудов.
Таким образом, первичный гемостаз обусловлен сужением сосудов и их механической закупоркой агрегатами тромбоцитов.
 | Единичный тромбоцит в активированном состоянии с отростками |
 | |
| Тромбоцитарный сгусток | |
 |
2. Вторичный гемостаз (плазменный, коагуляция)
Первичный белый тромб – это только временное решение, так как достаточно резкого движения или даже незначительных колебаний артериального давления (например, при физическом напряжении), чтобы сорвать тромбоцитарную пробку с места повреждения сосудистой стенки. Необходим дополнительный механизм, который укрепит скопление тромбоцитов и плотно свяжет его с краями раны. Начинается вторичный гемостаз, или собственно свертывание крови – коагуляция.
При свертывании крови запускается каскад реакций, превращающих растворенный в плазме белок фибриноген в нерастворимый фибрин, который формирует подобие тонкой сетки. Сеть фибрина захватывает находящиеся рядом лейкоциты и эритроциты, формирует красный тромб, уплотняет его и прикрепляет к краям раны. Коагуляция, или свертывание крови, останавливает кровотечение из крупных сосудов и предотвращает его возобновление. В коагуляционном каскаде реакций участвуют особые белки плазмы — факторы свертывания крови, которые обозначаются римскими цифрами в порядке их открытия (например, фактор II, VII и т.д.). Таким образом, в норме скорость свертывания крови зависит от взаимодействия целого ряда различных факторов.


3. Фибринолиз (растворение сгустка крови)
Система фибринолиза восстанавливает проходимость сосудов после ремонта места повреждения сосудистой стенки. Расщепление фибрина происходит под действием специального фермента – плазмина – с образованием продуктов деградации фибрина (ПДФ). Процесс фибринолиза длится от дней до недель, в зависимости от размера и выраженности повреждения сосуда.

II. Алгоритм диагностики нарушений системы гемостаза

Нарушения в системе свертываемости могут приводить к серьезным, с угрозой жизни, кровотечениям и тромбозам.
Которые, в конечном итоге, являются прямой или косвенной причиной наступления более половины всех летальных исходов: например, тромбозы при травме, сепсисе, онкологическом заболевании, хирургическом вмешательстве и др.
Поэтому своевременная точная оценка состояния системы гемостаза – одна из важнейших задач медицины.
 1. Скрининг
1. Скрининг
Первоначально выполняются исследования, отражающие состояние целых звеньев системы гемостаза.
Для этого существует стандартный набор тестов, традиционно называемых скрининговыми:
• время кровотечения
• протромбиновое время (ПВ)
• международное нормализованное отношение (МНО)
• активированное частичное тромбопластиновое время (АЧТВ)
• тромбиновое время (ТВ)
• растворимые фибрин-мономерные комплексы (РФМК)
Диагностическая значимость скрининга:
• нормальные результаты – нет значительных изменений в системе гемостаза
• аномальные результаты – показывают направленность нарушений в системе гемостаза
Протромбиновое время (ПВ) – один из основных базовых тестов в повседневной клинической практике; используется для определения времени свертывания и расчета МНО. Кровь собирают в пробирку с цитратом натрия, который действует как антикоагулянт: связывает ионы кальция, без которых кровь не свертывается. Избыток кальция возвращает цитратной плазме способность к свёртыванию. Далее к плазме с кальцием добавляется тканевой фактор (III фактор свертывания), и измеряется время образования сгустка.
Международное нормализованное отношение (МНО) – результаты ПВ зависят от активности используемого в тесте реагента тромбопластина. Чтобы уйти от этой зависимости и стандартизовать измерения ПВ, был введён показатель МНО, который рассчитывается как отношение (ПВ пациента/ПВ норма)МИЧ. Где МИЧ – это международный индекс чувствительности тромбопластина, показывающий его активность для данной партии реагента.
Активированное частичное тромбопластиновое время (АЧТВ) – представляет собой время, за которое формируется сгусток в образце плазмы крови, после добавления к ней специальных активаторов этого процесса. Таким образом, оценивается степень воздействия факторов свертывания крови на образование тромба.
III. Методы исследования системы свертывания
Клоттинговый (англ. «сlot» – сгусток) – в пробе запускается процесс
свертывания, и определяется время образования сгустка
(механическим или оптическим способом).
IV. Способы исследования системы свертывания
 1) Механический способ – время образование сгустка определяется по изменению вязкости реакционной смеси:
1) Механический способ – время образование сгустка определяется по изменению вязкости реакционной смеси:
• в реакционную кювету помещается металлический шарик;
• вокруг кюветы создаётся вращающееся магнитное поле;
• шарик вращается в магнитном поле со строго фиксированной скоростью или совершает колебательные движения с фиксированной амплитудой;
• при формировании сгустка вязкость пробы растет, движение шарика замедляется;
• прибор регистрирует изменение скорости движения шарика;
• остановка шарика приводит к автоматической остановке секундомера коагулометра.
 ВАЖНО!
ВАЖНО!  Результат механического измерения не зависит от оптической плотности пробы , поэтому в качестве образца можно использовать как цитратную плазму, так и цельную кровь , в том числе, капиллярную.
Результат механического измерения не зависит от оптической плотности пробы , поэтому в качестве образца можно использовать как цитратную плазму, так и цельную кровь , в том числе, капиллярную.
ВАЖНО! Благодаря тому, что оптическая плотность пробы не влияет на результат механического измерения, можно исследовать «сложные» пробы (иктеричные, липемичные и гемолизные), без их отбраковки и повторных назначений. Доступно только для механического способа измерения.
Механика прощает ошибки преаналитического этапа.
 Что такое иктеричност ь?
Что такое иктеричност ь?
Иктеричная проба окрашена в ярко-желтый цвет из-за высокой концентрации билирубина в крови, которая чаще всего обусловлена различными заболеваниями печени, а также приемом некоторых лекарственных препаратов. Высокая концентрация билирубина в пробе может исказить значение лабораторного показателя. Предсказать иктеричность образца, как правило, невозможно. При этом не всегда возможно и скорректировать повышенный уровень билирубина в крови пациента. Чтобы выполнить анализ иктеричной пробы и получить достоверный результат, необходимо использовать соответствующие способы и оборудование, которые позволяют исследовать иктеричную пробу без определения оптической плотности – на механических коагулометрах.
 Что такое липемия?
Что такое липемия?
Липемичная проба имеет желтовато-белый цвет из-за высокой концентрации липидов (жиров) в крови. Чаще всего липемия обусловлена приемом жирной пищи незадолго до сдачи крови, а также некоторыми нарушениями обмена веществ, в частности, обмена жиров. Высокая концентрация жиров в крови может исказить значение лабораторного показателя. Как избежать влияния липемии на результат? Если нарушены правила подготовки к сдаче анализов, кровь можно пересдать. Но если липемия обусловлена нарушениями метаболизма, «улучшить» образец невозможно в принципе. Чтобы выполнить анализ такой пробы и получить корректный результат, необходимо использовать соответствующие способы и оборудование (без определения оптической плотности), которые позволяют исследовать мутную пробу.
ВАЖНО! Если аномальная окраска плазмы обусловлена, например, приемом лекарств, то новое взятие образца ситуацию с качеством пробы не улучшит. Для таких пациентов получение результата возможно только механическим способом. Таким образом, только механика даст корректный результат для «сложной» пробы, качество которой улучшить слишком затратно или вообще невозможно.
| ВАЖНО! Особенности механических коагулометров позволяют успешно применять их для оценки гемостаза как в рутинном скрининге, так и в педиатрической практике и при контроле лечения непрямыми антикоагулянтами. |  |
2) Оптический способ – детекция сгустка по изменению оптической плотности пробы:
 • Исходная плазма прозрачна
• Исходная плазма прозрачна
• Формирование сгустка уменьшает
светопропускание через кювету
• Уменьшение светопропускания фиксируется
оптической системой прибора
ВАЖНО! Результат оптического измерения зависит от оптической плотности пробы, поэтому в качестве образца нельзя использовать цельную кровь, можно использовать только плазму. По этой же причине сложные пробы отбраковываются, а используемые реагенты должны быть прозрачными.
Оптический способ имеет лучшую чувствительность при замедленном образовании сгустка, при низком уровне фибриногена, на фоне антикоагулянтной терапии и в случае, если колебания шарика рвут слабые нити фибрина. С другой стороны, при скрининговых исследованиях (область использования полуавтоматических коагулометров) доля пациентов с такими особенностями свертывающей системы очень мала. Они обычно наблюдаются в специализированных клиниках, с другим парком оборудования и набором тестов. Поэтому вышеупомянутая особенность оптического метода не дает какого-либо ключевого преимущества в сравнении с механическим методом в области применения полуавтоматических коагулометров.
Физические характеристики плазмы (мутность, желтушность)


