Антиаритмические препараты
Антиаритмические препараты – это лекарственные средства, которые нормализуют нарушенный ритм сокращений сердца. Их активные компоненты могут принадлежать к различным типам химических соединений, а также относиться к разным классам фармакологических препаратов.
Классификация препаратов
Существует несколько классификаций антиаритмических препаратов. Наиболее известной является классификация Vaughan-Williams (1971), согласно которой выделяют 4 класса антиаритмиков.
I класс. Вещества, блокирующие быстрые натриевые каналы. Препараты этой группы способствуют снижению скорости деполяризации и замедляют проводимость по волокнам Пуркинье и пучку Гиса. Среди множества современных антиаритмических препаратов этой группы особого внимания заслуживает пропафенон. Пропафенон вызывает дозозависимое снижение скорости деполяризации, угнетает фазу 0 потенциала действия и его амплитуду в волокнах Пуркинье, что приводит к удлинению эффективного рефрактерного периода в предсердиях, атриовентрикулярном узле, дополнительных пучках, и, в меньшей степени, в желудочках
II класс. Бета-адреноблокаторы – снижают воздействие на сердечную мышцу симпатических (адренергических) импульсов, которые могут играть определенную роль в развитии аритмии. Большая часть средств этой группы способствует урежению частоты сердечных сокращений, снижению синоатриальной и атриовентрикулярной проводимости.
III класс. Препараты, которые замедляют реполяризацию. К ним относятся соталол и амиодарон. Антиаритмики этой группы способствует увеличению длительности потенциала действия (ПД) кардиомиоцитов, замедлению проведения импульса по всем областям проводящей системы сердца.
IV класс. К IV группе относятся антагонисты ионов кальция, которые блокируют «медленные» кальциевые каналы. Способствуют ингибированию медленного тока ионов кальция в клетки миокарда, что снижает автоматизм эктопических очагов возбуждения в сердце.
Механизм действия
До сих пор не выяснены механизмы действия антиаритмических средств. Тем не менее, многие препараты обладают схожим эффектом. Антиаритмические препараты изменяют поток ионов натрия, калия и кальция через мембрану кардиомиоцитов, в результате чего происходит изменение ее электрического потенциала. Основной электрофизиологический эффект – изменение скорости и продолжительности фаз ПД, скорости проведения электрического импульса, рефрактерности и автоматизма сердечной мышцы.
Основные антиаритмические препараты
Пропафенон (Пропанорм) – один из наиболее эффективных и безопасных лекарственных препаратов, который используется для лечения наджелудочковых и желудочковых нарушений сердечного ритма (экстрасистолии). Помимо свойств препаратов I класса по классификации Vaughan-Williams пропафенон сочетает в себе еще и свойства антиаритмических средств II, III, IV классов. Основным электрофизиологическим эффектом препарата является блокада трансмембранных натриевых каналов. Пропафенон вызывает дозозависимое снижение скорости деполяризации, угнетает фазу 0 потенциала действия и его амплитуду в волокнах Пуркинье, что приводит к удлинению эффективного рефрактерного периода в предсердиях, атриовентрикулярном узле и, в меньшей степени, в желудочках. Структурная организация молекулы пропафенона схожа с антагонистами β-адренорецепторов, в связи с чем он обладает легким β-блокирующим эффектом (соответствует примерно 1/40 части активности пропранолола). Кроме того, основные метаболиты пропафенона оказывают умеренно блокирующее действие на кальциевые каналы.
Аллапинин. Антиаритмический препарат I класса, основным механизмом действия которого является блокада быстрых натриевых каналов мембран кардиомиоцитов. Замедляет AV- и внутрижелудочковую проводимость, уменьшает эффективный рефрактерный период кардиомиоцитов предсердий, AV-узла, пучка Гиса и волокон Пуркинье. Аллапинин не рекомендуется применять у пациентов с явлениями сердечной недостаточности, так как он может ухудшить сократительную функцию миокарда. При приеме нагрузочной дозы препарата возможно увеличение продолжительность интервала QT.
Новокаинамид. Относится к I классу антиаритмических препаратов, блокирует быстрые натриевые каналы, что приводит к снижению скорости деполяризации и замедлению реполяризации, увеличивает длительность рефрактерного эффективного периода кардиомиоцитов. При внутривенном введении новокаинамида возможно угнетение проводимости, резкое снижение АД, возникновение тяжелых побочных эффектов.
Амиодарон (Кордарон). – относится к антиаритмическим препаратом III класса, вместе с тем обладая небольшим альфа- и бета-адреноблокирующим эффектом. Оказывает антиангинальный, коронародилатирующий эффект, обладает незначительным гипотензивным эффектом. Препарат применяется для лечения самых разнообразных нарушений сердечного ритма, в том числе у больных с синдромом WPW. При длительном приеме амиодарона возможно возникновение внесердечных побочных эффектов из-за накопления в тканях молекулы йода, входящей в состав препарата.
Соталол. обладает основными свойствами препаратов III класса и незначительным бета-блокирующим эффектом. Вызывает равномерное удлинение фаз реполяризации и потенциал действия, может назначаться больным ИБС.
Обращаем ваше внимание! Эта статья не является призывом к самолечению. Она написана и опубликована для повышения уровня знаний читателя о своём здоровье и понимания схемы лечения, прописанной врачом. Если вы обнаружили у себя схожие симптомы, обязательно обратитесь за помощью к доктору. Помните: самолечение может вам навредить.
Экстрасистолия – симптомы и лечение
Что такое экстрасистолия? Причины возникновения, диагностику и методы лечения разберем в статье доктора Белоус А. В., кардиолога со стажем в 7 лет.


Определение болезни. Причины заболевания
Экстрасистолией (лат. “extra” — вне, снаружи + греч. “systole” — сокращение, сжатие) называют внеочередное сокращение сердца, преждевременное по отношению к основному его ритму [1] [4] .
Эта патология может быть как функционального, так и органического происхождения. Чаще всего экстрасистолы носят функциональный характер, то есть возникают в отсутствие серьёзного структурного поражения сердца.
Факторы, провоцирующие функциональные экстрасистолы:
- стрессовые ситуации;
- чрезмерные физические нагрузки;
- курение, употребление алкоголя и наркотических веществ;
- злоупотребление крепким кофе и чаем.
Экстрасистолы органического происхождения могут возникать на фоне следующих состояний:
- ишемической болезни сердца — стенокардии, острого инфаркта миокарда или же постинфарктного кардиосклероза;
- воспалительных заболеваний, поражающих сердце — эндокардите, миокардите, перикардите;
- пороков сердца;
- гипертрофии миокарда, которая развивается чаще всего при артериальной гипертонии;
- поражениях сердца при системных заболеваниях — гемохроматозе, саркоидозе, амилоидозе, аутоиммунных заболеваниях.
Экстрасистолы встречаются у 65-70 % здоровых людей, а при длительном мониторировании ЭКГ — практически у всех [15] .
Экстрасистолия относится к числу самых безобидных аритмий, и сама по себе не влияет на продолжительность жизни, а зачастую не влияет и на самочувствие. Однако её безобидность относительна: хотя сама по себе экстрасистолия ничем не угрожает, но при наличии органического заболевания желудочковая экстрасистолия может привести к серьёзным осложнениям, прежде всего — к фатальным аритмиям.
Именно по этой причине желудочковая экстрасистолия более опасна чем предсердная или атриовентрикулярная экстрасистолия.
Симптомы экстрасистолии
Симптомы при экстрасистолии могут отсутствовать, особенно если она возникает на фоне органического заболевания сердца. Частые симптомы, которыми проявляется экстрасистолия:
- толчки и сильные сердечные удары;
- ощущение замирания в груди;
- перебои в работе сердца.
Функциональные экстрасистолы могут возникать на фоне неврозов или при нарушении работы вегетативной нервной системы. При этом присутствует:
- бледность кожных покровов либо гиперемия (покраснение) лица;
- приливы жара;
- тревога;
- повышенная потливость;
- чувство нехватки воздуха, страх, нарушение сна, дрожь в теле.
Патогенез экстрасистолии
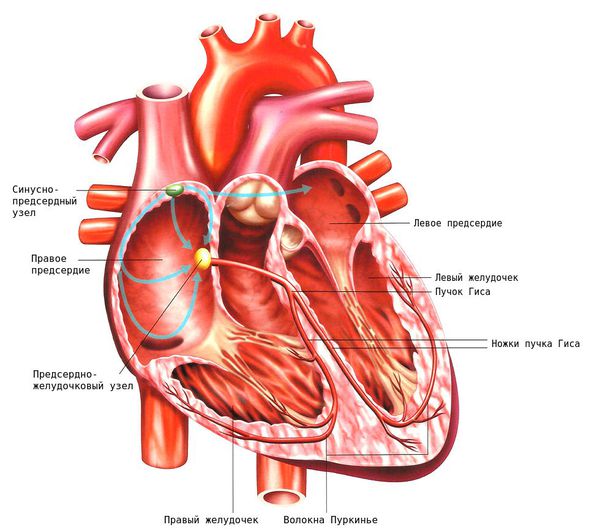
Сердце — полый мышечный орган, у человека и теплокровных животных имеет четырёхкамерное строение [13] . Сердце способно самостоятельно сокращаться через определённые промежутки времени. Эта функция называется автоматизмом и возможна благодаря возникновению электрических импульсов в самом сердце, точнее в его проводящей системе.
Проводящая система сердца — это комплекс специальных клеток, обеспечивающих возникновение и распространение электрического импульса по миокарду. Благодаря этому становится возможным последовательное, координированное сокращение миокарда. Проводящая система сердца представлена синусным узлом, атриовентрикулярным узлом (между предсердиями и желудочками), пучком Гиса с левой и правой ножкой, волокнами Пуркинье.
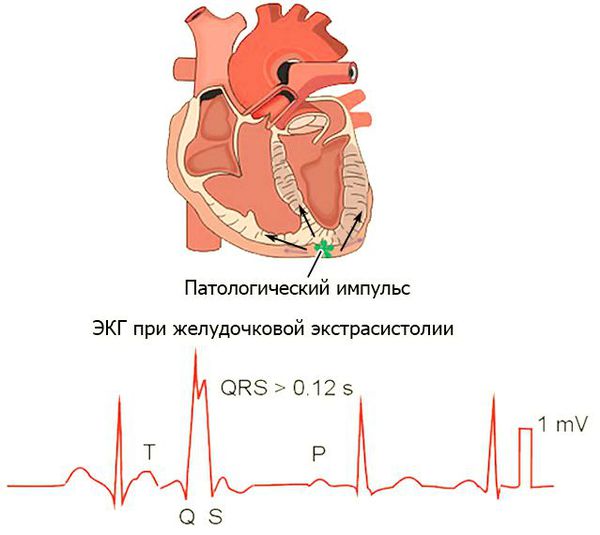
Один из механизмов развития экстрасистолии — повторный вход волны электрического возбуждения [4] .
При развитии в отдельных участках миокарда патологических процессов электрические свойства этих участков миокарда и проводящей системы сердца могут существенно отличаться друг от друга. К таким патологическим процессам относятся ишемия, дистрофия, некроз, кардиосклероз, а также значительные метаболические нарушения. Возникает разная скорость проведения электрического импульса и развиваются однонаправленные блокады проведений и участки замедленного распространения электрических импульсов.
Возбуждение этого участка может повторно распространяться на рядом лежащие отделы сердца ещё до того, как к ним вновь подойдет очередной импульс из синоатриального узла. Возникает повторный вход волны возбуждения в те отделы сердца, которые только что вышли из состояния рефрактерности (“нечувствительности”), в результате чего наступает преждевременное внеочередное возбуждение сердца — экстрасистола.
Другой механизм развития экстрасистол — патологический автоматизм, когда электрические импульсы зарождаются не там, где это предусмотрено нормальным ходом процесса.
Классификация и стадии развития экстрасистолии
Классификация экстрасистол по локализации:
- синусовые — исходят из области около синусового узла, расположенного в стенке левого предсердия;
- предсердные — источником является миокард правого или левого предсердий;
- узловые — возникают в узле проводящей системы, располагающемся между предсердиями и желудочками;
- желудочковые — появляются в миокарде правого или левого желудочков;
Классификация экстрасистол по этиологическому фактору:
- функциональные;
- органические;
Классификация по количеству очагов экстрасистолических импульсов:
- Монотопные мономорфные экстрасистолы — из одного источника возникновения, на ЭКГ имеют одинаковую форму.
- Монотопные полиморфные экстрасистолы — из одного источника возникновения, но имеют разную форму, скорость проведения и пути распространения импульса в желудочках.
- Политопные экстрасистолы — исходят из нескольких очагов, разные экстрасистолические комплексы, которые отличаются друг от друга по форме.
Классификация экстрасистол по количеству:
- Одиночные экстрасистолы — экстрасистолические сердечные циклы редкие и возникают нерегулярно.
- Аллоритмии — вид аритмии, при котором происходит чередование основного ритма и экстрасистол с определённой последовательностью. Выделяют следующие типы:
- бигеминия — экстрасистола следует после каждого нормального сокращения;
- тригеминия — после двух основных комплексов;
- квадригеминия — после трёх нормальных комплексов;
- пентагеминия — экстрасистолы регулярно повторяются через четыре сердечных цикла.
- Парные — две экстрасистолы подряд.
- Групповые — более двух, но менее пяти (часто такие эпизоды называют “пробежками”, если частота сердечных сокращений в эпизоде соответствует тахикардии – 100 и более сокращений в минуту).
Классификация желудочковых экстрасистол по Лауну-Вольфу-Райяну по степени их негативного влияния на прогноз:
- 0 — отсутствие желудочковых экстрасистол;
- I — до 30 экстрасистол за час мониторирования;
- II — более 30 экстрасистол за час мониторирования;
- III — полиморфные экстрасистолы;
- IVa — парные мономорфные экстрасистолы;
- IVb — парные полиморфные экстрасистолы;
- V — пробежки желудочковой тахикардии (три и более комплексов подряд).
В международной классификации болезней утверждена следующая кодировка экстрасистолии:
- I49.1 — Преждевременная деполяризация предсердий ;
- I49.2 — Преждевременная деполяризация, исходящая из АВ-соединения ;
- I49.3 — Преждевременная деполяризация желудочков ;
- I49.4 — Другая и неуточнённая преждевременная деполяризация [5] .
Осложнения экстрасистолии
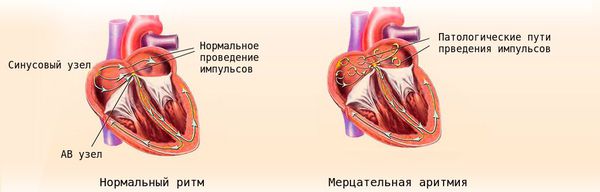
Наджелудочковая экстрасистолия не связана с повышенным риском внезапной смерти, однако в редких случаях она может стать причиной суправентрикулярной тахикардии — разновидности аритмии, приводящей к резкому и продолжительному увеличению частоты сердечных сокращений. Кроме того, у больных с пароксизмами фибрилляции предсердий именно предсердные экстрасистолы могут “запускать” эти пароксизмы фибрилляции — волны хаотического повторного возбуждения в предсердиях, опасные риском развития сердечной недостаточности[10].
Имеются отдельные публикации, где было показано, что желудочковые экстрасистолы могут свидетельствовать о повышении риска смерти в будущем. Эти случаи затрагивали экстрасистолии, возникающие при физических нагрузках, особенно на этапе восстановления [11].
На сократительной функции желудочков очень частые желудочковые экстрасистолы могут сказываться негативно, однако это возможно в основном при очень большом количестве экстрасистол — десятки тысяч. При значительном структурном поражении сердца желудочковые экстрасистолы могут косвенно указывать на повышенный риск внезапной сердечной смерти.
Диагностика экстрасистолии
Заподозрить экстрасистолию можно при наличии жалоб пациента на перебои в работе сердца. Экстрасистолы распознаются при пальпации пульса, а также при выслушивании сердца фонендоскопом, однако определить источник экстрасистолии (суправентрикулярная или желудочковая) таким путем невозможно. Основной метод диагностики экстрасистолии — это электрокардиография и суточное мониторирование ЭКГ, т. е. запись электрических потенциалов сердца с поверхности тела [2].
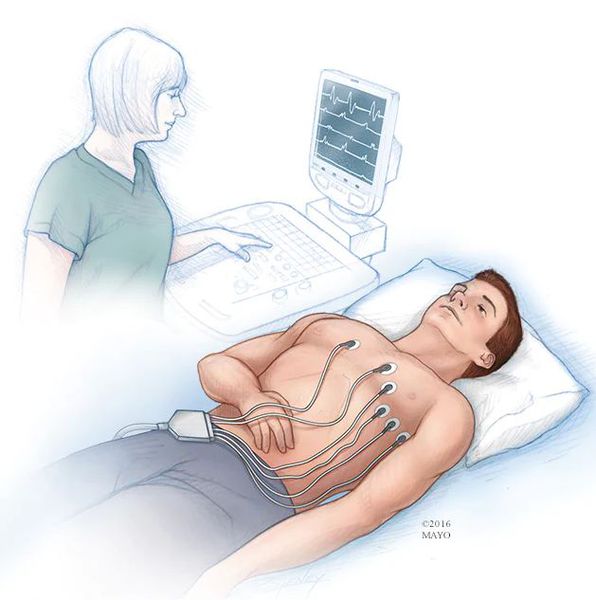
Таким образом, диагностика экстрасистолии включает:
- Сбор анамнеза. Врач уточняет обстоятельства, при которых появляется аритмия — на фоне эмоциональных или физических нагрузок, в покое, во время сна, после обильного приёма пищи; длительность и частоту эпизодов, приём медикаментов, наличие заболеваний, в том числе перенесённых ранее, вредных привычек.
- Физикальное обследование — измеряется артериальный пульс и давление, проводится аускультация (“выслушивание”), пальпация (“ощупывание”), перкуссия (“простукивание”) сердца и сосудов.
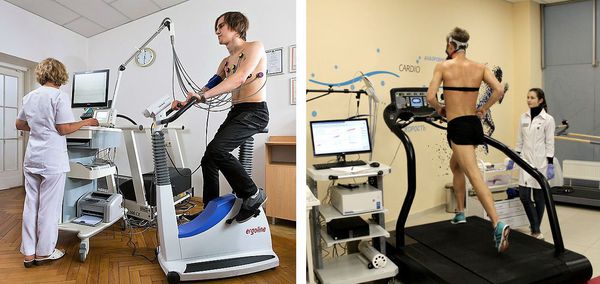
- Инструментальные исследования — стандартная электрокардиография, холтеровское мониторирование ЭКГ за сутки и более при необходимости, эхокардиография (УЗИ сердца), ЭКГ с нагрузкой (велоэргометрия, тредмил-тест).
Велоэргометрия регистрирует ЭКГ и показатели артериального давления на фоне физической нагрузки и после её завершения. Во время диагностики пациент вращает педали специального тренажёра (велоэргометра) с возрастающей скоростью, либо идет по ленте движущейся дорожки (тредмил). Нагрузка при этом возрастает постепенно.
С помощью двух последних методов выявляют экстрасистолы, возникающие именно при физических нагрузках.
Также для уточнения диагноза могут потребоваться лабораторные исследования:
- клинический анализ крови для выявления анемии;
- биохимический анализ крови для обнаружения почечной или печёночной недостаточности, повышенного уровня глюкозы;
- электролитный состав крови для определения повышенного или пониженного уровня калия;
- скрининг функции щитовидной железы с исследованием гормонального статуса — тиреотоксикоз и гипотиреоз могут приводить нарушениям ритма сердца;
- исследование репродуктивной системы — нарушение менструального цикла, а также наступление перименопаузы и менопаузы, особенно обусловленное патологическими гормональными изменениями, может опосредованно приводить к нарушению баланса в вегетативной системе и провоцировать возникновение нарушений ритма сердца;
- исследование надпочечников — эти органы принимают непосредственное участие в регуляции электролитного баланса, нарушение их функции может приводить к изменению концентраций электролитов в крови (калия, натрия, хлора, кальций, фосфора), электролитному дисбалансу в миокарде и к появлению экстрасистол.
Лечение экстрасистолии
Лечение экстрасистолии может быть медикаментозным, либо хирургическим (радиочастотная аблация). Кроме того, врач пытается выявить причины экстрасистолии и воздействовать на них (этиотропное лечение). Далеко не всегда экстрасистолия вообще требует лечения.
Этиотропное лечение
Поиск причин и воздействие на них составляет основу данного подхода, который, однако, не всегда возможно реализовать. При экстрасистолии вегетативного происхождения показана консультация невролога или психотерапевта. Часто применяемые в таких ситуациях успокоительные растительные сборы (пустырник, валериана, мелисса, настойка пиона) не имеют серьёзной доказательной базы.
Психотропные препараты применяются либо тогда, когда есть отчётливая связь между психоэмоциональными нарушениями и экстрасистолией, либо (чаще), когда экстрасистолия усугубляет фоновую тревожность или депрессию. Это могут быть как транквилизаторы, так и антидепрессанты.
Если есть основания думать, что экстрасистолия вызвана приёмом лекарственных средств, например диуретиков, противоаритмических препаратов, бета-адреностимуляторов или антидепрессантов, то возможна их пробная отмена.
В случаях, когда экстрасистолия протекает бессимптомно или малосимптомно, её лечение обычно не требуется [3]. В том случае, если пациент субъективно плохо переносит экстрасистолию, а самих экстрасистол достаточно много (тысячи), возможна лекарственная терапия. Препарат выбирают в зависимости от вида экстрасистолии и частоты сокращений сердца. Экстрасистолия обычно хорошо поддаётся лечению антиаритмическими препаратами. В клинической практике применяют классификацию антиаритмических препаратов по E. Vaughan- Williams:
1. Класс I. Мембраностабилизирующие препараты, блокаторы натриевых каналов. Подразделяются на классы Ia, Ib и Ic.
- класс Ia Хинидин , Новокаинамид, Дизопирамид, Аймалин ;
- класс Ib Лидокаин , Дифенин , Мексилетин ;
- класс Ic Флекаинид, Пропафенон , Этацизин , Аллапинин.
5. Класс II. Бета-блокаторы Пропранолол , Метопролол , Атенолол , Бисопролол . Устраняют влияние симпатической нервной системы на миокард.
6. Класс III. Средства, увеличивающие продолжительность потенциала действия, блокаторы калиевых каналов ( Амиодарон , Соталол , Дронедарон .
7. Класс IV. Блокаторы кальциевых каналов Верапамил , Дилтиазем .
Прочие средства, не вошедшие в классификацию, но применяющиеся для лечения аритмий (препараты калия, Аденозин , сульфат магния, сердечные гликозиды).
Если экстрасистолы на фоне достаточно длительной терапии или их число многократно уменьшается, может быть предпринята пробная отмена лекарственного препарата. В части случаев экстрасистолия после этого не возобновляется.
Для назначения антиаритмического средства и подбора его дозировки проводится суточное ЭКГ-мониторирование. В дальнейшем, что оценить эффективность лечения и исключить развитие побочных эффектов, необходим контроль за количеством экстрасистол в ходе выполнения повторного суточного мониторирования ЭКГ [6] .
Хирургическое лечение
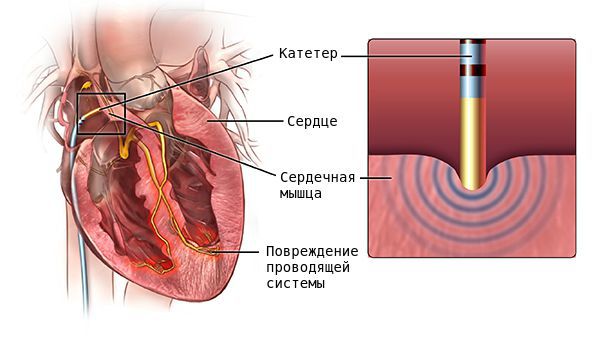
В случае неэффективности медикаментозой терапии и при наличии большого количества экстрасистол (десятки тысяч за сутки), возможно выполнение радиочастотной катетерной абляции (РЧА). В ходе вмешательства выявляется локализация очага аритмии и его последующее устранение с помощью строго локального радиочастотного воздействия на определенный участок миокарда. РЧА была внедрена в начале 1980-х годов и стала методом выбора для лечения многих аритмий, заменив многие оперативные вмешательства на открытом сердце и став альтернативой лекарственной терапии [8] .
Прогноз. Профилактика
Прогноз зависит от наличия органического поражения сердца и от степени нарушения функции желудочков. Риск аритмической смерти значительно увеличен, если частая желудочковая экстрасистолия регистрируется у больных, перенесших инфаркт миокарда, особенно при низкой сократимости сердца [16] .
При серьёзном органическом поражении миокарда (например, при низкой сократимости левого желудочка после перенесенного инфаркта миокарда) существует риск развития тяжелых желудочковых нарушений сердечного ритма, способных привести к смерти. Это желудочковая тахикардия и фибрилляция желудочков. При отсутствии органического поражения сердца экстрасистолия существенно прогноз не отягощает.
Профилактика заключается в предотвращение тех заболеваний сердца, на фоне которых экстрасистолия часто развивается, а также тех воздействий, о которых известно их проаритмогенное влияние:
- кардиомиопатию;
- ишемическую болезнь сердца;
- миокардит;
- метаболические, электролитные и других нарушения.
Также для профилактики следует:
- исключить медикаментозную, пищевую и химическую интоксикации;
- отказаться от курения, употребления алкоголя и крепкого кофе;
- нормализовать режим труда и отдыха, отрегулировать режим сна, питание, заниматься умеренной физической активностью, постараться минимизировать воздействие стрессов.
Лекарственные препараты следует принимать под строгим контролем врача. Своевременная диагностика и лечение заболеваний сердца и других органов — залог успешной профилактики. При появлении симптомов экстрасистолии следует обязательно обратиться к врачу [14] .
Показания для назначения антиаритмических препаратов при разных экстрасистолиях
Механизмы действия антиаритмических средств можно классифицировать в зависимости от их влияния на интактное сердце (клиническая классификация) или в соответствии с их действием на клеточном уровне, описанным в исследованиях in vitro (классификация в зависимости от характера влияния на потенциал действия).
Последняя из упомянутых классификаций используется чаще всего, хотя ее практическое значение весьма ограниченно.
Согласно этой классификации антиаритмические препараты подразделяются на 3 группы в зависимости от их основной точки (точек) действия в интактном сердце.
К первой группе относятся средства, основным действием которых является замедление проведения в АВ-узле. Таким образом, эти препараты могут оказаться полезными в лечении аритмий суправентрикулярного происхождения.
Во вторую группу объединены лекарственные средства, оказывающие действие в основном при желудочковых нарушениях ритма сердца. К третьей группе относятся препараты, которые действуют на предсердия, желудочки и (в случаях синдрома WPW или АВРТ) на дополнительные АВ-пути.
Таким образом, антиаритмические средства последней группы могут быть эффективными как при суправентрикулярных, так и при желудочковых аритмиях.
Классификация антиаритмических средств в зависимости
от основной точки (точек) действия в интактном сердце
| Точка действия | Примеры лекарственных средств |
| АВ-узел | Верапамил, дилтиазем, аденозин, дигоксин, БАБ |
| Желудочки | Лидокаин, мексилетин |
| Предсердия, желудочки, дополнительные пути АВ-проведения | Хинидин, дизопирамин, амиодарон, флекаинид, прокаинамид, соталол, пропафенон |

Классификация в зависимости от характера влияния на потенциал действия
Согласно этой классификации в зависимости от электрофизиологических эффектов на клеточном уровне препараты делятся на 4 основных класса.
I класс
Препараты I класса блокируют транспорт натрия через клеточную мембрану в начале активации клетки и, таким образом, снижают скорость нарастания потенциала действия (фаза 0). Они подразделяются на подклассы А, В и С в зависимости от их влияния на продолжительность потенциала действия (который на стандартной ЭКГ отражается длительностью интервала QT).
Препараты класса IA увеличивают продолжительность потенциала действия, класса IB – уменьшают этот показатель, а класса IС – оказывают лишь незначительный эффект. Антиаритмическое действие препаратов класса IB ограничивается лишь желудочками, а действие препаратов, относящихся к классам IA и IС, направлено и на предсердия, и на желудочки.
Препараты класса IA, особенно IС, замедляют внутрижелудочковое проведение, а препараты класса IA могут существенно увеличивать продолжительность интервала QT.
II класс
Препараты II класса препятствуют воздействию симпатической нервной системы на сердце. Они не влияют на потенциал действия большинства кардиомиоцитов, однако уменьшают наклон кривой спонтанной деполяризации (фаза 4) клеток с пейсмейкерной активностью и, таким образом, снижают частоту генерации импульсов.
III класс
Препараты III класса блокируют транспорт ионов калия через клеточную мембрану. Они увеличивают продолжительность потенциала действия и, следовательно, длительность рефрактерного периода и интервала QT, однако не замедляют фазу 0.
IV класс
Препараты IV класса препятствуют транспорту кальция через клеточную мембрану, который следует за входящим потоком натрия во время активации клеток. Наиболее чувствительны к действию этих препаратов клетки синусового и АВ-узлов. Необходимо заметить, что блокаторы кальциевых каналов, являющиеся производными дигидропиридина (нифедипин, амлодипин), не обладают антиаритмической активностью.
Ограничения классификации в зависимости от характера влияния на потенциал действия. Большинство препаратов относятся к I классу, а средства «внутри» этого класса существенно отличаются друг от друга по клиническим эффектам. Некоторые препараты обладают чертами, присущими средствам разных классов (например, амиодарон, основное действие которого характерно для препаратов III класса, также оказывает действие, присущее препаратам I, II и IV классов).
Более того, некоторые средства (например, аденозин и дигоксин) не могут быть отнесены ни к одному из вышеперечисленных классов.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
3.5.5. Антиаритмические средства
| Листать назад | Оглавление | Листать вперед |
В нормальных условиях у здорового человека сердце сокращается ритмично. Ритм обеспечивают периодически возникающие в самой сердечной мышце процессы возбуждения, вызывающие сокращения предсердий и желудочков в определенной последовательности и составляющие вышеописанный цикл работы сердца.
Нарушение сердечного ритма носит название аритмии. Существует много видов аритмий. Могут изменяться частота, последовательность или сила сокращений.
 |  |
В зависимости от локализации очага возбуждения, приводящего к аритмии, различают наджелудочковые (предсердные) и желудочковые аритмии.
Точно установить причину заболевания удается не всегда, потому что таких причин может быть много. Аритмия может развиться после инфаркта миокарда, когда повреждение сердечной мышцы затрудняет нормальное проведение импульсов. Более чем у 80% пациентов с острым инфарктом миокарда возникают аритмии. К аритмии может привести нарушение обмена минеральных веществ – калия, магния, кальция, натрия, которые играют важную роль в процессах возникновения и распространения электрических импульсов в сердце. Причиной аритмии могут также стать некоторые лекарственные средства, например, сердечные гликозиды . Свою “лепту” в развитие аритмии могут внести нарушения нервной регуляции деятельности сердца. Если аритмия угрожает здоровью (а в некоторых случаях она может угрожать и жизни) пациента, назначают лекарства, помогающие уменьшить ее проявления.
Большинство существующих антиаритмических средств можно по преобладающему механизму действия разделить на три основные группы:
Как известно, возникновение и распространение электрического импульса в клетках вообще и в клетках сердца в частности связано с активностью ионных каналов, среди которых особая роль принадлежит натриевому каналу. Вещества, блокирующие эти каналы, стабилизируют клеточные мембраны (их еще так и называют мембраностабилизирующими) и препятствуют аномальному возникновению и распространению электрических импульсов. Неправильно работающая клетка становится электрически “молчащей”, в то время как активность нормальных клеток не изменяется. Однако при увеличении дозы эти вещества подавляют проведение импульса и в нормальных тканях, провоцируя аритмию. Более того, даже терапевтическая концентрация препарата может стать “аритмогенной” при частом сердцебиении, ацидозе или гиперкалиемии.
Родоначальник препаратов этой группы – хинидин, являющийся производным хинина – алкалоида коры хинного дерева. К ней относят также прокаинамид , дизопирамид , лидокаин , мексилетин , морицизин , пропафенон и другие. Все они имеют одинаковый механизм действия, сходный с действием местных анестетиков, блокирующих натриевые каналы внутри клетки.
Эта группа лекарств уже обсуждалась в главе 3.2 и немного в этой главе. Бета-адреноблокаторы, наряду с другими фармакологическими свойствами, способны понижать возбудимость сердца. Вы уже знаете, что непроизвольная деятельность сердечно-сосудистой системы регулируется вегетативной нервной системой, в частности ее симпатическим отделом, с участием химических посредников – медиаторов, передающих импульсы с одной нервной клетки на другую. Стресс, волнение, интенсивная физическая работа стимулируют выработку таких медиаторов, а они, в свою очередь, возбуждают рецепторы сердца, вызывая ответ на возрастающую потребность организма в кислороде. Блокируя бета-рецепторы в клетках сердца, бета-адреноблокаторы изменяют их ответ на ряд медиаторов, объединенных общим названием катехоламины (норадреналин тоже является катехоламином). В результате устраняется влияние этих медиаторов на сердце, снижаются возбудимость и частота сердечных сокращений, нормализуется ритм.
3. Лекарства, блокирующие кальциевые каналы.
Каналы в клеточных мембранах, по которым происходит движение ионов кальция в клетку и из нее, так же как и другие ионные каналы, участвуют в регулировании частоты и интенсивности электрических импульсов, возникающих в клетке. Блокаторы кальциевых каналов, о которых мы рассказывали чуть выше, препятствуют транспорту ионов кальция внутрь клетки и, тем самым, замедляют проведение электрических импульсов. Это приводит к торможению водителя ритма и, следовательно, к урежению сокращений. Наиболее отчетливыми антиаритмическими свойствами среди блокаторов кальциевых каналов обладают верапамил и дилтиазем .
Помимо вышеперечисленных имеются и другие лекарства, обладающие антиаритмическими свойствами, но проявляющие их благодаря иным механизмам действия. Например, амиодарон , который сочетает свойства блокатора натриевых, кальциевых каналов, бета-адренорецепторов, но в дополнение к этому блокирует еще и калиевые каналы. Снижение выведения ионов калия из клеток приводит к замедлению или прекращению генерации импульса. В результате удлиняется период пониженной возбудимости клеток миокарда, и ослабляются колебания мембранного потенциала, лежащие в основе распространения возбуждения. Возбудимость и проводимость сердечной мышцы угнетаются, сердечные сокращения урежаются, а ритм восстанавливается.
При аритмиях применяются и препараты калия. Они увеличивают концентрацию внеклеточного калия, что тормозит выход его из клеток и, таким образом, возникновение и проведение электрических импульсов.
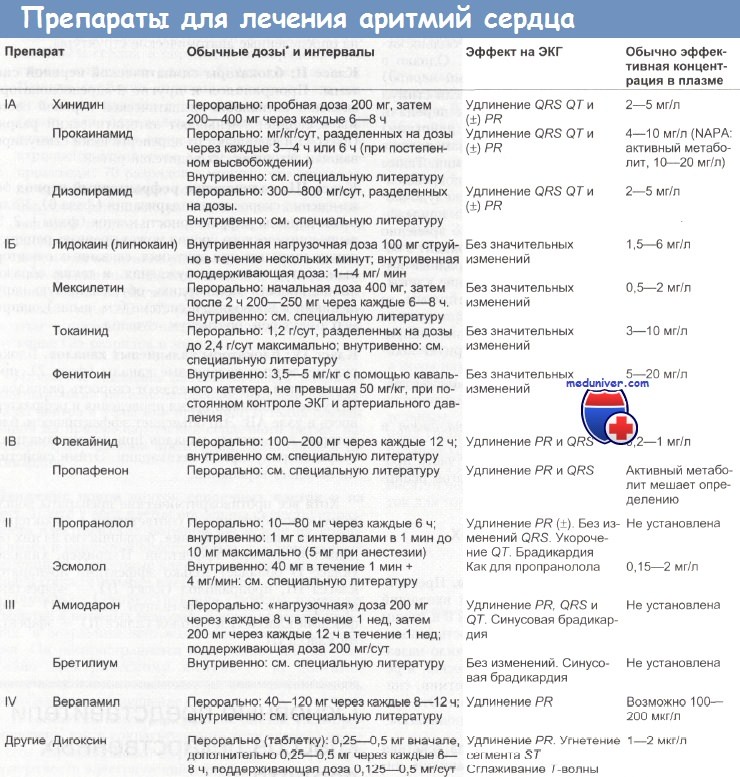
Ниже представлен список препаратов, часто использующихся для лечения аритмий. Более подробную информацию можно получить на сайте www.rlsnet.ru.
Аллапинин (лаппаконитина гидробромид) антиаритмическое, местноанестезирующее, седативное табл. ВИЛАР ПЭЗ (Россия)
Амиокордин (амиодарон) антиаритмическое табл. KRKA (Словения)
Кардиодарон (амиодарон) антиаритмическое табл. произв.: Щелковский витаминный завод (Россия)
Кордарон (амиодарон) антиаритмическое, антиангинальное р-р д/ин.; табл.дел. Sanofi-Synthelabo (Франция)
Лидокаин (лидокаин) антиаритмическое, местноанестезирующее р-р д/ин. Egis (Венгрия)
Нибентан (нибентан) антиаритмическое р-р д/инф. Верофарм (Россия)
Опакордэн (амиодарон) антиаритмическое, антиангинальное табл.п.о. Polpharma (Польша)
Панангин (калия и магния аспарагинат) антиаритмическое, восполняющее дефицит магния и калия р-р д/ин.; табл.п.о. Gedeon Richter (Венгрия)
Пропанорм (пропафенон) антиаритмическое табл.п.о. PRO.MED.CS Praha a.s. (Чешская Республика)
Ритмиодарон (амиодарон) антиаритмическое, спазмолитическое табл. ICN Pharmaceuticals (США), произв.: Ай Си Эн Лексредства (Россия)
Седакорон (амиодарон) антиаритмическое, антиангинальное конц.д/инф.; табл. Ebewe (Австрия)
Этацизин (этацизин) антиаритмическое табл.п.о. Олайнфарм (Латвия)
Новые подходы к медикаментозной терапии аритмий
Академик Ивашкин В.Т.: – А сейчас я с удовольствием попрошу включиться в нашу работу профессора Владимира Леонидовича Дощицина. «Новые подходы к медикаментозной терапии аритмии». Пожалуйста, Владимир Леонидович.
Профессор Дощицин В.Л.: – Доброе утро, уважаемые коллеги. В который раз мы возвращаемся к теме медикаментозного лечения аритмии сердца, одному из актуальнейших вопросов кардиологии. Очень большое разнообразие аритмий, масса ситуаций и нюансов в их течении делают очень затруднительным для практических врачей ведение таких больных. Среди всего многообразия аритмий важнейшими в практическом отношении, несомненно, являются два направления. Самое важное – это внезапная аритмическая смерть, которая составляет примерно четвертую часть всех смертей вообще, потому что половина смертей взрослых людей – это сердечно-сосудистые заболевания, а половина сердечно-сосудистых смертей – это аритмическая внезапная смерть. И, конечно, профилактика внезапной аритмической смерти – это важнейшая проблема современной медицины. Внезапная смерть – это, в основном, примерно на 80% – фибрилляция желудочков, то есть желудочковая аритмия. А в суправентрикулярных аритмиях основную роль, конечно, играет фибрилляция предсердий. У нас ее называют мерцательной аритмией, хотя это более широкое понятие. Но в связи с этим возникает масса вопросов.
Что вызывает наибольшее затруднение в практической работе? Все дело в том, что аритмии сами по себе могут заметно ухудшать качество жизни, отягощать прогнозы. Но возможно вполне доброкачественное, безобидное течение аритмии и существование больного с этой аритмией в течение неопределенно долгого времени. С другой стороны – методы лечения аритмии. Я уже не говорю об оперативных методах, но и медикаментозное лечение может оказывать серьезное побочное действие и само по себе негативно влиять на прогноз. Это доказано. Или, если это лечение удачно, то аритмия устраняется и качество жизни улучшается. Так вот, каждый раз практическому врачу приходится решать, что хуже: аритмия или лечение. Иными словами, нужно или не нужно активно лечить аритмию?
В связи с этим я напомню основные группы показаний к вмешательству. Первое – это когда аритмия отягощает прогноз и несет в себе какую-то угрозу жизни. Основные из них – это угрозы внезапной аритмической смерти. Вторая группа показаний – если очевидно по клиническим и инструментальным данным негативное влияние аритмии на эффективность кровообращения, гемодинамику. И, наконец, третья группа – когда объективных показаний может не быть, но субъективно аритмия плохо переносится. Здесь тоже имеются показания, хотя в этом случае цель лечения будет другая: улучшить субъективную переносимость, при этом не обязательно полностью устранять аритмию, так как она негативно не влияет на прогноз.
Я напомню хорошо известную классификацию, которая на сегодняшний день получила наибольшее распространение, – классификацию антиаритмических лекарств. Напомню четыре основные группы. Первый класс – блокаторы натриевых каналов, там подклассы 1А, 1В, 1С, здесь показаны их основные представители. Второй класс – бета-адреноблокаторы. Третий – блокаторы калиевых каналов или препараты, замедляющие реполяризацию. И четвертый класс – блокаторы кальциевых каналов. В первом классе наибольшее значение имеет, несомненно, класс 1С, потому что он представлен используемыми на сегодняшний день препаратами – этацизин, пропафенон, аллапинин. К классам 1А и 1В относятся более старые препараты, которые постепенно уходят из широкой практики: хинидин, прокаинамид, лидокаин и так далее. Бета-блокаторы – хорошо известный класс, это не только антиаритмики, но и антиангинальные и гипотензивные препараты.
Мощный класс – третий – блокаторы калиевых каналов. Основные представители – это амиодарон и соталол, мы их рассматриваем как препараты резерва, которые назначаются, но, в основном, при неэффективности других препаратов в более сложных ситуациях. И, наконец, – антагонисты кальция, среди которых основную роль играет верапамил.
Эту классификацию критиковали многократно, и основной предмет критики заключается в том, что сюда не входят многие препараты, имеющие антиаритмическое действие. Например, дигиталис и вообще сердечные гликозиды – АТФ и другие препараты, которые как бы стоят между этими классами или имеют совершенно другие свойства. И в связи с этим, я напомню, была предложена другая классификация, так называемый «Сицилианский гамбит», который представляет собой просто описание свойств разных антиаритмических препаратов. Вот как в клеточках шахматной доски отмечены свойства, способность влиять на ионные каналы, натриевые – быстрые, средние, медленные, на кальциевые, на калиевые, на различные рецепторы – адренергические альфа-, адренергические бета-рецепторы, холинергические рецепторы и другие.
И, глядя на эту табличку, можно видеть, что многие антиаритмики обладают одновременно свойствами представителей нескольких классов, и их даже трудно классифицировать. И есть препараты (они представлены в конце) – атропин, аденозин, дигоксин, омакор – те, которые в эту классификацию не входят, а обладают другими механизмами действия. То есть это более широкое перечисление антиаритмиков, но его недостатком является то, что это – не классификация, она никак не группирует препараты и не позволяет выбирать тот или иной класс, тех или иных представителей.
Поэтому при систематизированном описании и в научных работах по аритмологии фигурирует все-таки классификация Вогана Вильямса (Vaughan Williams), и ею широко пользуются. Здесь имеется целый ряд спорных моментов. В частности, больше всего важных спорных моментов касаются 1С-класса и вообще, прежде всего, первого класса. И один из важнейших актуальнейших вопросов: можно или нельзя давать эти препараты больным ишемической болезнью сердца, острыми и хроническими ее формами, и больным с другой выраженной органической патологией сердца? Этот вопрос и на сегодняшний день не имеет однозначного ответа. После публикации, уже довольно давно, много лет назад, в исследованиях КАСТ-1 и КАСТ-2 было показано, что антиаритмики 1С-класса могут негативно влиять на прогноз больных ИБС. Но это касается, главным образом, больных острым инфарктом миокарда. Что касается хронических форм ИБС, то так однозначно судить нельзя, потому что таких работ было довольно мало, и касались они ограниченного числа препаратов без достаточного учета других противопоказаний.
На сегодняшний день бытует такая тактика, что антиаритмики первого, в частности, С-класса не следует принимать больным с выраженными признаками сердечной недостаточности (низкая фракция выброса); при острых формах ИБС (острый инфаркт, прогрессирующая стенокардия); при очень выраженной гипертрофии левого желудочка с толщиной более 14 миллиметров (по данным эхокардиографии). Есть и другие ограничения: блокада ножек, выраженная брадикардия и другие. А если ничего этого нет, то наличие умеренно выраженной патологии сердца не является прямым противопоказанием для применения препаратов 1С-класса.
Почему я обращаю на это внимание – потому что здесь лежат очень важные практические вопросы. Можно или нельзя купировать пароксизм мерцания предсердий у больного стенокардией, например, пропафеноном, этацизином, которые являются активными препаратами для этой цели. Так вот, эта табличка дает на это ответ: да, можно, если нет прямых противопоказаний в виде выраженных изменений миокарда, сердечной недостаточности, острого коронарного синдрома и так далее. Это практически очень важно.
Вот основные ограничения для применения антиаритмиков первого класса: острый коронарный синдром, сердечная недостаточность, внутрижелудочковая блокада, атриовентрикулярная блокада и резко выраженная брадикардия, скажем, синдром слабости синусового узла.
Бета-адреноблокаторы – важнейший класс препаратов. Мы их даем очень широко, лечим ишемическую болезнь сердца, артериальную гипертонию. Из аритмий, в основном, этот класс препаратов лечит, главным образом, наджелудочковые формы, то есть суправентрикулярную тахикардию, суправентрикулярную экстрасистолию, мерцание и трепетание предсердий, в основном, для урежения ритма при этих формах аритмий. Что касается желудочковых аритмий, то эффективность этого класса препаратов ниже. Но учитывая их благоприятное действие на основные болезни, то есть ишемическую болезнь, артериальную гипертонию, предпочтительно с них начинать, и может быть такая ситуация, что они окажутся эффективными и при желудочковых аритмиях тоже, и тогда больше ничего не нужно будет. Но если они окажутся неэффективными, а это примерно половина случаев, то тогда приходится решать вопрос: заменять бета-блокаторы либо на третий класс препаратов, либо добавлять к бета-блокаторам первый класс.
Третий класс препаратов, повторяю: класс резерва. Амиодарон – сильнейший, мощнейший препарат, хорошо переносится при недлительном назначении. Но при длительном назначении почти у 30% (примерно) возникают различные нежелательные эффекты, которые заставляют его ограничивать или вообще отменять. Самые частые из них – нарушение функции щитовидной железы. Второе по частоте – сердечное осложнение: брадикардии, блокады, удлинение QT с возможным аритмогенным эффектом. Возможно поражение печени, поражение легких, ну, и самое частое ограничение – это кожные реакции, которые, хотя и ничем не угрожают, но могут вызывать беспокойство больных, нарушение качества жизни.
Другой препарат этого класса – соталол – обладает нежелательными свойствами третьего класса препаратов, то есть удлиняет интервал QT, вызывает брадикардию, и поэтому противопоказан при брадикардии блокады. И как бета-блокатор он снижает артериальное давление и обладает другими побочными действиями, характерными для неселективных бета-блокаторов. А это довольно много побочных эффектов. Я напомню: это и бронхоспазмы, и негативное влияние на углеводный обмен, и возможное нарушение эректильной функции и так далее. То есть препарат хороший, эффективный, но тоже имеет значимые негативные эффекты.
Недавно был предложен другой препарат этого класса, дронедарон, который на сегодняшний день широко не используется, опять же, из-за довольно значимых выявленных побочных эффектов. В частности, он противопоказан при сердечной недостаточности: доказано, что он увеличивает летальность. У больных с перманентной фибрилляцией предсердий он не пошел, и у больных с патологией печени тоже. Сейчас пока место этого препарата не определено.
И, наконец, четвертый класс – это, в основном, верапамил. Я говорю о негативных эффектах, о возможных побочных действиях, ограничениях – это синдром предвозбуждения желудочков, выраженная сердечная недостаточность, снижение давления (это же гипотензивный препарат) и блокада и брадикардия, как и для всех других антиаритмиков.
Резюмирую все сказанное. Все антиаритмики этих основных классов имеют значимые побочные эффекты, которые существенно ограничивают возможность их применения. И приходится решать, что хуже: лечение аритмии или сама аритмия? Среди каких-то новых направлений, которые можно сегодня назвать, это появление новых препаратов с доказанными антиаритмическими свойствами, но с менее выраженными побочными эффектами. Это так называемые omega-3 полиненасыщенные жирные кислоты – эйкозапентаеновая, докозагексаеновая – в виде лекарственного препарата омакор. На сегодняшний день доказано, что этот препарат обладает антиаритмическим действием благодаря сумме механизмов. Основной из них – это влияние на ионные каналы, кальциевые и натриевые. Модуляция прохождения ионов через эти каналы является одним из основных механизмов антиаритмического эффекта. Помимо этого, этот препарат обладает противовоспалительным эффектом, антисклеротическим эффектом в виде стабилизации бляшек и не оказывает сколько-нибудь значимых побочных эффектов, свойственных другим антиаритмикам. На сегодняшний день в ряде рандомизированных исследований показана способность этого препарата усиливать антиаритмический эффект основных антиаритмиков. В частности, с амиодароном, кордароном, когда его попытались сочетать у больных с частыми пароксизмами мерцания предсердий, было показано, что добавление омакора в терапии кордароном существенно повышает эффективность терапии. Такие работы были сделаны в многоцентровых исследованиях во Франции, и в России тоже такие работы есть, в том числе, комбинация омакора с пропафеноном.
Появились сейчас работы, которые показали возможность благоприятного действия этого препарата и на желудочковую аритмию, тоже, в частности, желудочковая экстрасистола, пробежки желудочковой тахикардии, у больных ишемической болезнью сердца. Это работа кардиологов из Санкт-Петербурга. У нас такие данные тоже есть: повышение эффективности лечения желудочковых аритмий при добавлении к антиаритмикам, в частности, к амиодарону и соталексу этого самого омакора. Это позволило нам предложить вот такой алгоритм ведения больных с желудочковыми аритмиями, в частности, с желудочковой экстрасистолией у больных ишемической болезнью сердца и у больных хронической сердечной недостаточностью другой этиологии.
Вот, ИБС – я уже говорил, что обычно у таких больных мы начинаем терапию с бета-блокаторов, потому что есть антиангинальный эффект и, возможно, антиаритмический. Если не помогает, тогда возможно добавление омакора, и это может быть достаточным для того, чтобы этот эффект проявился. Если не помогает, то возможно добавление и амиодарона, или замена бета-блокатора на соталол плюс омакор, и это будет очередное усиление терапии.
Если есть сердечная недостаточность. Тут, во-первых, сразу большие дозы бета-блокаторов не пойдут, тут приходится соблюдать осторожность и приходится комбинировать маленькие дозы бета-блокаторов с ингибиторами АПФ и, возможно, с омакором. Если это не помогает, то – осторожное увеличение дозы бета-блокаторов и, возможно, добавление амиодарона. Это, конечно, не общая рекомендация, это возможный алгоритм действия для лечения желудочковых аритмий у таких больных.
Надо сказать, что сейчас имеется достаточно большая доказательная база этих крупных рандомизированных исследований, согласно которым добавление омакора к стандартной терапии больных ишемической болезнью сердца улучшает прогноз. Вот это – хорошо известное исследование GISSI-Prevention, где брались больные инфарктом миокарда, получавшие стандартную терапию; и опытная группа – к этой терапии добавлялся омакор. Было показано доказательное снижение общей смертности и значительное снижение риска аритмической смерти.
Второе исследование – GISSI-HF – это больные с сердечной недостаточностью, довольно неблагоприятная прогностически группа больных. Опять – группа больных, получающих стандартную терапию: диуретики, ингибиторы АПФ и так далее. И эта терапия – плюс омакор. Опять было получено снижение общей смертности, снижение аритмической смерти и госпитализации по поводу желудочковых аритмий.
Все эти данные позволили включить омакор в рекомендации по профилактике внезапной смерти – это рекомендация Американской ассоциации сердца и Европейского кардиологического общества; рекомендация по ведению больных нестабильной стенокардией Европейского общества кардиологов; рекомендации по реваскуляризации миокарда, опять же, европейские; по вторичной профилактике коронарных заболеваний атеросклероза – «American Heart Association»; лечение острого коронарного синдрома без подъема ST, опять же, «American Heart Association»; и по вторичной профилактике инфаркта миокарда. Ну, и одна из последних – это рекомендация по лечению больных с застойной сердечной недостаточностью, принятая в Австралии и Новой Зеландии.
Сказанное позволяет констатировать, что этот препарат эффективен как добавочное средство при профилактике пароксизмов фибрилляции предсердий; как улучшение прогноза у больных ишемической болезнью сердца. Показано, что этот препарат обладает побочными действиями, сопоставимыми с плацебо, то есть ни об одном из существующих препаратов с антиаритмическим действием такого сказать нельзя. Это, пожалуй, единственное, уникальное сочетание.
Хочу напомнить в заключение, что, когда мы лечим больных с аритмией, мы ставим перед собой цели: улучшить самочувствие больного, уменьшить симптомы аритмии, уменьшить (если есть) гемодинамические нарушения. Но одна из главных задач – это позитивно повлиять на прогноз и ни в коем случае его не ухудшить. Так вот именно этим задачам и соответствует комбинированная терапия основных антиаритмических препаратов с новым направлением, омакором.
НОВАЯ МЕТОДИКА ПОДБОРА АНТИАРИТМИЧЕСКОЙ ТЕРАПИИ У БОЛЬНЫХ С ИБС, СТРАДАЮЩИХ ЖЕЛУДОЧКОВОЙ ЭКСТРАСИСТОЛИЕЙ


Holter monitoring, antiarrhythmic treatment, ventricular extrasystoles


The method is proposed ojsearching for the antiarrhythmic treatment when every subsequent medicine is prescribed in a time interval corresponding to the duration of the previous drug action.


ВА-N21 от 28/03/2001, стр. 38-42 /.. Оригинальные исследования


Желудочковая экстрасистолия (ЭСж) относится к одному из наиболее распространенных видов аритмий у больных с ИБС. Она отягощает течение и прогноз заболевания, вызывает расстройства гемодинамики, ухудшает качество жизни больных, приводит к ограничению их работоспособности [2].
Доказана связь ЭСж высоких градаций по B.Lown с возникновением жизнеопасных аритмий (желудочковая тахикардия, фибрилляция желудочков), что позволяет считать их маркером риска внезапной смерти у больных ИБС [6,7,10].
Лечение желудочковых нарушений ритма сердца в целом и ЭСж в частности является одной из наиболее сложных задач современной аритмологии. Проведенные уже более 10 лет назад многоцентровые плацебо-контролируемые исследования CAST и CAST II резко ограничили возможности использования самой большой и перспективной группы антиаритмических препаратов (ААП), антиаритмиков 1С подкласса для пациентов, перенесших инфаркт миокарда (ИМ), со сниженной сократительной способностью сердца.
В то же время оказалось, что весьма эффективными для лечения больных с ИБС, страдающих ЭСж, могут быть бета-адреноблокаторы, в частности, селективные. Было показано, что, в существенно меньшей степени обладая устраняющим ЭСж действием в сравнении с ААП I класса, они достоверно уменьшают риск возникновения фатальных желудочковых аритмий [18]. Препараты III класса, в частности амиодарон и сота-лол, можно использовать как для устранения желудочковых аритмий, так и для снижения риска внезапной смерти (ВС) [9].
Как известно, нередко непосредственной причиной возникновения желудочковых аритмий, в том числе и жизнеопасных, у больных с ИБС является транзи-торная ишемия миокарда (ИшМ). Поэтому нитропре-параты, по мнению многих авторов, также обладают антиаритмическим действием и могут использоваться для профилактики ВС.
Таким образом, задача выбора оптимальной антиаритмической терапии (ААТ) для каждого конкретного больного является весьма актуальной. Такой подбор является совсем непростой задачей, т.к. всеми принятой методики выбора оптимальных ААП и их доз, а также единых критериев объективной оценки их эффективности не существует.
К сожалению, до настоящего времени отсутствуют общепринятые критерии эффективности лечения ЭСж. Разные авторы предлагают различные критерии оценки: например, уменьшение общего числа ЭСж на 50-84%, парных ЭСж на 75-90%, а эпизодов неустойчивой желудочковой тахикардии-на 65-100% [11,14,16,17].
Другими авторами кроме этого дополнительно учитываются морфологическая картина и интервал сцепления ЭСж. Согласно их рекомендациям, антиаритмическое лечение считается эффективным при условии выполнения каждого из следующих условий: уменьшение количества ЭС более чем на 75%; уменьшение числа парных ЭС и экстрасистол типа «R на Т» более чем на 90%; при полиморфности экстрасистол – уменьшения числа морфологических типов максимально до двух; полное исчезновение эпизодов желудочковой тахикардии (ЖТ).
Не существует единой точки зрения также по поводу методики оценки эффективности ААТ. Чаще всего при использовании холтеровского мониторирования критерии оценки эффективности ААТ используются при сравнении результатов 2-х суточных записей ЭКГ, выполненных в коротком промежутке времени. Это условие необходимо учитывать, так как по данным ряда авторов, довольно незначительная разница в результатах холтеровских исследований, выполненных с интервалом в 1-3 дня, существенно увеличивается при промежутке между исследованиями больше чем через 1-2 недели. При промежутке более трех месяцев эта разница становится настолько большой, что оценка эффективности антиаритмического лечения у большинства исследуемых больных не может быть проведена [15, 17].
В настоящее время используются три основные методики подбора ААТ. Первым, наиболее часто встречающимся способом подбора, к сожалению, остается длительный и малоэффективный эмпирический метод, основанный на опыте врача и данных литературы о механизме действия препарата. Как правило, этот метод представляет собой последовательное назначение препаратов до тех пор, пока какой-либо из них не окажется эффективным. При этом эффективность лечения чаще всего контролируется лишь с учетом данных ЭКГ и субъективных ощущений пациента [1,2].
Вполне очевидно, что выбранный таким образом препарат с высокой долей вероятности может оказаться неэффективным и, более того, может обладать проарит-мическим действием. Недостатки этого метода очевидны: он является длительным, малоэффективным, небезопасным, а также, что немаловажно, весьма дорогостоящим.
Другим довольно распространенным способом подбора ААТ является тестирование ААП с помощью острых лекарственных тестов (ОЛТ), то есть болюсно-го внутривенного введения препаратов [4]. Этот метод выгодно отличается от предыдущего, так как требует значительно меньше времени, регистрация ЭКГ во время ОЛТ позволяет получить достоверную информацию об индивидуальных антиаритмических и проаритмичес-ких особенностях действия препарата на пациента в течение довольно длительного времени.
Тем не менее, несмотря на очевидные преимущества этого метода, этот способ также не лишен недостатков. Поскольку речь идет об инвазивных тестах, этот способ подбора ААТ требует специально оборудованного кабинета, определенной квалификации врача, владеющего основами реанимации, так как внутривенное введение антиаритмиков связано с высоким риском развития осложнений и проаритмического действия препаратов, что позволяет считать этот метод весьма опасным.
Кроме того уместно заметить, что такой подбор лечения практически не может быть применен у больных с высокой спонтанной вариабельностью аритмий, число которых меняется от часа к часу в течение одних суток. Тем более неприменим этот метод у больных с высокой спонтанной вариабельностью аритмий от суток к суткам, так как не позволяет адекватно оценить эффект введенного препарата.
К тому же, многие авторы обращают внимание на отсутствие соответствия между эффективностью препарата при его парентеральном и пероральным применением. Довольно часто не наблюдается соответствия результатов ОЛТ и отдаленного эффекта терапии [3].
И, наконец, еще один способ подбора ААТ, получивший широкое распространение в связи с внедрением в последние годы в лечебную практику такого метода как динамическая электрокардиография (холтеровс-кое мониторирование, суточное мониторирование ЭКГ), заключающийся в непрерывном мониторировании ЭКГ в течение 1-3 суток до лечения и столько же времени на фоне терапии.
Мониторирование ЭКГ, проводимое до назначения терапии, дает возможность учесть индивидуальные особенности нарушений сердечного ритма у пациента, такие как распределение аритмий в течение суток, их связь с периодами сна и бодрствования, физическим и психо-эмоциональными нагрузками, эпизодами ИшМ.
Как известно, общепринятая методика подбора ААТ предусматривает назначение каждого последующего препарата не ранее, чем через пять периодов полувыведения предыдущего. При этом ААП назначаются либо коротким курсом в среднетерапевтической дозе, либо однократно, в дозе, соответствующей половине суточной. Объективный контроль эффективности препарата осуществляется с помощью ХМ.
Можно предположить, что именно такой метод подбора терапии оптимален. Однако представляется очевидным, что он является весьма дорогостоящим, так как требует достаточно продолжительного времени пребывания больного в стационаре и проведения многократных ХМ.
Таким образом, весьма актуальной является разработка не столь трудоемкой и дорогостоящей, но такой же эффективной методики подбора ААТ. В качестве альтернативы «классической» методике можно предложить способ подбора ААТ, предусматривающий назначение «нагрузочной» дозы каждого последующего препарата через более короткий интервал времени, соответствующий не пяти периодам полувыведения, а длительности действия предыдущего препарата.
Сравнению этих двух методов выбора наиболее эффективного противоаритмического средства посвящено данное исследование.
МАТЕРИАЛ И МЕТОДЫ
В группу обследования был включен 21 пациент с ИБС (14 мужчин и 7 женщин в возрасте от 42 до 70 лет) с ЭСж II-IV градаций по B.Lown. Всем пациентам, включенным в исследование, на фоне отмены ААТ продолжительностью не менее 2-х недель (для амиодарона -не менее 4-х недель) было проведено многосуточное (двух-трех – суточное) мониторирование ЭКГ на системе «Кардиотехника-4000» фирмы «ИНКАРТ» г. Санкт-Петербург для оценки спонтанной вариабельности аритмий в течение суток.
После этого всем пациентам назначались последовательно следующие препараты: нитросорбид, метопролол, мексилетин и соталол. Таким образом, были выбраны антиаритмики I, II и III классов по классификации E.M.Waughan- Williams. Нитросорбид был включен как препарат, потенциально способный устранять желудочковые аритмии за счет своего противоишемичес-кого действия. В табл. 1 представлены сведения о фармакологических свойствах выбранных препаратов.

Каждый из выбранных препаратов назначался больным последовательно по двум схемам, условно названных «длинной», или классической, и «короткой». «Длинная» схема предусматривала назначение каждого последующего препарата через пять периодов полувыведения предыдущего и, исходя из данных приведенной выше таблицы, представляла собой следующую последовательность смен препаратов: нитросорбид в дозе 20-40 мг – 6 часов, затем 50 мг метопролола -18 часов, далее – 400 мг мексиле-тина – 48 часов и, наконец, последним принимался соталол в дозе 80-160 мг – 48 часов.
Таким образом, для оценки эффективности ААТ при «длинной» схеме подбора требовалось 5 суток. Очевидно, что эта оценка осуществлялась с помощью пятисуточного мониторирования ЭКГ. После завершения подбора препаратов по «длинной» схеме пациенты получали те же препараты в тех же дозах, но по «короткой» схеме, предполагающей назначение каждого последующего препарата по истечении длительности действия предыдущего: нитросорбид – 4 часа, затем метопролол – 8 часов , мексилетин – 8 часов и, наконец, соталол – 24 часа. На «короткую» схему требовалось 2 суток, в течение которых также осуществлялось мониторирование ЭКГ. На рис. 1. последовательность назначения препаратов представлена графически.

После окончания тестирования по обеим схемам, выбирался наиболее эффективный препарат, который назначался курсом на 5-7 дней
Нами использовались наиболее распространенные критерии оценки эффективности лечения: на фоне приема ААП общее число ЭСж, по данным суточного мониторирования, должно было уменьшиться на 50% и более, число ЭС высоких градаций по Б.Лауну (III—IV градации) – на 90-100% [ ].
В настоящей работе промежуток между двумя исследованиями (контрольным без терапии и на фоне тестируемого препарата) не превышал 1 недели (от 1 до 7 дней) с учетом выполнения мониторирования ЭКГ по «длинной» и «короткой» программам по описанной выше методике. Поэтому оценку эффективности ААП можно считать вполне корректной.
Кроме того, объективность оценки эффективности терапии в сравнении с исходными данными, а также при сравнении «длинной» и «короткой» схем назначения терапии достигалась тем, что нами сравнивались часы от начала действия препарата и до окончания времени его действия с этими же часами в сутках мониторирования без терапии (соответственно у каждого больного с 2-мя или 3-мя сутками).
Таким образом удалось избежать ошибки, связанной со спонтанной вариабельностью числа ЭСж в течение суток.
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Как уже было указано выше, задачей исследования являлось сопоставление результатов подбора ААТ по «длинной» и «короткой» схемам. Для решения поставленной задачи все пациенты были по результатам лекарственного тестирования по каждому препарату в отдельности разделены на две группы.
В первую из них вошли больные, у которых п двум схемам («длинная» и «короткая») отмечались дс стоверные однонаправленные изменения (как в сторс ну уменьшения числа ЭСж на фоне приема препарате так и в сторону увеличения), а также те больные, у ко торых не было достоверных изменений на фоне при ема препарата (то есть препарат не оказывал никакоп антиаритмического действия).
Соответственно, во вторую группу были включе ны пациенты, у которых по одной схеме изменения был! статистически достоверными, а по второй – недосто верными, а также те, у которых результаты оказалис! разнонаправленными. Результаты сопоставления «длинной» и «короткой» схем подбора терапии представлены на рис. 2.

Как показано на рис. 2 , при использовании нит-росорбида результаты совпали у 14 пациентов из 21 (66,7%). Метопролол оказался одинаково эффективным (или неэффективным) в 15 случаях (71,4%). Результаты применения мексилетина совпали у 17 больных (81,0%). Действие соталола было одинаковым в 18 случаях из 21 (85,7%).
В целом результаты подбора терапии по всем четырем препаратам оказались одинаковыми при использовании «длинной» и «короткой» схем в 76,8% случаев. Эффективность только ААП (за исключением нитросор-бида, не являющегося антиаритмиком) совпала в 79,4% лекарственных тестов. Суммарные результаты представлены на рис. 3.

Таким образом, «короткая» схема лекарственного тестирования представляется вполне адекватной заменой классической методике подбора ААП. Конечно, при ее использовании не удается избавиться от некоторого искажения результатов, обусловленного суммацией (наложением) эффектов препаратов за счет их неполной элиминации. Однако очевидно, что эта погрешность невелика.
Была произведена оценка эффективности каждого из препаратов в отдельности по «длинной» и «короткой» схемам. Данные об эффективности каждого из препаратов в отдельности представлены на рис. 4. Наиболее действенным оказался соталол, который подавлял экстрасистолию у 52,4% больных (11 человек) при подборе по «длинной» и у 80,9% – по «короткой схеме (17 человек). Эффективность мексилетина составила соответственно 66,6% (14 больных) и 71,4% (15 человек). Метоп-ролол устранял экстрасистолы в 28,5% и 38,1% случаев, соответственно у 6 и 8 человек. Наконец, как и следовало ожидать, наименее значимым было воздействие нитросорбида:0,95% и 0,48%, соответственно у 2 и 1 больного.

Выявленная эффективность ААП соответствует литературным данным.
Как можно видеть, метопролол может быть использован не только для профилактики жиз-неопасных желудочковых аритмий (этот эффект селективных бета-адреноблокаторов доказан), но и для устранения ЭСж. Эго антиаритмическая эффективность составляет примерно 50%. Еще более действенными как антиаритмики оказались мекситил и соталол. Не следует, впрочем, забывать об известных ограничениях, связанных с использованием ААП I класса в целом и мексити-ла в частности у больных с ИМ и сниженной фракцией выброса.
Основным выводом ИЗ представленной работы является следующий: при подборе A AT путем тестирования ААП в качестве интервала между нагрузочными дозами антиаритмиков или их курсовым приемом можно использовать не общепринятые пять периодов полувыведения предыдущего препарата, а существенно более короткий интервал времени, соответствующий длительности действия предыдущего препарата. Это позволит существенно сократить время, необходимое для подбора ААТ и, следовательно, время пребывания больного в стационаре.
- Голицын СП. Соколов С.Ф. Медикаментозное лечение нарушений ритма сердца: выбор антиаритмической терапии и контроль ее эффективности // Кардиология – 1983.-Т 23.-N8.-с. 114-117.
- Кушаковский М.С. Аритмии сердца. // СПб – 1992. – с. 192-198.
- Сметнев А.С, Шевченко Н.М., Гросу А.А. Практические аспекты диагностики и лечения нарушений ритма сердца // Тер. архив – 1987. – Т 59. – N 5. – с. 138-142.
- Янушкевичус З.И., Бредикис Ю.Ю., Лукошявичюте А.И., Забела П.В. Нарушения ритма и проводимости сердца // М. – 1984. – с. 38-75.
- Anastasion-Nana M.I., Menlove R.L. Changes in spontaneous variability of venricular ectopic activity as function of time in patients with chonic arrhythmias. Circulation. 1988,78,286.
- Bigger J.T. Current approaches to drug treatment of ventricular arrhythmias // Amer. J. Cardiol. 1987. Vol. 60, p.l0f-20f.
- Bigger J.T. Weld E.M. Analysis of prognostic significance of ventricular arrhythmias after myocardial infarc tion: shortcomigs of Lown grading system //Brit. Heart J. 1981 Vol.45, N.6, p.717-724.
- Caruso AC; Marcus FI; Hahn EA; Hartz VL; Mason JW; Predictors of arrhythmic death and cardiac arrest in the ES- VEM trial. Electrophysiologic Study Versus Electromagnet ic Monitoring. // Circulation, 96(6): 1888-92 1997 Sep 16.
- Katritsis D., Camm A.J. New class III antiarrhytmic drugs. Eur Heart J. 1993; 14 (suppl H): 93-99.
- Lown B. Sudden cardiac death: the major challenge confronting contemporary cardiology // Am.J.Cardiol. 1979 Vol.43, N.2, p. 313-328.
- Mihelson E.L., Morganroth J.: Spontaneous variability of complex ventricular arrhythmias detected by long-term electrocardiographic recording. Circulation, 1980,61,690.
- Ruberman W. Weinblaff E. Goldberg J.D. et al. Ventricular premature beats and mortality after myocardial infarction // N.Engl J.Med. – 1977 V. 297 P. 759-757.
- Тео К.К., Yusuf S, Furberg CD. et al. Antiarrhythmic drug therapy in acute myocardial infarction. JAMA 1993; 270: 1589-1595.
- Pratt СМ., Slymen D.J.: Analysis of the spontaneous variability of venricalar arrhythmias: consecutive ambulatory electrocardiographic recordings of ventricular tachycardia. Am. J. Cardiol., 1985, 56, 67.
- Pratt СМ., Slymen D.J.: The canging baseline of complex venricalar arrhythmias: a new consideration in assess ing long-term antiarrhythmic drug therapy. New Engl. J. Med., 1985, 313, 144.
- Sami M., Кгдетег Н.: A new method for evaluating antiarrhythmic drug efficacy. Circulation., 1980, 62, 1172.
- Schmidt G., Barthel P.: Problems relating to the spontaneous variability of venricalar arrhythmia in controlling an antiarrhythmic therapy. J.Amb.Mon., 1991, 4, 43.
- Singh B.N., Lazzara R. Introduction: A new Age in the Pharmacologic Therapy of Cardiac Arrhythmias. Am J Cardiol. 1996; 78: (4A): 1-3.
Российский Научно-Практический
рецензируемый журнал
ISSN 1561-8641
Насколько опасна желудочковая экстрасистолия? Интервью с заведующим отделением хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции ФГБУ «НМИЦ ТПМ» Минздрава России Алексеем Владимировичем Тарасовым.
Желудочковая экстрасистолия (ЖЭС) — разновидность нарушения ритма сердца, проявляется преждевременными сокращениями сердца, активация которых происходит из миокарда желудочков.
Об экстрасистолиях мы поговорим с заведующим отделением хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции ФГБУ «НМИЦ ТПМ» Минздрава России Алексеем Владимировичем Тарасовым.
Как часто Вы в своей практике сталкиваетесь с экстрасистолиями?
Врачи ежедневно сталкиваются с этим диагнозом. Экстрасистолии диагностируются у 50-70% всех пациентов с нарушением ритма, с ишемической болезнью сердца и сердечной недостаточностью.
Расскажите поподробнее о причинах возникновения ЖЭС
ЖЭС — это всегда вторичное нарушение ритма сердца, а, значит, есть какая-то первопричина. Вот ее надо найти врачу, и на нее воздействовать.
Причины могут быть разные: от стресса и наличия вредных привычек – курения, алкоголя, переедания, до патологий сердечно-сосудистой системы – ИБС, стенокардия, гипертония, кардиомиопатия, пороки сердца, миокардит. Также причина может быть в патологиях других внутренних органов – легких, желудочно-кишечного тракта, онкологических заболеваниях.
Насколько желудочковая экстрасистолия опасное заболевание?
Мы никогда не говорим пациенту, что его жизни что-то угрожает, пока не проведем всестороннюю диагностику и не выявим первопричину заболевания. Бывают экстрасистолы безопасные, которые не стоит даже начинать лечить, бывают те, которые требуют немедленных действий!
Какая диагностика ЖЭС?
Главное — понять, угрожает ли экстрасистолия жизни пациента, может ли привести к самому грозному осложнению — внезапной сердечной смерти!
Сначала мы фиксируем жалобы пациента, потом направляем на функциональные исследования сердца. В первую очередь, на ЭКГ в 12 отведениях, затем на суточное холтеровское мониторирование, УЗИ сердца. Для исключения коронарной патологии — нагрузочные тесты. В зависимости от полученных результатов, можем назначить КТ, МРТ, гастроскопию, анализы крови, внутрисердечное электрофизиологическое исследование или генетическое обследование.
То есть, не всем пациентам показано лечение? Расскажите подробнее
Не каждая ЖЭС требует коррекции. Иногда, наоборот, не стоит ее трогать, так как терапия может нанести еще больший вред здоровью. В нашем центре были такие случаи. Не раз мы отменяли антиаритмическую терапию, назначенную другим врачом и отмечали положительную динамику.
Выбор тактики лечения зависит от того, есть ли у пациента органические поражения сердца или оно структурно нормальное.
В лечении мы добиваемся трех целей: уменьшения симптомов, устранения гемодинамических нарушений, улучшения прогноза.
Но наша ключевая цель — профилактика внезапной сердечной смерти. Еще раз подчеркну, главное — определить, имеется ли у пациента на фоне экстрасистолии риск внезапной сердечной смерти!
Какие подходы и методики лечения применяются в вашем отделении?
В самом начале нашей беседы я говорил и сейчас акцентирую на этом внимание, что ЖЭС имеет вторичную природу. Поэтому в начале лечения важно определить первичное заболевание и воздействовать на него.
Далее, это назначение лекарственных препаратов, в том числе антиаритмических, седативных, препаратов калия, магния и др.
При неэффективности лекарственной терапии – радиочастотная аблация или имплантация кардиовертер-дефибриллятора, если аритмия прогностически опасная.
Если нет поражения сердца, пациентам рекомендуется смена образа жизни. Исключение перееданий, тяжелой пищи, алкоголя, курения. Иногда экстрасистолия может уйти даже после отдыха, поездки в отпуск.
А если есть поражение сердца?
Здесь сложнее. У таких пациентов происходят изменения электрофизиологических свойств миокарда, потеря электрической стабильности миокарда, электролитный дисбаланс в миокарде (потеря кардиомиоцитами калия, магния), гиперкатехоламинемия. Главное — назначить бета-адреноблокаторы, так как они выполняют «защитную» функцию от электрической нестабильности у таких больных.
В зависимости от патологии и опасности аритмии мы можем рекомендовать им хирургическое лечение.
В заключении расскажите немного о своем отделении
У нас в отделении хирургического лечения сложных нарушений ритма сердца и электрокардиостимуляции накоплен большой опыт в лечении таких пациентов.
В работе мы опираемся на доказательную медицину, национальные и международные рекомендации, прибегаем к консультациям научного и профессорско-преподательского состава нашего Центра.
У нас есть все необходимые условия для быстрой диагностики, качественного лечения и наблюдения пациентов.
По вопросам отбора пациентов для стационарного лечения и высокотехнологичной помощи, консультаций, по любым вопросам относительно работы отделения:
+7 (499) 553-68-79 (зав. отделением Тарасов Алексей Владимирович)
По вопросам состояния госпитализированных пациентов, общение с лечащими врачами:
+7 (499) 553-68-97 (после 14:00) ординаторская
Отдел организации платных медицинских услуг и госпитализации:


