Эритроциты в крови: норма по возрасту, причины повышенных и пониженных значений
Эритроциты – красные кровяные тельца, самые многочисленные клетки крови. Формально они не являются клетками, так как в процессе созревания теряют многие необходимые для клеток структуры. Например, в них отсутствуют ядра, и они не синтезируют никакие белковые молекулы, в отличие от остальных клеток организма. Так что название «клетка» в данном случае используется для удобства. Эритроциты образуются в костном мозге и постоянно циркулируют в организме, выполняя важнейшую функцию поддержания жизни – они переносят кислород из легких к тканям и органам и удаляют углекислый газ.
Кроме эритроцитов, кровь содержит плазму, тромбоциты, лейкоциты. Однако количество эритроцитов так велико, что всего пара капель крови содержит около одного миллиарда этих клеток. Они составляют около 40% всего объема крови. Собственно, именно эритроциты и придают нашей крови характерный красный цвет за счет содержания гемоглобина.
Эритроциты не вечны, со временем они изнашиваются и в конечном итоге умирают. Средний жизненный цикл эритроцита составляет примерно 120 дней – всего четыре месяца. Однако не стоит переживать, костный мозг постоянно производит новые клетки и поддерживает нужный уровень красных кровяных телец. Различные неблагоприятные обстоятельства могут сокращать или, наоборот, увеличивать их скорость воспроизводства и влиять на продолжительность их жизни – таким образом, нарушается баланс состава крови. Повышение или понижение красных кровяных телец связано с разными патологическими состояниями. Рассмотрим этот вопрос подробнее.
Эритроциты в крови в норме
Границы нормы различаются в зависимости от пола, возраста и других особенностей.
Так, для взрослого мужчины она составляет от 4,0 до 5,1×10¹² единиц на литр крови, а для женщин — 3,7 до 4,7×10¹² в 1 л.
У беременных женщин эритроциты могут снижаться до 3–3,5 х 10¹² в 1 л.
У детей до года концентрация красных кровяных телец постоянно меняется, поэтому для оценки состава их крови существует специальная таблица, которой руководствуются врачи при расшифровке анализов.
В детском возрасте после года еще существуют небольшие отклонения от «взрослой» нормы, но к подростковому возрасту уровень эритроцитов выравнивается.
Повышенные эритроциты
Эритроциты могут быть повышены из-за множества причин, начиная от банального обезвоживания и заканчивая эритремией – хроническим лейкозом. Поэтому при любых отклонениях в результатах анализов необходимо проконсультироваться со специалистом, чтобы определить причину.
Увеличение числа эритроцитов называют эритроцитозом, который бывает:
1. Первичный. Редкое наследственное заболевание, характеризующееся упадком сил, головокружением и более темным цветом слизистых оболочек.
2. Вторичный. Вызван другими заболеваниями или состояниями (например, курением или пребыванием в высокогорных районах) и связан с кислородным голоданием клеток.
Таким образом, можно выделить следующие причины повышения эритроцитов:
- Обезвоживание. Когда сокращается объем жидкости в организме, процентное содержание эритроцитов (и других форменных элементов крови) искусственно увеличивается.
- Дефицит кислорода, который организм пытается компенсировать за счет производства большего количества красных кровяных телец.
- Врожденный порок сердца. Если сердце не может эффективно перекачивать кровь, количество кислорода, поступающего в ткани, уменьшается. Организм создает больше эритроцитов, чтобы компенсировать кислородное голодание.
- Генетические причины (изменение чувствительности к кислороду, нарушение выделения кислорода гемоглобином).
- Истинная полицитемия – редкое заболевание, при котором в организме вырабатывается слишком много эритроцитов.
Повышенная выработка эритроцитов грозит сгущением крови, замедлением кровотока и связанными с этим проблемами (например, головной болью, головокружением, проблемами со зрением, чрезмерной свертываемостью крови).
Часто повышенный уровень эритроцитов объясняется обезвоживанием, жаркой погодой, сильным стрессом или чрезмерными физическими нагрузками. Патологическое повышение эритроцитов – достаточно редкая патология. Намного чаще пациенты сталкиваются с их пониженным уровнем.
Пониженные эритроциты
Главные симптомы низкого уровня эритроцитов:
- Слабость или утомляемость.
- Недостаток энергии.
- Бледность кожных покровов.
Сниженные эритроциты – относительно распространенная патология. Малое число красных кровяных телец и/или гемоглобин называется анемией. Если эритроцитов мало, в кровеносном русле, соответственно, становится меньше гемоглобина, который переносит кислород. Таким образом, организм испытывает кислородное голодание, а мы чувствуем слабость, сонливость, упадок жизненных сил, головокружение. На фоне анемии выпадают волосы, кожа становится бледной, сухой.
Есть много форм анемии, каждая из которых имеет свою причину. Анемия может быть временной или приобретенной; в зависимости от выраженности – от легкой до тяжелой степени. Согласно публикации журнала The Lancet от 2015 года, около одной трети населения мира страдает анемией.
Наиболее распространенные причины пониженных красных кровяных телец:
- Несбалансированное питание с дефицитом железа, витамина B12 или фолиевой кислоты.
- Повреждение костного мозга (токсины, лучевая или химиотерапия, инфекция, прием некоторых лекарств).
- Любые заболевания костного мозга.
- Хронические воспалительные процессы.
- Кровотечение в пищеварительном тракте (например, при язвах, полипах, раке толстой кишки).
- Обильные менструальные кровотечения.
- Травма с масштабной кровопотерей.
- Состояния, вызывающие разрушение эритроцитов (например, гемолитическая анемия, вызванная аутоиммунными процессами или дефектами самих эритроцитов).
- Почечная недостаточность – серьезные патологии почек приводят к сокращению эритропоэтина (или гемопоэтина) – гормона почек, который способствует выработке эритроцитов.
Риск анемии выше в следующих группах:
- дети возрастом от 6 месяцев до 2 лет;
- беременные или недавно родившие женщины;
- соблюдающие диету с низким содержанием витаминов, минералов и железа, красного мяса;
- пациенты, регулярно принимающие лекарства, вызывающие воспаление слизистой оболочки желудка (например, ибупрофен);
- имеющие в семейном анамнезе наследственную анемию, такую как серповидноклеточная анемия или талассемия;
- пациенты с кишечным расстройством, которое влияет на всасывание питательных веществ (например, болезнь Крона);
- пережившие недавно большую кровопотерю из-за операции или травмы;
- люди с хроническими заболеваниями (ВИЧ, диабет, заболевание почек, рак, ревматоидный артрит, сердечная недостаточность, заболевание печени).
Отклонение от нормы – не всегда болезнь
Если уровень эритроцитов при первом анализе несколько выходит за границы нормы, не стоит паниковать. Врач поможет интерпретировать результаты верным образом, учитывая ваши индивидуальные особенности и историю болезни. Единичный слегка повышенный или слегка пониженный результат может не иметь медицинского значения.
Есть несколько факторов, из-за которых результат теста может выходить за пределы установленного контрольного диапазона без патологических причин:
- Под воздействием внешних факторов (стрессы, перенесенные инфекции, физическая нагрузка) результаты анализа одного и того же человека могут незначительно отличаться. При этом человек может быть здоров. Если анализ показал незначительное отклонение, пересдайте тест в другой день.
- Индивидуальные особенности. Для некоторых людей границы нормы могут незначительно отличаться от общепринятых. Референсные значения действительны для подавляющего числа людей, но мы все разные, и в некоторых редких случаях у здорового человека могут быть свои, немного отличающиеся от привычных значений, нормы.
Точно определить это сможет только врач, проведя дополнительные исследования.
Анализы на эритроциты в крови
Подсчет красных кровяных телец и оценка их строения обычно производятся как часть общего анализа крови (ОАК). Общий анализ крови – самый частый анализ, информативный практически при любых патологических процессах. Этот тест также может использоваться для диагностики и/или мониторинга ряда заболеваний, которые влияют на выработку или продолжительность жизни эритроцитов.
Сдать общий анализ крови с определением 5 фракций лейкоцитов вы можете в любом медицинском центре Ситилаб.
Для точной диагностики врач может назначить дополнительные анализы:
- Подсчет ретикулоцитов – определяет количество незрелых эритроцитов.
- Анализ на железо – этот микроэлемент играет важную роль в производстве красных кровяных телец.
- Уровни витамина B12 и фолиевой кислоты – эти витамины также важны для производства красных кровяных телец.
- Анализ крови на ферритин – отражает запасы железа в организме.
- Железо сыворотки крови, общая железосвязывающая способность сыворотки крови – дополнительные параметры, отражающие процесс обмена железа в организме.
Когда необходим прием средств, влияющих на эритропоэз? Причины понижения показателей эритроцитов
Эритропоэз и механизмы его регуляции
В эмбриональном периоде кроветворение осуществляется вначале в кровяных островках желточного мешка, затем примерно спустя 5 недель эмбрионального развития – в печени. Селезенка включается в процесс кроветворения с 16 недели внутриутробного развития. Первые гемопоэтические элементы появляются в костном мозге на 2-ом месяце эмбрионального развития, однако миелоидный период кроветворения начинается на 4-5-м месяцах эмбрионального развития, вытесняя постепенно кроветворение в печени и селезенке. Костномозговой эритропоэз осуществляется вне синусов, в строме костного мозга, то есть эктраваскуляторно. К моменту рождения ребенка костный мозг развивается полностью, а экстрамедуллярное кроветворение практически завершается. Постэмбриональный период кроветворения начинается после рождения ребенка и продолжается на протяжении всей жизни. Гемопоэз осуществляется в специализированных гемопоэтических тканях: миелоидной (эпифизы трубчатых костей и полости многих губчатых костей) и лимфоидной (тимус, селезенка, лимфатические узлы). В миелоидной ткани образуются эритроциты, лейкоциты, тромбоциты. В лимфоидной ткани идет дальнейшая дифференцировка и созревание лимфоцитов, а также плазматических клеток – основных продуцентов антител.
Постэмбриональный гемопоэз обеспечивает процессы физиологической регенерации крови, то есть её обновление, что компенсирует физиологические процессы разрушения дифференцированных клеток крови.
В условиях нормы функциональная активность органов кроветворения и кроверазрушения строго сбалансирована, что обеспечивает относительное постоянство содержания эритроцитов и других клеток в периферической крови. Разрушение эритроцитов происходит примерно после 120-дневного пребывания их в системной циркуляции при участии тканевых макрофагов селезенки, лимфатических узлов, печени. Гемоглобин, освобождающийся в процессе распада эритроцитов, трансформируется в билирубин в клетках моноцитарно-макрофагальной системы, а затем в гембилирубин (непрямой билирубин), вступая во взаимодействие с белками крови или липопротеидами. Гембилирубин в свою очередь элиминируется из системного кровотока печеночными клетками, где превращается в прямой билирубин (соединение билирубина с глюкуроновой кислотой). Прямой билирубин вместе с желчью поступает в кишечник, постепенно превращается в другие желчные пигменты (стеркобилиноген, уробилиноген) которые, выделяясь с калом и мочой, придают им окраску. При внутриклеточном разрушении эритроцитов основным продуктом, образующимся после распада гемоглобина, является билирубин, а при внутрисосудистом гемолизе большие количества гемоглобина соединяются с α2-гликопротеином-гаптоглобином, который не проникает в мочу.
Основным регулятором эритропоэза является эритропоэтин – гликопротеид, интенсивно вырабатывающийся в условиях гипоксии. При гипоксических состояниях различного генеза концентрация эритропоэтина возрастает в десятки раз по сравнению с нормой. Основным источником синтеза эритропоэтина являются почки (до 90 %), печень (около 10 %), а также макрофаги костного мозга и селезенки. Для эритропоэтина характерен мембранный тип рецепции эритропоэтинчувствительными клетками костного мозга с последующими активацией митоза и дифференцировки клеток, в частности, стимуляцией транспорта железа в эритрокариоцитах, синтеза цепей глобина, ферментов образования гема, синтеза мембранных белков и эритроцитарных антигенов.
Эритропоэз стимулируется под влиянием катехоламинов, глюкокортикоидов, андрогенов, гормонов щитовидной железы, инсулина, плацентарного пролактина, ИЛ-3, ИЛ-6, ИЛ-9, ИЛ-11, КСФ, фолиевой кислоты, витаминов С, В12, железосодержащих препаратов.
Эритропоэз угнетается при повышенной оксигенации тканей, когда снижается образование эритропоэтина, а также под влиянием эстрогенов, глюкагона, ацетилхолина, интерферонов, ФНО-а, ИЛ-1, ИЛ-5, эритроцитарных кейлонов.
После рождения у ребенка в течение нескольких дней отмечают эритроцитоз – содержание эритроцитов составляет 5,5⋅1012/л, в то же время имеется высокое содержание гемоглобина (156-200 г/л). В течение первого года жизни изменяется антигенная структура эритроцитов, возникает прогрессирующее снижение фетального гемоглобина. К концу первого года жизни содержание фетального гемоглобина не превышает 1 %.
Общая характеристика эритроцитов
Эритроциты – самая многочисленная популяция клеток крови, обладающих разнообразными функциями, в частности дыхательной, трофической, детоксицирующей. Количество эритроцитов довольно вариабельно в условиях нормы: так, у женщин оно колеблется от 3,7⋅1012/л до 4,7⋅1012 /л, а у мужчин – от 4,5⋅1012/л до 5,5⋅1012 /л. Сдвиг этих показателей до нижней или верхней границы нормы может быть одним из признаков болезни.
Около 85 % всех эритроцитов имеют форму двояковогнутого диска, то есть являются дискоцитами. Форма эритроцита определяет цепь ауторегулирующих процессов, направленных на поддержание движения крови, её реологических свойств. В условиях патологии появляются эритроциты различной формы, такие состояния именуют пойкилоцитозом. Среди аномальных по форме эритроцитов различают овалоциты, аннулоциты, сфероциты, акантоциты, стоматоциты, щизоциты и другие формы, имеющие в ряде случаев определённое диагностическое значение.
Обычная в условиях нормы форма дискоцита значительно увеличивает площадь диффузии газов, электролитов и других субстратов. Средний диаметр эритроцита (нормоцита) в области краёв составляет 7,5 мкм, а максимальная толщина эритроцита в области краёв составляет 2 мкм. Эритроциты с диаметром от 2 до 6 мкм – микроциты, а с диаметром от 9 до 16 мкм – макроциты. Количество макро- и микроцитов в крови здорового человека в среднем составляет 15–20 %. Резкое увеличение содержания в крови микро- и макроцитов, именуемое анизоцитозом, является одним из признаков нарушения гемопоэза, характерным для анемий, лейкоцитозов, заболеваний инфекционно-аллергической природы. За время свой жизни в периферической крови эритроцит совершает кругооборот более 1 млн. раз, что вызывает развитие механических и метаболических изменений в эритроцитах. Эритроциты обладают пластичностью, то есть способностью к деформации при прохождении через узкие извитые капилляры диаметром 2,5–7,5 мкм. По мере старения их способность к деформации снижается, они застревают в капиллярах красной пульпы селезенки и там разрушаются в процессе фагоцитоза тканевыми макрофагами. Эластичность эритроцитов определяется особенностями структуры белка спектрина, гемоглобина, а также соотношением различных фракций липидов в мембране клеток.
Эритроциты играют важную роль в регуляции кислотно-основного состояния организма, в процессах свертывания крови и фибринолиза за счет адсорбции на их мембране разнообразных ферментных факторов этих систем. Эритроциты являются регуляторами водно-солевого обмена в связи со способностью депонировать воду и минеральные соли при нахождении их в венозной крови. Одной из главных функций эритроцитов является участие в иммунологических реакциях организма за счет наличия в мембранах эритроцитов комплекса полисахаридо-аминокислотных соединений, обладающих свойствами антигенов. Следует помнить, что суммарный объем эритроцитов приблизительно в 160 раз превышает таковой лейкоцитов и тромбоцитов, а потому кровь можно рассматривать как двухфазную систему, представляющую собой взвесь (суспензию) эритроцитов в плазме. При этом эритроцит подвергается в токе крови действию напряжения сдвига – оно более значительно у края и направлено в сторону стенки и менее выражено в центре сосуда. Разница действующих векторов силы у разных краёв обеспечивает вращательное движение эритроцитов в текущей жидкости, что при столкновении с тромбоцитами, имеющими меньший размер и худшую деформируемость по сравнению с эритроцитами, приводит к отбрасыванию кровяных пластинок к стенке сосуда. Благодаря этому пристеночный слой оказывается обогащенным тромбоцитами. Указанный эффект обусловлен величиной гематокрита, размером эритроцитов и тромбоцитов и ригидностью их мембран. Увеличение любого из указанных параметров сопровождается усилением передвижения кровяных пластинок к стенке сосуда, а при наличии повреждения эндотелия – адгезией к субэндотелию.
Буферные свойства эритроцитов. Как известно, на единицу объема эритроцит связывает в 60 раз большее количество О2, чем плазма крови. О2 хорошо растворим в воде, поэтому диффузия его в растворе происходит очень быстро. Связывание О2 с эритроцитами определяется парциальным давлением газа в плазме и сорбционными свойствами Нв. В капиллярах легких, где давление О2 высоко (рО2 = 133 гПа), высоко и сродство Нв к О2, что обеспечивает трансмембранный перенос газа и связывание его с гемоглобином. В капиллярах тканей, где рО2 равно 40-50 гПа, сродство Нв к О2 резко снижается. При этом происходит выход кислорода из эритроцитов.
Транспорт СО2 через мембрану эритроцита также осуществляется за счет диффузного давления (в капиллярах легких рСО2 = 53гПа, а в капиллярах тканей – 61 гПа). Диффузия СО2 в растворах происходит примерно в 20 раз быстрее, чем О2.
Высокая скорость равновесия содержания СО2 в системе эритроцит – плазма крови обеспечивается наличием в эритроцитах особого фермента – карбоангидразы, катализирующего реакции трансформации СО2 и Н2О в углекислоту (Н2СО3), а также мощными системами трансмембранного обмена анионами.
При понижении концентрации СО2 в эритроцитах возникает отрицательный заряд Нв, что приводит к уменьшению содержания внутриклеточной воды, а при увеличении содержания СО2 в эритроцитах – они набухают.
Известно, что осмотическое давление в эритроцитах несколько выше, чем в плазме крови, что связанно с высокой внутриклеточной концентрацией белков по сравнению с плазмой крови. При этом содержание низкомолекулярных осмотически активных веществ (ионов натрия) в эритроцитах значительно меньше, чем в плазме крови. Величина осмотического давления в эритроцитах обеспечивает достаточный или нормальный тургор этих клеток. Осмотическое давление плазмы и эритроцитов в условиях нормы находится в динамическом равновесии, что обуславливает стабильность структуры эритроцитов.
При помещении эритроцитов в коллоидно-осмотическую среду с более низким осмотическим давлением (гипотонические растворы) может наступить осмотический или коллоидно-осмотический гемолиз. Последний обусловлен тем, что вода поступает в эритроциты до того момента, пока не разрывается мембрана и гемоглобин выходит в окружающую среду.
В умеренногипотонической среде эритроциты приобретают сферическую форму, их называют в связи с этим сфероцитами. Способность эритроцитов сохранять свою структуру при развитии гипоосмотических состояний или в гипоосмотической среде получила название осмотической устойчивости, или резистентности эритроцитов. Верхняя граница резистентности или максимальная устойчивость эритроцитов соответствует примерно 0,5–0,4 % раствора хлорида натрия.
При помещении эритроцитов в гипертоническую среду происходит их сморщивание в связи с потерей воды и уменьшением объема.
Эритроцитам свойственна способность к оседанию. Удельная масса цельной крови в норме для взрослого составляет в среднем 1,05–1,06. Удельная масса эритроцитов (1,085–1,096) выше, чем плазмы крови (1,02–1,027), поэтому эритроциты в пробирке с кровью, лишенной возможности свертываться, способны медленно оседать на дно. Скорость оседания эритроцитов в значительной мере определяется белковым составом плазмы крови, в частности уровнем мелкодисперсных белков-альбуминов. В связи с этим важная роль в обеспечении величины СОЭ отводится соотношению альбуминово-глобулиновых фракций белков крови. СОЭ у мужчин в среднем составляет 1–10 мм/ч, у небеременных женщин 2-15 мм/ч. При некоторых патологических процессах и заболеваниях, а также во второй половине беременности СОЭ повышается, так как увеличивается содержание в крови грубодисперсных белков глобулиновой фракции, получивших название аггломеринов, а также за счет усиления образования фибриногена.
При замедлении скорости кровотока и повышении вязкости крови эритроциты проявляют способность к агрегации. Вначале агрегация носит обратимый характер, при этом образуются ложные агрегаты, или монетные столбики. В случае быстрого восстановления кровотока они распадаются на полноценные клетки с сохраненной мембраной и внутриклеточной структурой.
Пластичность или деформируемость – это способность эритроцитов к обратимой деформации при прохождении через узкие извитые капилляры, микропоры. Данное свойство определяется особенностями структуры мембраны эритроциты, наличием в ней особого белка спектрина.
Таким образом, основными физиологическими и физико-химическими свойствами эритроцитов являются следующие:
– способность к оседанию;
– способность к агрегации;
– деструкция после определенного периода циркуляции в кровотоке.
1. Дыхательная функция заключается в захвате и переносе кислорода к тканям и экскреции СО2 из организма. Это обеспечивается содержащимся в эритроцитах белком гемоглобином. Гемоглобин – сложный белок состоит из групп гема и белкового остатка – глобина. Содержание гемоглобина у мужчин составляет 130-160 г/л, у женщин 120-140 г/л.
2. Трофическая функция эритроцитов связана с их способностью транспортировать аминокислоты, нуклеотиды, пептиды к различным органам и тканям, способствуя обеспечению репаративных процессов. В ряде случаев эту функцию называют транспортной.
3. Детоксиксицирующая функция эритроцитов обусловлена их способностью адсорбировать токсические продукты эндогенного или экзогенного происхождения и частично инактивировать их.
4. Участие в процессах свертывания крови за счет адсорбции на их мембране плазменных факторов свертывания крови
5. Участие в регуляции кислотно-основного состояния организма (буферная функция) за счет гемоглобина обеспечивающего до 70 % буферной ёмкости крови.
6.– Ферментативная функция связана с наличием в эритроцитах большого количества ферментов, в частности карбоангидразы, метгемоглобинредуктазы, ферментов гликолиза.
Анемия (малокровие)
Содержание статьи:
- Причины возникновения патологии
- Группы риска
- Патогенез болезни
- Симптомы анемии
- Классификация
- Стадии анемии
- Диагностические мероприятия
- Лечение анемии
- Осложнения болезни
- Прогноз и профилактика анемии
Анемия (малокровие) – патология, для которой свойственно снижение уровня гемоглобина в крови, количества эритроцитов (красных кровяных телец), изменение их формы. Пониженный гемоглобин – обязательный признак анемии, изменение числа эритроцитов и их деформация присутствуют не всегда.
Анемия – распространенное заболевание. Ему подвержены более четверти всего населения мира – 27,9 % или 1,9 млрд человек. Ежегодный темп прироста анемий составляет 6,6 %. Чаще всего патология встречается у детей дошкольного возраста (47,4 % от всех случаев), женщин, особенно во время беременности, реже – у мужчин (12,7 %). В России анемия ежегодно диагностируется у более чем 1,5 млн пациентов.
Причины возникновения патологии
Железодефицитная анемия (ЖДА), самая частая форма малокровия, обусловлена тремя факторами: недостаток поступления железа, его усиленная потеря, высокая потребность в этом микроэлементе, не восполняемая в достаточной мере.
Одна из причин недостатка поступления железа – неполноценное питание (недоедание, однообразное меню с малым количеством белка и красного мяса, вегетарианство, искусственное вскармливание). Кроме того, поступлению необходимого объема микроэлемента препятствует нарушение его усвояемости. Это происходит из-за различных патологий, мешающих ионизации железа в желудке (гастрит с атрофией слизистой, резекция желудка, гипо- и авитаминоз витамина C), и затрудняющих его всасывание в кишечнике (дуоденит, энтерит, колит).
Потерю железа сверх нормы провоцируют кровотечения – из носа, десен, желудочно-кишечные, геморроидальные, маточные, почечные, геморрагические диатезы, частое донорство.
Гиперпотребность в железе вызывают физиологические и патологические состояния. К физиологическим относятся интенсивный рост и половое созревание, беременность и кормление грудью, профессиональные тренировки, тяжелые физические нагрузки. К патологическим – глистные инвазии.
Дефицит железа бывает связан с некоторыми инфекционными болезнями, также нехватка этого элемента фиксируется у детей, рожденных матерями с анемией.
Группы риска
Исходя из причин, можно выделить категории людей, подверженных развитию малокровия:
- пациенты с пищевыми расстройствами, вегетарианцы, соблюдающие строгую диету;
- беременные и кормящие матери, женщины с обильными менструациями;
- дети и подростки, особенно не получающие полноценного питания;
- люди пожилого возраста;
- профессиональные спортсмены;
- доноры крови;
- люди с различными хроническими патологиями.
Патогенез болезни
Ведущее звено патогенеза ЖДА – нарушение синтеза гемоглобина вследствие снижения запасов железа, которое крайне необходимо для нормальной жизнедеятельности организма. Железо присутствует в составе гемоглобина и миоглобина, отвечает за транспортировку кислорода, различные биохимические процессы.
Железо всасывается в кровь из желудочно-кишечного тракта (ЖКТ), соединяется с трансферрином и либо накапливается в печени в составе белка ферритина, либо направляется в красный костный мозг, где с его участием идет синтез гемоглобина. Некоторая часть микроэлемента в составе трансферрина принимает участие в окислительно-восстановительных реакциях в тканях.
Нарушения на любом из описанных этапов затрудняют или делают невозможным процессы всасывания железа, его соединения с трансферрином, способствуют возникновению анемии. Всасыванию микроэлемента препятствуют заболевания ЖКТ, отсутствие части желудка или кишечника, гиповитаминоз витамина C, целиакия. При затруднении связывания железа с трансферрином оно не попадает в органы-депо (печень, селезенка) и красный костный мозг, как результат – нарушается синтез гемоглобина. Нехватка железа, требующегося для биохимических реакций, приводит к дестабилизации выработки некоторых гормонов, уменьшению адаптационных возможностей организма, снижению иммунитета Источник:
Седунова Е.Г. Структура заболеваемости анемиями различного генеза / Е.Г. Седунова, И.Р. Балданова // Вестник Бурятского университета. – 2010. – № 12. – С. 151-153 .
Симптомы анемии
Общие признаки:
- слабость, сонливость;
- головокружение, шум в ушах, мушки перед глазами;
- увеличение частоты сердечных сокращений, одышка;
- сухая и бледная кожа, иногда с желтоватым оттенком;
- голубоватый цвет склер;
- ломкие и слоящиеся ногти, их деформация – ногти становятся плоскими или вогнутыми, на них появляются поперечные борозды;
- тусклые, секущиеся, выпадающие больше нормы волосы;
- жжение языка, заеды – мелкие трещины в углах рта, небольшие изъязвления в ротовой полости, затруднения глотания;
- извращенные вкусовые и обонятельные пристрастия;
- потеря аппетита.
Зачастую начальные симптомы заболевания при легкой стадии анемии пациенты списывают на усталость, недосып, тяжелый рабочий график. Человека должны насторожить такие признаки как слабость при незначительной нагрузке, чувство разбитости, сонливость даже после полноценного ночного сна. В этом случае следует сдать общий анализ крови, чтобы не пропустить начало заболевания.
При острых и тяжелых анемиях возможно резкое ухудшение самочувствия – тошнота, рвота, обмороки, вплоть до гипоксической комы.
Классификация
Разновидности анемии в зависимости от причины:
- Железодефицитная – диагностируется в 90 % всех случаев. В анализе крови наблюдается снижение числа эритроцитов. Транспортировка кислорода из легких затрудняется, развивается кислородное голодание органов и тканей.
- Пернициозная анемия – возникает в результате нехватки витамина B12, обычно в результате наличия воспалительного очага или хронического заболевания кишечника.
- Фолиеводефицитная – следствие нехватки в организме фолиевой кислоты. Часто наблюдается у беременных женщин, недоношенных детей, при алкоголизме, длительном приеме противосудорожных средств.
- Гемолитическая анемия характеризуется разрушением эритроцитов и снижением срока их жизни. В анализе крови число эритроцитов может превышать норму – так организм компенсирует невозможность красных кровяных телец выполнять возложенную на них функцию.
- Постгеморрагическая – результат острой или хронической кровопотери.
- Апластическая анемия – недостаток выработки эритроцитов костным мозгом. Может быть результатом длительного приема цитостатиков, радиоактивного облучения при терапии онкологических заболеваний.
- Серповидноклеточная – изменение нормальной формы эритроцитов, которые принимают очертания полумесяца. Эритроциты перестают выполнять свои функции и могут закупоривать мелкие кровеносные сосуды, что чревато дополнительными осложнениями. Заболевание имеет генетическую предрасположенность, распространено на африканском континенте.
- Сидеробластная анемия – приобретенная или наследственная патология, характеризующаяся гипохромией эритроцитов при высоком содержании железа в сыворотке крови и его отложении в тканях Источник:
Полуэктова О.Ю. Важнейшие анемии в общей врачебной практике. Гипорегенеративные анемии / О.Ю. Полуэктова [и др.] // Земский врач. – 2011. – № 4 (8). – С. 9-13. .
По качественным и количественным показателям:
- микроцитарная гипохромная – размер эритроцитов меньше нормы, они не могут транспортировать нужное количество гемоглобина;
- макроцитарная гиперхромная – крупные эритроциты транспортируют достаточное количество гемоглобина, но цикл их жизни короче обычного;
- нормоцитарная нормохромная – эритроциты обычной формы и размера, но их количество в крови снижено.
В этой классификации применяется величина цветового показателя крови (ЦП), норма которого равна 0,86-1,1. При нормохромной анемии ЦП остается в допустимых пределах, при гипохромной – опускается ниже 0,86, при гиперхромной – поднимается выше 1,1.
По течению (для геморрагических анемий):
- Острая – результат массивной кровопотери при травмах кровотечениях. Требует экстренной медицинской помощи, иногда – переливания донорской крови.
- Хроническая – возникает вследствие незначительных повторяющихся кровопотерь (при патологиях ЖКТ, доброкачественных и злокачественных опухолях, циррозе печени, геморрое).
Стадии анемии
ЖДА развивается, последовательно проходя три этапа:
- Прелатентный дефицит железа. Симптоматика отсутствует, показатели общего анализа крови в норме. Снижаются запасы железа в печени и костном мозге, уровень ферритина.
- Латентный (скрытый) дефицит железа. Запасы железа истощаются, уровень гемоглобина пока еще в норме. Возникают первые, слабо выраженные симптомы заболевания, – слабость, утомляемость, бледность и сухость кожи, одышка при физической нагрузке. В анализах крови количество гемоглобина и эритроцитов в норме, снижается ферритин, сывороточное железо, повышается общая железосвязывающая способность сыворотки крови.
- Непосредственно железодефицитная анемия. Присутствуют характерные симптомы и изменения в анализах крови. Уровень гемоглобина и эритроцитов, ферритина, сывороточного железа снижается, изменяется размер и форма эритроцитов.
Для ЖДА выделяют три степени тяжести, каждой из которых соответствует определенный уровень гемоглобина. В норме показатель составляет от 110 до 130 г/л, нижняя граница допустима для детей и беременных женщин, верхняя – для мужчин.
| Степень тяжести | Уровень гемоглобина (г/л) |
|---|---|
| Легкая | 100-129 |
| Средняя | 70-109 |
| Тяжелая | менее 70-80 |
Диагностические мероприятия
Основа диагностики анемии – общий (ОАК) и биохимический анализ крови.
ОАК позволяет оценить уровень гемоглобина и эритроцитов, средний объем эритроцитов, среднее содержание и концентрацию гемоглобина в эритроцитах, ЦП, скорость оседания эритроцитов, лейкоцитарную формулу Источник:
Байрамалибейли И.Э. Алгоритм диагностики анемий / И.Э. Байрамалибейли [и др.] // Вестник Российского университета дружбы народов. Серия: Медицина. – 2006. – № 1 (33). – С. 12-20. .
По биохимическому анализу оцениваются уровень сывороточного железа и ферритина, увеличение общей железосвязывающей способности сыворотки, коэффициент насыщения трансферрина железом.
Дополнительно к анализам показаны фиброгастроскопия, колоноскопия, ЭКГ, УЗИ сердца для выявления причины, вызвавшей ЖДА, и контроля за состоянием пациента в целом. Больному также могут потребоваться консультации врачей различной специализации либо гематолога, если не удастся выявить причину анемии Источник:
Мещерякова Л.М., Левина А.А., Цыбульская М.М., Соколова Т.В. Лабораторные возможности дифференциальной диагностики анемий. Онкогематология, 2015. с. 46-50 .
Лечение анемии
Важный этап в лечении – устранение факторов, вызывающих недостаток железа. Одновременно больному назначается терапия для нормализации уровня этого микроэлемента. Диета – важная составляющая процесса лечения, но она является вспомогательным элементом, вылечить анемию без применения лекарств невозможно.
В основе лечения – препараты железа. Предпочтение отдается пероральному приему лекарств, инъекционно они вводятся только при тяжелом течении анемии, необходимости быстрого восстановления уровня железа, непереносимости или неэффективности пероральных препаратов, заболеваниях органов пищеварения, препятствующих всасыванию лекарственных средств.
Помимо препаратов железа рекомендованы витамины (B12, C), фолиевая кислота.
Для лечения отдельных видов анемий применяются специальные методы. При постгеморрагической анемии требуется восполнение объема циркулирующей крови, в том числе с помощью гемотрансфузий. При апластической анемии показаны гемотрансфузии, гормональная терапия и другие мероприятия, вплоть до трансплантации костного мозга.
Лечение железодефицитной анемии продолжается от 3 до 6 месяцев. Его нельзя прекращать сразу после восстановления уровня гемоглобина, в организме должен сформироваться запас железа.
Осложнения болезни
Последствия анемии возникают при ее долгом течении и отсутствии терапии. Дефицит железа в организме вызывает ослабление иммунитета, уменьшается сопротивляемость простудным, вирусным, бактериальным заболеваниям. Возможны осложнения со стороны нервной системы, нарушения функций печени, сбои менструального цикла. Из-за постоянной гипоксии возникают нарушения функций сердечно-сосудистой системы – дистрофия миокарда, застойные явления, развивается сердечно-сосудистая недостаточность. Наиболее тяжелым осложнением анемии является гипоксическая кома.
Прогноз и профилактика анемии
При своевременной диагностике и адекватной терапии прогноз благоприятный. Как правило заболевание лечится амбулаторно, госпитализация пациента не требуется.
Для профилактики ЖДА необходимо полноценное питание с достаточным поступлением белка, ежегодная сдача общего анализа крови, контроль за состоянием здоровья в целом и устранение заболеваний, которые могут стать источником пусть даже небольшой хронической кровопотери. Люди из групп риска по назначению врача могут ежегодно принимать курс препаратов железа, однако делать это самостоятельно недопустимо, так как бесконтрольный прием этих лекарств может вызвать тяжелые побочные эффекты.
Источники:
- Байрамалибейли И.Э. Алгоритм диагностики анемий / И.Э. Байрамалибейли [и др.] // Вестник Российского университета дружбы народов. Серия: Медицина. – 2006. – № 1 (33). – С. 12-20.
- Полуэктова О.Ю. Важнейшие анемии в общей врачебной практике. Гипорегенеративные анемии / О.Ю. Полуэктова [и др.] // Земский врач. – 2011. – № 4 (8). – С. 9-13.
- Седунова Е.Г. Структура заболеваемости анемиями различного генеза / Е.Г. Седунова, И.Р. Балданова // Вестник Бурятского университета. – 2010. – № 12. – С. 151-153.
- Мещерякова Л.М., Левина А.А., Цыбульская М.М., Соколова Т.В. Лабораторные возможности дифференциальной диагностики анемий. Онкогематология, 2015. с. 46-50
| Наименование услуги (прайс неполный) | Цена (руб.) | В рассрочку* |
|---|
* Ознакомиться подробнее с условиями можно здесь — Лечение в кредит или рассрочку.
Когда необходим прием средств, влияющих на эритропоэз? Причины понижения показателей эритроцитов
Эритроциты (красные кровяные клетки) – самые многочисленные клетки крови, содержащие гемоглобин. Их основная функция – доставлять кислород к тканям и органам.
Определение количества эритроцитов является неотъемлемой частью общего анализа крови и отдельно не производится.
Число эритроцитов, количество эритроцитов, подсчет количества эритроцитов.
Синонимы английские
Red blood cell count, RBC count, RCC, red cell count, erythrocyte count, red count.
*10 12 /л (10 в ст. 12 на литр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Общая информация об исследовании
В ходе этого теста подсчитывается количество эритроцитов в определенном объеме крови – в литре или в микролитре.
Эритроциты, которые образуются в костном мозге, доставляют кислород к органам и тканям, а также способствуют переносу углекислого газа от органов и тканям к легким, где он выдыхается. Это происходит за счет того, что они содержат белок гемоглобин, который легко вступает в связь с кислородом и углекислым газом.
Изменение количества эритроцитов, как правило, сопряжено с изменениями уровня гемоглобина. Когда количество эритроцитов и уровень гемоглобина снижены – у пациента анемия, когда повышена – полицитемия.
В норме продолжительность жизни эритроцита – около 120 дней. Организм старается поддерживать примерно одинаковое число циркулирующих эритроцитов. При этом старые эритроциты уничтожаются в селезенке, а новые образуются в костном мозге.
Если баланс между образованием и разрушением эритроцитов нарушается из-за потери эритроцитов, их разрушения или уменьшения их образования, то развивается анемия. Наиболее частые причины потери эритроцитов – это острое или хроническое кровотечение либо гемолиз (разрушение в кровяном русле). Организм возмещает такие потери, увеличивая производство эритроцитов в костном мозге. Этот процесс регулирует гормон эритропоэтин, образующийся в почках.
Снижаться продукция эритроцитов может, когда нарушается нормальная работа костного мозга. Причиной подобного нарушения может быть инфильтрация мозга опухолевыми клетками или угнетение его функции под воздействием радиации, химиотерапии, из-за нехватки эритропоэтина (образующегося в почках вещества, которое стимулирует образование эритроцитов) или из-за недостатка веществ, необходимых для образования гемоглобина (железа, витамина B12, фолиевой кислоты).
Снижение производства эритроцитов приводит к уменьшению их циркуляции в кровяном русле, недостатку гемоглобина и его способности переносить кислород, а следовательно, к слабости и утомляемости.
В свою очередь, число эритроцитов увеличивается при более активной работе костного мозга. К этому могут приводить разные причины, например чрезмерный уровень эритропоэтина, повышающее число эритроцитов хроническое расстройство (истинная полицитемия) или курение.
Для чего используется исследование?
- Тест на эритроциты, вместе с гемоглобином и гематокритом, применяют, чтобы выявить любые варианты анемии или полицитемии.
- Эти показатели обычно входят в так называемый клинический (общий) анализ крови. Кроме того, он включает в себя определение различных характеристик эритроцитов (формы, размеров, объема), которые, как правило, позволяют уточнить вариант анемии.
Когда назначается исследование?
Обычно исследование входит в рутинный общий анализ крови, который делается как планово, так и при различных болезнях и патологических состояниях, перед хирургическими вмешательствами.
Повторно его обычно назначают пациентам, страдающим от кровотечений или хронической анемии.
Что означают результаты?
Возраст
Пол
Эритроциты, *10^12/л
Когда необходим прием средств, влияющих на эритропоэз? Причины понижения показателей эритроцитов
Стадии дифференцировки красных клеток крови. Первой клеткой, которую можно идентифицировать как принадлежащую к группе красных клеток крови, является проэритробласт, показанный как отправная точка на рисунке ниже.
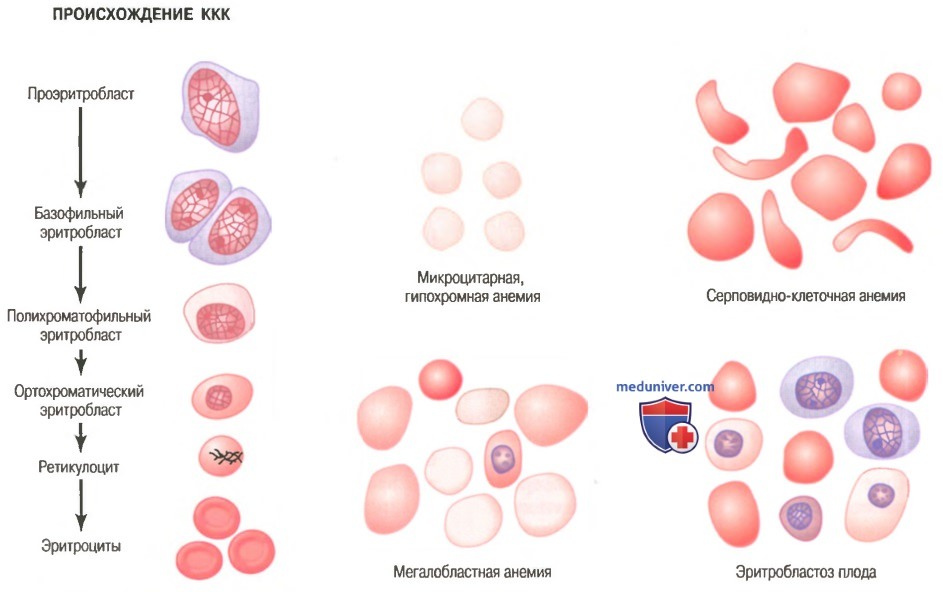 Происхождение нормальных красных клеток крови (ККК) и их особенности при разных типах анемий
Происхождение нормальных красных клеток крови (ККК) и их особенности при разных типах анемий
При соответствующей стимуляции большие количества этих клеток формируются из стволовых клеток КОЕ-Э.
Сразу после образования проэритробласт делится много раз, в результате формируются много зрелых красных клеток крови. Клетки первой генерации называют базофилъными эритробластами, поскольку они окрашиваются основными красителями; к этому времени клетка накапливает очень мало гемоглобина.
В последующих генерациях, как показано на рисунке, клетки наполняются гемоглобином до концентрации, равной примерно 34%, ядро сжимается до небольшого размера, и его конечный остаток абсорбируется или выдавливается из клетки. В то же время абсорбируется эндоплазматический ретикулум. На этом этапе клетку называют ретикулоцитому поскольку она все еще содержит небольшое количество базофильного материала, состоящего из остатков аппарата Гольджи, митохондрий и некоторых других цитоплазматических органелл.
Во время этой ретикулоцитарной стадии клетки выходят из костного мозга в кровеносные капилляры путем диапедеза (просачиваясь сквозь поры капиллярной мембраны).
Остаточный базофильный материал ретикулоцита в норме исчезает в течение 1-2 сут, и после этого клетка становится зрелым эритроцитом. В связи с короткой жизнью ретикулоцитов их концентрация среди всех клеток крови обычно немного ниже 1%.
Регуляция продукции красных клеток крови. Роль эритропоэтина
Общая масса эритроцитов в системе кровообращения регулируется в узких пределах, поэтому, с одной стороны, (1) всегда имеется адекватное количество красных клеток крови для обеспечения достаточного транспорта кислорода из легких к тканям, с другой стороны, (2) клеток не становится так много, чтобы они мешали кровотоку. Известные в настоящее время данные об этом контроле представлены в виде схемы на рисунке ниже и заключаются в следующем.
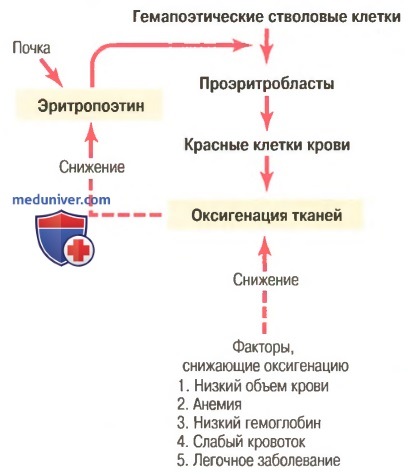 Увеличение продукции красных клеток крови, связанное с функцией механизма эритропоэтина при снижении оксигенации тканей
Увеличение продукции красных клеток крови, связанное с функцией механизма эритропоэтина при снижении оксигенации тканей
а) Оксигенация тканей является наиболее важным регулятором продукции красных клеток крови. Любое состояние, ведущее к уменьшению доставки кислорода тканям, обычно увеличивает скорость образования эритроцитов. Следовательно, если в результате кровотечения или любого другого состояния у человека развивается анемия, костный мозг немедленно усиливает продукцию красных клеток крови. Кроме того, разрушение значительной части костного мозга по любой причине, особенно при рентгенотерапии, ведет к гиперплазии оставшегося костного мозга, что отражает попытку удовлетворить потребности организма в эритроцитах.
На очень больших высотах, где количество кислорода в воздухе сильно снижено, снабжение тканей кислородом становится недостаточным, и продукция красных клеток крови резко возрастает. В этом случае образование эритроцитов регулирует не их концентрация в крови, а несоответствие между доставкой кислорода тканям и потребностями тканей в кислороде.
Скорость продукции красных клеток крови возрастает также при различных болезнях системы кровообращения, сопровождаемых снижением кровотока через периферические сосуды, особенно на фоне недостаточности поглощения кислорода при прохождении крови через легкие. Так, тканевая гипоксия, характерная для хронической сердечной недостаточности и многих легочных заболеваний, стимулирует продукцию красных клеток крови, что ведет к увеличению гематокрита и, как правило, общего объема крови.
б) Эритропоэтин стимулирует продукцию красных клеток крови, а его образование возрастает в ответ на гипоксию. Главным стимулом для продукции эритроцитов при состояниях с низким содержанием кислорода является циркулирующий в крови гормон эритропоэтин — гликопротеин с молекулярной массой около 34000. При отсутствии эритропоэтина гипоксия практически не стимулирует продукцию эритроцитов. Но когда система эритропоэтина функционирует, гипоксия вызывает заметное увеличение секреции эритропоэтина, а он, в свою очередь, усиливает образование красных клеток крови до тех пор, пока гипоксия не исчезнет.
в) Роль почек в формировании эритропоэтина. У здорового человека примерно 90% всего эритропоэтина синтезируется в почках; остальная часть образуется в основном в печени. Пока точно не известно, где именно в почках синтезируется эритропоэтин. Одним из возможных мест секреции эритропоэтина являются эпителиальные клетки почечных канальцев, поскольку анемичная кровь околоканальцевых капилляров не способна удовлетворить их высокую потребность в кислороде, что стимулирует продукцию эритропоэтина.
Иногда секрецию эритропоэтина почками стимулирует гипоксия не в почках, а в других частях тела, что позволяет предположить возможное существование некоего внепочечного сенсора, который посылает к почкам дополнительный сигнал, стимулирующий продукцию этого гормона. В частности, норадреналин, адреналин и некоторые из простагландинов стимулируют продукцию эритропоэтина.
Когда у человека удаляют обе почки или если они разрушены болезнью, у человека неминуемо развивается тяжелая анемия, поскольку эритропоэтин, синтезируемый другими тканями (в основном печенью), составляет лишь 10% нормы и может обеспечить формирование не более половины красных клеток крови, необходимых организму.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
– Вернуться в оглавление раздела “Физиология человека.”
Стимуляторы эритропоэза ( по материалам статьи David Goldsmith )
Опубликовано пн, 24/02/2020 – 10:29

Эпоэтины были впервые использованы в 1986 году у человека для повышения гематокрита. В то время пациенты, находящиеся на почечном диализе (заместительной почечной терапии) обычно были очень анемичными (с типичными уровнями гемоглобина 4–8 г / дл), часто получавшими переливания крови (с сопутствующими хроническими опасностями перегрузки железом, вирусными инфекциями и аллосенсибилизацией) и определенной симптоматикой (усталость, недостаток выносливости и легкая усталость). Эпоэтины – одни из самых ранних успешно используемых биофармацевтических препаратов, должны были, по-видимому, значительно помочь в клиническом лечении пациентов с хроническим заболеванием почек, что действительно (и остается) имело место.В те первые дни резкое сокращение (но никогда не отмена) необходимости регулярных переливаний крови и способность лечить пациентов со значительно более высоким гематокритом оказали огромное влияние на пациентов и всех тех, кто был связан с их хроническим лечением.
Первоначальный энтузиазм в отношении этого нового подхода почти полностью основывался на демонстрации предотвращения переливания крови и на ограниченных наборах данных, показывающих улучшение толерантности к физической нагрузке, пройденного расстояния, качества жизни и улучшение размеров и производительности левого желудочка. Профиль побочных эффектов искусственной инженерии более высокого гематокрита с использованием эпоэтина был очевиден с самого начала.
Один из первых уроков, еще не полностью освоенных, заключается в том, что хроническое заболевание почек – это не состояние абсолютного недостатка циркулирующего эритропоэтина, а часто состояние постоянной и очень вариабельной резистентности к эритропоэтину. Основной причиной этого является дефицит железа ( ab initio или вследствие стимулированного эритропоэза), хотя существует много других потенциальных причин устойчивости к эндогенному эритропоэтину, а также к эпоэтинам. Однако, мы не знаем как лучше всего использовать эти биологически мощные и плейотропные синтетические гормоны – эпоэтины – в клинической практике. Сейчас много написано о взлетах и падениях эпоэтинов . Недавняя работа McFarland и его коллег, использующая многолетние данные, полученные из DOPPS , рассказывает замечательную историю о быстром усвоении эпоэтинов, о быстром увеличении уровней гемоглобина у субъектов и огромное увеличение доз различных используемых эпоэтинов и эритропоэз-стимулирующих агентов (ESAs) (и, конечно, за счет увеличения стоимости их медицинского обслуживания, если это не компенсируется улучшением клинических результатов). Сегодня возникает подозрение, что не все хорошо с нашим нынешним понимание того, как и когда пытаться изменить гематокрит с помощью ESA у субъектов с хроническим заболеванием почек. Риск начала использования эпоэтина у пациентов с хроническим заболеванием почек является значительным, и, что особенно важно, без информации на уровне пациента, которая может нам помочь, баланс между риском и вредом для каждого пациента достаточно размыт. Нацеливание на более высокие уровни гемоглобина при хроническом заболевании почек повышает риск развития инсульта, гипертонии и тромбоза сосудов и, вероятно, повышает риск смерти, серьезных сердечно-сосудистых событий и терминальной стадии почечной недостаточности.
Вероятно, лечение пациентов с хроническим заболеванием почек эпоэтинами только для «коррекции» уровня гемоглобина или для соблюдения рекомендаций не является хорошим лекарством, так же как и решение о необходимости диализа для пациента на основе исключительно измерений СКФ. Некоторые исследователи утверждает, что нижний предел для гемоглобина потенциально может быть установлен на таком уровне, который не приводит к заметному увеличению связанной с переливанием аллосенсибилизации. Конечно, эпоэтины не отменяют, а значительно снижают показатели переливания крови. Тем не менее, некоторые оговорки должны быть введены. Во-первых, влияние лейкодеплированной крови на иммунологическую систему является комплексным: донор-специфическое переливание или одно несоответствующее переливание HLA-DR может быть безвредным или полезным, и этот эффект может варьироваться между мужчинами и женщинами. Беременность / аборт остаются самым большим фактором риска аллосенсибилизации. Во-вторых, в Великобритании только
50% пациентов, находящихся на диализе, попадают в лист ожидания по пересадке почки, и из них только 25% или около того перенесли пересадку через 2 года после включения в список ожидания.
Возникает ряд вопросос , на которые следует ответить. Что такое «эффект взаимодействия между целевым гемоглобином, достигнутым гемоглобином и дозой эпоэтина»? На это можно частично ответить путем рандомизации пациентов с эпоэтином «низкой дозы» по сравнению с эпоэтином «высокой дозы» (со строгими мерами безопасности). Что такое «идеальная парадигма лечения анемии»? Является ли она тщательным пополнением запасов железа и устранением других причин резистентности к эритропоэтину, а также ожиданием того, как это повлияет на концентрации гемоглобина, по сравнению с ранним одновременным применением железа и эпоэтинов? Что такое «идеальная продолжительность фазы коррекции» и «максимальная скорость роста гематокрита» (при любом вмешательстве)? Если мы возьмем пример гипонатриемии на мгновение, более важно избежать быстрого повышения уровня натрия в плазме с течением времени, чем стремиться к какому-либо конкретному целевому уровню натрия в плазме. Каковы патомеханизмы и маркеры «сосудистого повреждения, вызванного эпоэтином»? Нам нужны подробные исследования о влиянии эпоэтина на эндотелий сосудов, на конкретные сосудистые русла (например, мозг и сердце) и особенно на количество и функцию тромбоцитов. Нам также необходимо понять, способствует ли одновременное применение высоких доз внутривенных добавок железа с высокими дозами внутривенного эпоэтина неблагоприятным изменениям в количестве и функции тромбоцитов, количестве и функциях эндотелиальных клеток и показателях окислительного стресса. «Идеальный гематокрит может варьироваться» от пациента к пациенту и даже у одного и того же пациента в зависимости от клинической ситуации. Это может означать, что кому-то, кто проходил лечение по одному значению гемоглобина, может потребоваться новое целевое значение, если клиническая ситуация изменяется, например, после инсульта или инфаркта миокарда, или с интеркуррентными заболеваниями. Что является непростой задачей, так это то, что в наше время мы можем быть уверены только в том, что уровни гемоглобина 13 г / дл могут быть вредными, но клиническое влияние того, что находится между… где
75–85% показателей гемоглобина у современных пациентов с хронической болезнью почек далеко не ясно. Все нефрологи наверняка согласятся, что повышение гемоглобина с 6 до 9 г / дл будет иметь реальную пользу для пациентов , даже , если оно достигается реальными различными способами, это одно, но двигаться вверх еще на 3 г / дл от исходного гемоглобина 9 г / дл. до 12 г / дл (который требует гораздо больше эпоэтина и железа) дает в лучшем случае лишь скромную выгоду.
Анемия
Анемия — это патологическое состояние, вызванное уменьшением количества эритроцитов в крови и/или снижением концентрации гемоглобина в самих эритроцитах.
Эритроциты (красные кровяные клетки, red blood cells, RBC) – самая многочисленная популяция клеток крови. Эритроциты содержат гемоглобин (Hb), который в легких присоединяет молекулы кислорода и доставляет их в ткани. В обратную сторону – из тканей к легким – гемоглобин переносит молекулы углекислого газа. Иными словами, гемоглобин обеспечивает процесс дыхания. Эритроцит имеет форму диска, вогнутого с обеих сторон. Такое устройство значительно увеличивает площадь поверхности, на которой происходит газообмен. Эритроциты имеют небольшой размер, что позволяет им проходить через самые узкие кровеносные сосуды (капилляры, артериолы, венулы). Один эритроцит в среднем живёт до 120 дней.
Низкий гемоглобин – один из критериев, на который необходимо обращать внимание не только при диагностике самих анемий, но и для оценки их степени тяжести. Снижение количества гемоглобина в эритроцитах возникает при недостаточном обеспечении железом в процессе созревания клеток в красном костном мозге.
Существует несколько классификаций анемий в зависимости от причин, от механизмов развития анемии и от выраженности изменений показателей крови. Они необходимы врачу для понимания, с чем связано текущее состояние. Это помогает выбрать наилучшую тактику дальнейшего обследования, провести дифференциальную диагностику и назначить эффективное лечение.
Диагностикой и лечением анемии занимаются врачи-терапевты, врачи общей практики, семейные врачи. В случае тяжелого или злокачественного течения болезни может потребоваться вмешательство врача-гематолога, а также проведение более подробного и специализированного обследования.
Причин для развития анемии множество. Часто анемия является осложнением основного хронического заболевания.
Железодефицитная анемия развивается либо при недостаточном поступлении железа в организм, либо при повышенной потребности организма в железе.
Часто в той или иной степени присутствуют оба фактора.
Причинами недостаточного поступления железа могут быть заболевания органов желудочно-кишечного тракта, при которых нарушаются процессы переваривания и всасывания пищи. Употребление продуктов, содержащих низкое количество железа или железо в трудно усваиваемой форме (исключительно растительный рацион). Некоторые пищевые продукты (алкоголь, молоко, кофе) или лекарственные средства (антибактериальные, антацидные препараты) препятствуют усвоению железа из пищи.
Потребности организма в железе («расход железа») существенно возрастают у детей в периоды активного роста, у женщин во время беременности и кормления грудью.
Анемии часто осложняют течение заболеваний, сопровождающихся длительной кровопотерей (особенно на фоне нарушения всасывания пищи):
- язвенная болезнь желудка и 12-перстной кишки;
- воспалительные заболевания кишечника;
- миома матки, эндометриоз;
- злокачественные новообразования;
- нарушения свертываемости крови;
- глистные инвазии.
Организм человека не может синтезировать железо! Железо мы получаем только с пищей. Значение имеет не только количество железа в продуктах, но и его доступность для усвоения организмом. В продуктах животного происхождения (говядина, баранина, печень) содержится гемовое железо. Оно усваивается организмом наиболее эффективно. В растительных продуктах (овощах, фруктах, крупах) содержится негемовое железо. Организм человека плохо усваивает негемовое железо.
Основная причина развития железодефицитной анемии, по мнению экспертов Всемирной организации здравоохранения (ВОЗ), – это неправильное (несбалансированное) питание. Если Вы не употребляете мясные продукты, то необходимо помнить, что из растительных продуктов железо усваивается значительно хуже. Разумно планируйте ваш рацион питания, чтобы не допустить дефицита железа.
Другой вид анемии – заболевание, вызванное дефицитом витамина B12.
В12-дефицитная анемия развивается из-за недостатка цианокобаламина.
Причинами недостатка могут быть:
- Недостаточное поступление витамина В12 с пищей (строгое вегетарианство), так как цианокобаламин содержится только в мясных продуктах, молоке, яйцах, рыбе и морепродуктах.
- Нарушение секреции желудком «внутреннего фактора Кастла»;
- Нарушение всасывания витамина В12 в тонком кишечнике;
- Конкурентное расходование витамина В12;
- Повышенный расход витамина В12;
- Снижение запасов витамина В12;
- Нарушение транспорта витамина В12;
- Отсутствие транскобаламина или появление антител к нему.
- Бледность кожных покровов, трещинки, «заеды» в уголках рта
- Ломкость ногтей, истонченность и исчерченность ногтей
- Выпадение волос, ломкость, нарушение структуры
- Повышенная утомляемость, снижение работоспособности
- Учащенное сердцебиение, головокружение, одышка сопровождают даже небольшую физическую активность
Для железодефицитной анемии характерно
- Извращение вкуса: пристрастие к малосъедобным продуктам — сырому мясу, замороженным полуфабрикатам; желание употреблять в пищу несъедобные вещества — мел, землю, лёд, глину.
- Извращение обоняния: пристрастие к неприятным запахам, например, бензина, ацетона, краски и т. д.
Какие анализы можно сдать тем, кто подозревает у себя анемию? Самым доступным и простым является общий анализ крови
Если по результатам анализа будут выявлены изменения количества эритроцитов, гемоглобина, гематокрита, эритроцитарных индексов (MCV, MCH, MCHC, RDW), то необходимо проконсультироваться с врачом для назначения дальнейшего обследования и лечения.
Для справки:
Гематокрит (Ht) – показатель, который характеризует количество клеток в единице объема цельной крови. Величина гематокрита зависит от количества и формы эритроцитов. Снижение уровня гематокрита также характеризует снижение содержания эритроцитов в крови.
MCV (mean corpuscular volume) – средний объем эритроцита, отражает размер клеток. При наличии длительного дефицита железа, созревающие эритроциты становятся мелкими, в крови появляются микроциты, и показатель MCV снижается. При наличии дефицита витаминов В12 и В9 созревающие клетки становятся крупными, в крови появляются макроциты, и данный показатель увеличивается. Оба состояния негативно сказываются на главной функции эритроцитов – транспорте кислорода и углекислого газа. В случае макроцитарной анемии уменьшается их способность проходить по сосудам маленького диаметра, и уменьшается срок их жизни.
МСН (mean corpuscular hemoglobin) – среднее содержание гемоглобина в эритроците, отражает те же самые процессы, что и предыдущий показатель MCV. При длительном дефиците железа в кровоток выходят эритроциты, которым в процессе роста и созревания этого микроэлемента не хватало, и они становятся не только маленькими, но ещё и недостаточно насыщенными гемоглобином. MCH начинает снижаться, развивается состояние гипохромии. Эритроциты становятся бледными, ухудшается их функционирование. Раньше для оценки состояния насыщения гемоглобином эритроцитов рассчитывался цветовой показатель, MCH является его современным более точным аналогом и позволяет дифференцировать анемии на нормохромные, гипохромные и гиперхромные. В случае дефицита витаминов В12 и В9 происходит обратная ситуация. Созревающие эритроциты перенасыщены гемоглобином, данный показатель начинает увеличиваться, развивается состояние гиперхромии. В совокупности два этих показателя помогут врачу только лишь на основании результатов общего анализа крови предположить природу анемии.
MCHC (mean corpuscular hemoglobin concentration) средняя концентрация гемоглобина в эритроците. Отражает концентрацию гемоглобина в эритроците. Снижается при железодефицитных гипохромных анемиях и заболеваниях сопровождающихся нарушением синтеза гемоглобина на любом этапе. Повышается при гиперхромных В12 и В9 дефицитных анемиях.
RDW (red blood cell distribution width) ширина распределения эритроцитов по объему. Данный показатель зависит от среднего объема эритроцита, поэтому при повышении или снижении MCV, наблюдается его увеличение, что свидетельствует в пользу того, что в крови находятся клетки разного объема, например, макроциты и нормоциты, или микроциты и нормоциты.
Для комплексного обследования, когда причина анемии неизвестна, можно воспользоваться программой Биохимическая диагностика анемий в состав которой входят параметры отражающие обмен и запас железа в организме, запас витамина В9 (фолиевой кислоты) и витамина В12 (цианокобаламина), а так же эритропоэтин – гормон запускающий эритропоэз (созревание новых эритроцитов).
- Трансферрин – осуществляет внеклеточный транспорт железа во все клетки организма человека.
- Растворимые рецепторы трансферрина (sTfR). Один из важных диагностических критериев, на основании которого можно установить истинный дефицит железа. Поступление железа в клетку происходит после взаимодействия комплекса «железо-трансферрин» со специфическими белками – рецепторами на мембране клеток. Концентрация рецепторов трансферрина зависит от двух факторов – количества депонированного железа в составе ферритина и пролиферативной активности клетки. Количество растворимых трансферриновых рецепторов является чувствительным индикатором как активности эритропоэза, так и дефицита железа. При анемии, развившейся как осложнение хронических заболеваний, этот показатель не меняется (остается в норме). Это помогает установить основную причину анемии.
- Ферритин (Ferritin) – депонированная форма железа, отражающая его общий запас в организме. Понижение концентрации ферритина в крови — маркер железодефицитных состояний.
- Федеральные клинические рекомендации по диагностике и лечению железодефицитной анемии Издание официальное Москва 2015
- Струтынский А.В Диагностика и лечение железодефицитных анемий РМЖ «Медицинское обозрение» №11 от 14.05.2014 стр. 839
- Анемии: железодефицитная, В12-дефитная и анемия хронических заболеваний. Информационное письмо для врачей-гематологов, терапевтов, врачей-интернов и врачей-ординаторов. г. Ростов-на-Дону, 2013 год.


