Механизм формирования патологических мишеневидных эритроцитов в кровяной плазме

Периферическая кровь является чрезвычайно реактогенной системой, для которой характерны динамические изменения количественного и качественного состава форменных элементов в ответ на действие физиологических и патологических раздражителей.
Самой многочисленной популяцией клеток периферической крови являются эритроциты, суммарный объем которых превышает во много раз объем лейкоцитов и тромбоцитов.
В цикле лекций даны классификация, патогенезе и гематологическая характеристика типовых нарушений со стороны красной крови различной этиологии.
Общая характеристика эритроцитозов и анемий
В условиях патологии возможны количественные и качественные изменения со стороны элементов красной крови, что приводит к выраженному нарушению их функциональной активности.
Среднее содержание эритроцитов в норме в крови у женщин варьирует в диапазоне от 3,7 до 4,7·1012/л, а у мужчин – от 4,5 до 5,5·1012/л. Количественные изменения эритроцитов могут проявляться в виде увеличения их содержания – эритроцитоза или уменьшения – эритропении (анемии). Изменение количества эритроцитов в периферической крови, как правило, является следствием комплексного воздействия ряда патогенетических факторов: нарушения нервной, гормональной, гуморальной регуляции эритропоэза, усиления распада эритроцитов в периферической крови или в мононуклеарно-фагоцитирующей системе, усиления процессов физиологического или патологического депонирования крови, а также следствием кровопотери.
Качественные изменения состава эр итроцитов периферической крови могут проявляться в виде изменения формы эритроцитов, их размеров, появлением незрелых, малодифференцированных форм эритроцитарного ряда. Как известно, в условиях нормы у человека преобладают в периферической кров и, двояковогнутые, или дисковидные (дискоциты), эритроциты, имеющие в среднем размер 7,2–7,5 мкм (нормоциты).
Качественные изменения эритроцитов периферической крови, подобно количественным сдвигам, могут явиться отражением дегенеративных изменений со стороны крови на фоне действия различных патогенных факторов или нарушений регенераторной активности костного мозга, могут быть признаками нарушений проце ссов кроветворения в костном мозге, кровопотери, гемолиза эритроцитов врожденной или приобретенной пр ироды.
Патологическое состояние, характеризующееся выраженными изменениями размеров эритроцитов периферической крови, получило название анизоцитоза. Различают микроцитоз, когда размеры эритроцитов становятся менее 7–6 мкм, макроцитоз – при увеличении размеров свыше 8–9 мкм, мегалоцитоз, когда в периферической крови появляются гигантские эритроциты размерами 14–16 мкм и более. Одной из разновидностей анизоцитоза являются карликовые эритроциты, имеющие диаметр размером 2–2,2 мкм. Размеры эрит роцит ов являют ся одним из вспомогательных признаков, п озволяю щих дать дифференциальную диагностику заболеваний.
Состояние, характе ризующееся изменением формы эритроцитов, – пойкилоцитоз. Подобно анизоцитозу, пойкилоцитоз отражает характер и интенсивность дегенеративных сдвигов со стороны элементов периферической крови. Изменения формы эр итроцитов при различных видах патологии весьма разнообразны. Различают сфероцитоз, овалоцитоз акантоцитоз, стоматоцитоз, шизоци тоз, аннулоцитоз. В ряде случаев патологии в периферической крови появляются мишеневидные эритроциты, серповидноклеточные эритроциты, что неред ко является признаком врожденных аномалий структуры гемоглобина.
В ответ на действие разнообразных патогенных факторов инфекционной и неинфекционной природы костный мозг может реагировать угнетением костномозгового кроветворения, когда в периферической крови снижается содержание ретикулоцитов и становится резко выраженным преобладание дегенеративных форм эритроцитов. В случае активации костномо згового кроветворения как одной из реакций адаптации, компенсации в ответ на действие альтерирующего фактора в периферический кровоток начинают в избытке поступать из костного мозга регенераторные, недостаточно зрелые элементы эритроцитарного ряда – ретикулоциты, а также нормоциты различной степен и зрелости. Лишь при тяжелых формах патологии красной крови опухолевой природы в системный кровоток поступают малодифференцированные клетки костного мозга эритробласты.
Разнообразн ые сдвиги со стороны красной крови симптоматического характера, отражающие развитие патологических процессов или заболеваний, можно объединить в две основные группы:
Группа анемий нередко включает в себя и эритропении.
Эритроцитозы: классификация, этиология, механизмы развития
Эритроцитозы – состояния, характеризующиеся увеличением количества эритроцитов в единице объема крови свыше 4,7 ·1012 /л у женщин и 5,5·1012 /л – у мужчин.
В зависимости от этиологических факторов различают пер вичные эритроцитозы наследственной и приобретенной природы, включающие в себя, в частности, истинную полицитемию, или болезнь Вакеза, а также вторичные эритроцитозы, являющиеся симптомами разнообразных заболеваний или патологических состояний.
В зависимости от механизмов развития выделяют абсолютные эритроцитозы – состояния, характеризующиеся увеличением содержания эритроцитов в периферической крови в связи с активацией эритропоэза в костном мозге, а также относительные эритроцитозы, в основе которых лежит феномен сгущения крови при обычной интенсивности эритропоэза.
Первичные эритроцитозы. Наследственный семейный эритроцитоз – генетически обусловленная форма патологии, характеризующаяся увелич ением содержания в периферической крови гемоглобина, эритроцитов, повышением вязкости крови, расстройствами микроциркуляции. Наследственный эритроцитоз включает группу заболеваний, в осно ве которых могут лежать различные патогенетические механизмы:
1. Образование аномальных гемоглобинов с повыш енным сродством к кислороду; в настоящее время оп исано около 30 таких гемоглобинов.
2. Дефицит фермента дифосфоглицератмутазы и, соответственно, 2,3-дифосфоглицерата, что приводит к повышению сродства гемоглобина к кислороду, уменьшению отдачи его тканям, развитию гипоксии.
Аномальные гемоглобины с повышенным сродством к кислороду наследуются по аутосомно-доминантному типу. Повышенное сродство гемоглобина к кислороду связывают с заменой лишь одного аминокислотного остатка в молекуле гемоглобина.
При всех разновидностях наследственного эритроцитоза возникает выраженная гипоксия тканей, стимулирующая увеличение продукции эритропоэтина и активацию эритропоэза.
Выраженность клинических симптомов наследственного эритроцитоза варьирует и зависит от типа наследования. При аутосомно-доминантном типе наследования, характеризующемся повышением концентрации АТФ в эритроцитах, заболевание, как правило, протекает бессимптомно. Клинические проявления наиболее выражены при аутосомно-рецессивном типе наследования дефицита фермента дифосфоглицератмутазы, приводящего к дефициту 2,3-ДФГ и резкому увеличению степени сродства гемоглобина к кислороду. Симптоматика заболевания обусловлена развитием гипоксии, повышением вязкости крови, нарушением свертываемости крови. Наиболее частыми осложнениями являются тромбозы сосудов головного мозга и капиллярная кровоточивость. Больные жалуются на головную боль, утомляемость, боль в нижних конечностях, области сердца. В периферической крови выявляются эритроцитоз, увеличение содержания эритроцитов, повышение гематокрита, резкое замедление СОЭ.
Эритремия (истинная полицитемия, болезнь Вакеза) относится к числу хронических лейкозов, самостоятельная нозологическая форма патологии, не исключается возможность наследственной предрасположенности к данному заболеванию, поскольку описаны случаи болезни у родственников. Причинами эритремий, как и других заболеваний опухолевой природы, могут быть патогенные факторы физического, химического, биологического происхождения. В основе развития эритреми й лежат неограниченная пролиферация клеток-предшественниц миелопоэза, усиление миелопролиферативного процесса в костном мозге, селезенке, а также в других органах и тканях. При этом име ет место активация эритропоэза, лейкопоэза, тромбоцитопоэза, что приводит к развитию полицитемии. Характерной особенностью эритреми й является снижение уровня эритропоэтина в крови.
В периферической крови отмечаются эритроцитоз, ретикулоцитоз, нейтрофильный лейкоцитоз со сдвигом влево, базофилия, моноцитоз, тромбоцитоз, увеличение содержания гемоглобина до 200 г/л, снижение цветового показателя в связи с отставанием процессов синтеза гемоглобина от интенсивности эритропоэза. В терминальной стадии патологии возникает подавление костномозгового кроветворения, что приводит к развитию панцитопении.
Клинические проявления эритреми й обусловлены в основном увеличением вязкости крови, объема циркулирующей крови, расстройствами коагуляционного гемостаза. У больных отмечаются развитие гипертензии, переполнение кровью внутренних органов (плетора), нарушения микроциркуляции в виде замедления кровотока, стаза, турбулентного кровотока, тромбоза сосудов, геморрагий.
Вторичные эритроцитозы. Вторичные эритроцитозы не являются самостоятельными нозологическими формами патологии, это сим птомы различных патологических процессов и заболеваний.
Как указывалось выше, различают абсолютные и относительные вторичные эритроцитозы.
Абсолютные эритроцитозы связаны с активацией эритропоэза в костном мозге под влиянием различных гормональных и гуморальных стимулирующих воздействий. Важнейшим стимулятором эритропоэза является эритропоэтин – гормон гликопротеиновой природы, стимулирующий пролиферацию и дифференцировку эритропоэтинчувствительной клетки в морфологически распознаваемые элементы.
Впервые эритропоэтин был обнаружен в 1906 г. Карно и Дефландром. В настоящее время получен в чистом виде, ММ около 36000, существует в форме мономера, димера или комплекса обеих форм. Стимулирующим фактором избыточного освобождения эритропоэтина и соответственно развития абсолютного эритроцитоза является гипоксия. Синтез гормона в основном происходит в почках. Высказывается точка зрения, что в почках образуется неактивный предшественник эритропоэтина – эритрогенин, преэритропоэтин, который активируется при контакте с плазменным факт ором α2 – глобулиновой природы. Тем не менее, активная форма гормона может образовываться и в самих почках, в мозговом и корковом веществе при участии циклического 3 -,5-АМФ, циклического ГМФ, почечных простагландинов.
Считают, что в норме печень не является местом синтеза эритропоэтина, однако в условиях патологии почек (при удалении почки, нарушении ее эндокринной функции) печень становится эритропоэтинсинтезирующим органом.
Следует отметить и возможность синтеза эритропоэтина в тканевых макрофагах, моноцитах крови.
Данные литературы убедительно свидетельствуют о возможности интенсификации синтеза эритропоэтина не только при разнообразных гипоксических состояниях, но и при опухолевом поражении печени и почек, что, естественно, может сопровождаться развитием симптоматического эритроцитоза.
Касаясь механизмов развития вторичных эритроцитозов, необходимо остановиться и на других гормональных стимуляторах эритропоэза, которыми являются гормоны аденогипофиза (АКТГ, ТТГ, ГТГ, СТТ).
Стимулирующим воздействием на эритропоэз обладают гипофизарный и плацентарный пролактин, тиреоидные гормоны, андрогены, причем усиление эритропоэза под влиянием указанных гормонов возникает опосредованно за счет стимуляции продукции эритропоэтина. Тем не менее, очевидна возможность развития эритроцитоза при разнообразных эндокринопатиях, особенно при опухолевом поражении эндокринных желез, сопровождающемся усилением продукции гормонов – стимуляторов образования эритропоэтина почками.
Вторичные абсолютные эритроцитозы в зависимости от их значимости и патогенетических механизмов развития могут быть представлены как гипоксемические, или компенсаторные, и негипоксемические.
Гипоксемические эритроцитозы могут возникать при экзогенных гипоксических состояниях, а также при эндогенной гипоксии циркуляторного, гемического, тканевого характера. Компенсаторные гипоксемические эритроцитозы отмечаются при длительном пребывании в высокогорной местности, при хронической сердечной, легочной недостаточности, при метгемоглобинемии, карбоксигемоглобинемии. Эритроцитоз при гипоксических состояниях обеспечивает адаптацию организма к действию патогенного фактора, поэтому он и получил название компенсаторного.
Абсолютный негипоксемический эритроцитоз не имеет компенсаторной функции, обусловлен повышенной продукцией эритропоэтина при поражении почек: раке, поликистозе, стенозе почечной артерии, гидронефрозе, после операции пересадки почки. Вторичные негипоксемические эритроцитозы могут иметь место при опухолевом поражении печени, селезенки, болезни и синдроме Иценко – Кушинга, когда возникает стабильная гиперпродукция гормонов АКТГ и глюкокортикоидов.
Клинические проявления вторичных абсолютных эритроцитозов разнообразны, в значительной мере обусловлены особенностями этиологических ф акторов и основного заболевания. Тем не менее, общими признак ами эритроцитозов являются умеренная полицитемическая гиперволемия, увеличение вязкости крови и гематокрита, повышение артериального давления, развитие гипертрофии миокарда, расстройства микроциркуляции, наличие микротромбоза.
В периферической крови отмечаются эритроцитоз, ретикулоцитоз, в отличие от эритремии отсутствуют тромбоцитоз и лейкоцитоз.
Вторичные относительные эритроцитозы не связаны с активацией эритропоэза, возникают вследствие двух основных патогенетических факторов:
1. Сгущения крови (гемоконцентрации) при потере организмом жидкости (диарея, рвота, плазмопотеря при ожогах).
2. Выброса депонированной крови при стресс-реакциях, острой гипоксии.
В ряде случаев относительные эритроцитозы наблюдаются при артериальной гипертензии у лиц, злоупотребляющих алкоголем, у курильщиков.
Клинические проявления относительных эритроцитозов также в значительной мере определяются характером основного заболевания, особенностями этиологического фактора. При любых формах патологии не исключена возможность увеличения гематокрита в связи с нормо- или гиповолемической полицитемией, а также развитием гипертензивных состояний.
Механизм формирования патологических мишеневидных эритроцитов в кровяной плазме
Мишеневидными эритроцитами называется вид патологической формы эритроцитов, обладающий плоскими очертаниями с низкой концентрацией гемоглобина, находящегося в центральной части клетки. Данный тип кровяных клеток появляется при талассемии. Отличается от здоровых форм уплотнением в центре, где скапливается гемоглобин. Гемоглобиновые клетки создают характерное в круге мишени пятно высокой насыщенности. Время от времени контрастное кольцо вступает в реакцию со сферой перемычки.
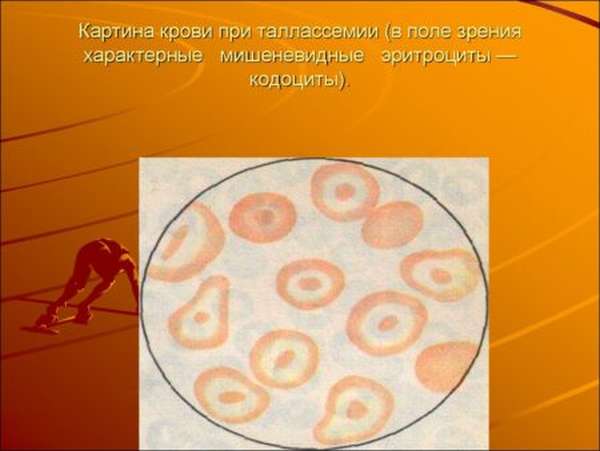
Данное пятно смещается в шлемовидную форму, образующуюся по краям мембраны. Чтобы разобраться, как формируются мишеневидные эритроциты, можно в качестве примера зажать резиновый шар. Вмятины увеличиваются, пока не дотронуться до вершин, затем дно самой мягкой вмятины выпячивается, формируя выпуклость, где концентрируется избыточная поверхность. Из-за слабой устойчивости центральной выпуклости, спровоцированной лишней поверхностью, начинается формирование перемычек, шлемовидных холмиков и полос.
- Характеристика морфологии мишеневидных клеток
- Эритроциты в анализе крови
- Причины возникновения патофизиологии клеток
- Способы лечения
Характеристика морфологии мишеневидных клеток
В мишеневидном эритроците мало гемоглобина. В классификации нормальных эритроцитов должно быть 30 процентов гемоглобина от объема клетки. Нехватка вещества вызывает сокращение клеточного объема, формирование плоской формы.
Изменение формы эритроцитов приводит к тому, что они становятся жесткими, плоскими и тонкими. Диаметр клетки растет до 8,5 мкм. Слишком большие размеры и высокая плотность эритроцита обуславливает сложность прохождения через капилляры. Это причина формирования сжатий. В клеточной оболочке возникают крупные касательные и растягивающие напряжения каплевидной формы. Образования разрушают клеточную структуру по экватору. Расслоенный эритроцит превращается из мишеневидного в звездчатую клетку.
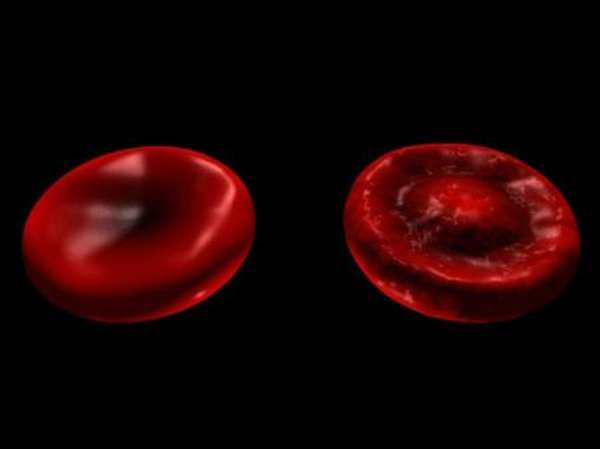
Внимание! В ветеринарии при исследовании крови животных также выявляются деформированные дегенеративные клетки крови.
Эритроциты в анализе крови
Эритроциты мишеневидного типа в образце периферической крови возникают, когда величина периферической клеточной мембраны становится больше, чем количество гемоглобина, содержащегося в ней. Поэтому мишеневидные частицы обозначают рост клеточной мембраны у пациентов с печеночными заболеваниями, при гипохромии и железодефицитной анемии третьей степени, когда концентрация внутриклеточного гемоглобина падает. Это явление встречается у людей с пойкилоцитозом, анизоцитозом, талассемией и дефицитом железа.
Появление мишеневидных эритроцитов и измененных лейкоцитов характерно для анализа крови больных с некоторыми разновидностями регенеративных нарушений гемоглобина. К примеру: аномальным считается гемоглобин С и S. В такой ситуации деформированные клетки формируются из-за агрегации нездорового гемоглобина. Эти заболевания появляются и у ребенка, и у взрослого.
Причины возникновения патофизиологии клеток
При болезнях печени мишеневидные клетки формируются из-за высокого скопления липидов на мембранных стенках эритроцитов. Это увеличивает размеры поверхности клетки по отношению к цитоплазме. В отличие от клеток мишеневидного типа, появляющихся при талассемии, называемых «микроцитами», деформированные эритроциты при печеночных патологиях являются макроцитами. Средний объем таких клеток составляет 110 фл.
Сильнее всего на формирование макроцитов влияет алкоголизм. Этот процесс не зависит от заболевания печени или недостатка кобаламина или фолата. Здесь причина в деформации мембранных стенок эритроцитов, связанных с альдегидными частицами – веществами, образующимися из-за деятельности этанола.
Эхиноциты обладают маленькими зубчиками, покрывающими поверхность эритроцитной мембраны. Несмотря на то, что данные клетки попадаются в образцах крови редко, особенно если в ней мало альбумина, эхиноциты обнаруживаются при острой печеночной и почечной недостаточности.
Читайте также: Пойкилоцитоз в общем анализе крови – причины, в чем опасность патологии и к чему она приводит
Способы лечения
Мишеневидные эритроциты, появившиеся на фоне алкогольной зависимости или избытка соли в организме, -я серьезная проблема. Поэтому решать ее нужно сразу после, как поставлен диагноз. Если игнорировать явление, то в клеточной оболочке в дальнейшем наблюдаются растягивающие напряжения, что приводит к разрушению эритроцитов. Достигнув зрелости, мишеневидные эритроциты трансформируются в звездчатые клетки, а состояние здоровья усугубляется.
Для лечения назначаются сборы трав на основе липы и ромашки. В некоторых случаях прописывают медикаментозные препараты, обеспечивающие улучшение состояния больного.
Оставляя патологию без лечения, пациент рискует получить серьезные заболевания печени. Поэтому к показателям анализов нужно относиться серьезно. Чем раньше начать лечение, тем проще побороть патологические процессы в организме.
Механизм формирования патологических мишеневидных эритроцитов в кровяной плазме

Являясь основной частью клеточной популяции крови млекопитающих, эритроциты и тромбоциты в значительной степени определяют ее реологические свойства [4]. Весьма велика в этом плане роль их агрегации и поверхностной геометрии, и в этой связи остаются весьма востребованными методические подходы к изучению микрореологических эритроцитов и тромбоцитов у людей и животных, что позволит своевременно и адекватно проводить у них их оценку и при необходимости контролируемую, предотвращая дисциркуляторные нарушения в жизненно важных органах [3, 5].
Не вызывает сомнений, что микрореологические дисфункции эритроцитов и тромбоцитов являются также и важным патогенетическим фактором развития многих заболеваний. В условиях патологии ухудшение их реологических свойств может стать первоосновой нарушения функций внутренних органов, что во многом способно определить тяжесть состояния человека или животного и дальнейший прогноз. Все это подчеркивает диагностическую ценность лабораторной оценки агрегации и цитоархитектоники эритроцитов и тромбоцитов.
Имеющие место в кровотоке межэритроцитарные поверхностные взаимодействия определяются пространственной плотностью и качественным составом мембраны (фосфатные, аминные, карбоксильные и др. химические группы) [8]. Понижение плотности поверхностного отрицательного заряда эритроцитов приводит к дестабилизации их суспензии, возможно, за счет сорбции на поверхности мембраны эритроцита макромолекул (чаще всего фибриноген) [10].
Наблюдаемая физиологическая агрегация эритроцитов имеет характер линейных цепочек в виде монетных столбиков, состоящих из 5–6 клеток, с возможностью полной гидродинамической дезагрегации эритроцитов в сосудистом русле. При очень низких скоростях сдвига эритроциты даже в норме почти полностью объединены в монетные столбики. При повышении скорости сдвига монетные столбики полностью разрушаются и кровь течет по сосудам, состоя из отдельных клеток [11].
Наиболее важным признаком патологической агрегации эритроцитов является глыбчатая их агрегация с увеличением прочности сцепления между эритроцитами, сохраняющаяся даже при 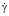 = 250 с-1. Такие агрегаты циркулируют по крови благодаря наличию в организме системы шунтов, минуя капиллярное русло, обеспечивая тем самым не только непрерывность кровотока, но и его централизацию с недостаточностью тканевой перфузии [10, 11].
= 250 с-1. Такие агрегаты циркулируют по крови благодаря наличию в организме системы шунтов, минуя капиллярное русло, обеспечивая тем самым не только непрерывность кровотока, но и его централизацию с недостаточностью тканевой перфузии [10, 11].
Изменения формы эритроцитов от дискоидной до сферической приводит к невозможности свободной упаковки эритроцитов, что ведет к увеличению площади соприкосновения (следовательно, к патологической агрегации). При этом, эхиноцитарная трансформация существенно увеличивает прочность агрегатов.
Колебания соотношения альбумина и фибриногена в плазме является дополнительным показателем суспензионной стабильности крови. Альбумин – наиболее эффективный дезагрегант и естественный антагонист фибриногена [1, 10]. При уменьшении соотношения между концентрацией альбумина и крупномолекулярными белками (глобулины, фибриногеном и продуктами деградации фибрина) ослабляет суспензионную стабильность крови.
Для оценки агрегации эритроцитов кровь из вены забирают в утренние часы после 14-часового голодания из вены через толстую иглу самотеком в пробирку с цитратом натрия в соотношении 9:1 и центрифугируют 10 мин. при 3 000 об./мин. В 96 луночной планшетке заполняют 2 лунки 0,2 мл плазмы обследуемого. Из пробирки удаляется вся плазма и слой лейкоцитов. Эритроциты ресуспепдируются стандартным фосфатным буфером в соотношении 1:4 с последующим центрифугированием в течение 10 мин. при 3 000 об./мин., что позволяет отмыть их от остатков плазмы при удалении надосадочной жидкости. После этого берется 0,02 мл эритроцитов и ресуспендируется в первой заполненной аутологичной плазмой лунке 96 луночной планшетки, что позволяет получить 10 % гематокрит. Затем из этой лунки забирают чистой сухой пипеткой 0,02 мл содержимого и помещают во вторую заполненную лунку, что позволяет получить 1 % гематокрит. После этого 1 сетку в камере Горяева заполняют полученной суспензией эритроцитов, выдерживают 3 мин. для возникновения спонтанной агрегации и проводят подсчет свободных эритроцитов (в т.ч. 2 эритроцита вместе) и агрегатов, начиная с 3 эритроцитов, соединенных в виде «монетных столбиков») в 2-х больших квадратах камеры (объектив х 40, окуляр х 10). Считаются количество «монетных столбиков» и количество эритроцитов, вовлеченных в них.
Агрегационную активность эритроцитов можно регистрировать с помощью светового микроскопа путем подсчета в камере Горяева количества агрегатов эритроцитов, агрегированных и неагрегированных эритроцитов во взвеси отмытых эритроцитов в плазме крови с вычислением среднего размера агрегата (СРА) [5]:
где СЭА – сумма всех эритроцитов в агрегате;
КА – количество агрегатов.
Показатель агрегации (ПА) рассчитывается по следующей формуле:
ПА = (СРА х КА + КСЭ) / (КА + КСЭ),
где КСЭ – количество свободных эритроцитов.
Процент неагрегированных эритроцитов (ПНА) определяется:
ПНА = (КСЭ х 100) / (СРА х КА + КСЭ).
Оценка цитоархитектоники эритроцитов ведется с применением световой фазовоконтрастной микроскопии. Для исследования поверхностной геометрии эритроцитов кровь фиксируется в 1 % растворе глутарового альдегида («Fluka», Switzerland) на среде 199 (рН 7,4) при температуре 4 ºС в течение одних суток, после чего готовится препарат «раздавленная капля». Подсчет клеток производится в процентах на 200 эритроцитов. Регистрируемые эритроциты типируются согласно классификации, предложенной Г.И. Козинцем с соавт. [2], подразделяющей эритроциты на десять классов: дискоциты; дискоциты с одним выростом; дискоциты с гребнем; дискоциты с множественными выростами; эритроциты в виде тутовой ягоды; куполообразные эритроциты (стоматоциты); сфероциты с гладкой поверхностью; сфероциты с шипиками на поверхности; эритроциты в виде «спущенного мяча»; дегенеративные формы эритроцитов.
Первые пять классов эритроцитов (дискоциты, в т.ч. с признаками эхиноцитарной трансформации) считаются обратимо деформированными в виду их способности спонтанно восстанавливать форму. Остальные классы эритроцитов относят к группе необратимо деформированных или предгемолитических форм.
Современная оценка микрореологических свойств крови немыслима без определения агрегации тромбоцитов, осуществляющейся визуальным способом [7], хорошо показавшим себя на практике [6]. С этой целью кровь забирают с цитратом натрия 3,8 % в соотношении 9:1, центрифугируют 5 мин. при 1000 об/мин. для получения богатой тромбоцитами плазмы (БТП). Часть плазмы отбирают, а оставшуюся центрифугируют при 3000 об/мин. в течение 20 мин., получают бедную тромбоцитами плазму (БеТП). БТП стандартизируют по числу тромбоцитов (до 200·109/л.).
Из получившегося объема стандартизированной плазмы отбирают из расчета по 0,02 мл плазмы на каждый исследуемый индуктор и их комбинацию. Оставшийся объем плазмы можно использовать для других гематологических и биохимических исследований. Из отобранного объема стандартизированной плазмы на предметное стекло наносят 0,02 мл плазмы и разными пипетками по 0,02 мл раствора индуктора. В качестве агонистов возможно применение, в т.ч. АДФ (0,5×10-4 М), коллагена (разведение 1:2 основной суспензии), тромбина (0,125 ед/мл), адреналина (5,0×10-6 М), ристомицина (0,8 мг/мл), перекиси водорода (7,3×10-3 м). Стеклянной палочкой смешивают плазму с индукторами и включают секундомер. Смесь перемешивают так, чтобы жидкость занимала окружность диаметром около 2 см. Покачивая стекло круговыми движениями в проходящем свете осветителя, на черном фоне следят через лупу за возникновением агрегатов. При появлении отчетливых агрегатов, просветлении раствора и прилипании части агрегатов к стеклу секундомер отключают и фиксируют время агрегации тромбоцитов. Реакцию повторяют 2–3 раза с каждым индуктором и находят среднее арифметическое из полученных результатов.
Оптимальными значениями агрегации тромбоцитов при концентрации тромбоцитов 200·109/л составляет для АДФ – 37–50 с, коллаген – 27–36 с, ристомицин – 38–50 с, тромбин – 48–59 с, адреналин – 81–106 с, перекись водорода – 40–60 с.
Регистрация внутрисосудистой активности тромбоцитов возможна по методу [9], когда из локтевой вены берут 2 мл в силиконированную центрифужную пробирку с 8 мл раствора 0,125 % глутаральдегида и сразу центрифугируют 6 мин при 1000 об/мин. Супернатант разводят раствором глутаральдегида в четыре раза (0,1 мл + 0,3 мл раствора), перемешивают пипеткой 5 раз и заполняют камеру Горяева, которую помещают на 20 мин. в увлажненную чашку Петри.
При помощи фазовоконтрастного микроскопа определяют процентное распределение описанных выше форм тромбоцитов на 200 клеток. Первым видимым проявлением активации кровяных пластинок является изменение их формы, которое может служить для адекватной оценки этого процесса как индуцируемого in vitro, так и развивающегося в организме. В сосудистом русле при отсутствии патологических активирующих влияний подавляющее большинство интактных тромбоцитов, называемых дискоцитами, имеет характерную дискоидную форму или форму чечевицы и практически гладкую поверхность. Интактное состояние тромбоцитов, сопряженное с формой дискоцита, – один из важнейших факторов, препятствующих неоправданному развитию внутрисосудистого тромбоза. Механизмы его обеспечения достаточно сложны. Это отчасти связано с тем, что интактное состояние этих клеток сочетается с потенциальной возможностью быстрых и специфичных преобразований при появлении в кровотоке активирующих стимулов. Характерное изменение формы при индуцировании гемостатических реакций кровяных пластинок отражает определенные процессы их внутренней ультраструктурной и биохимической перестройки [12]. При этом развивается типичная последовательность изменений: от формы интактного тромбоцита – дискоцита к активированным клеткам – дискоэхиноциту, т.е. дискоциту, у которого на поверхности появляются отростки, и далее к сфероциту или сфероэхиноциту. У последнего не только форма становится все более сферичной, но и возрастает число отростков.
Оценка степени агрегации осуществляется также по относительному числу всех тромбоцитов, вовлеченных в агрегационную реакцию. Последнее может быть выявлено по процентному отношению числа агрегировавших тромбоцитов к общему их числу в препарате (т.е. к сумме свободно лежащих клеток и вовлеченных в агрегацию) по формуле:
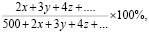
где x, y, z и т.д. – число агрегатов соответствующего размера на 500 свободных тромбоцитов.
Оценка состояния основных микрореологических свойств эритроцитов и тромбоцитов не требует дорогостоящего оборудования, дает полную информацию об их динамике. При применении данных морфофункциональных методов установлено, что и у здорового человека и животных в циркулирующей крови лишь у небольшой части эритроцитов и тромбоцитов изменена форма. Однако в патологических условиях изменения этих показателей могут быть намного более выражены вследствие внутрисосудистой альтерации эритроцитов и кровяных пластинок. Это обуславливает то, что при патологических состояниях микроциркуляция может значительно ухудшаться, т.к. появляется значительное количество эритроцитов и тромбоцитов с измененной формой и их внутрисосудистых агрегатов.
Таким образом, оценка агрегации и цитоархитектоники – это важный элемент диагностики состояния животных и человека, позволяющий при необходимости своевременно определять сроки начала корректирующего вмешательства.
Рецензенты:
Громнацкий Н.И., д.м.н., профессор, профессор кафедры терапии № 2 Курского государственного медицинского университета, г. Курск;
Жукова Л.А., д.м.н., профессор, заведующий кафедрой эндокринологии и диабетологии Курского государственного медицинского университета, г. Курск.
Механизм формирования патологических мишеневидных эритроцитов в кровяной плазме

Гемолитическая анемия объединяет группу заболеваний красной крови наследственного и приобретенного характера, основным признаком которых является выраженный гемолиз. Это может быть связано с двумя причинами: 1 – с воздействием на эритроциты внешних факторов, которые либо непосредственно повреждают клетки, либо так изменяют их свойства, что эритроциты быстро разрушаются (приобретенные гемолитические анемии), 2 – с наследственными дефектами эритроцитов (наследственные гемолитические анемии) [1, с. 562].
Токсическая гемолитическая анемия – вид анемии, вызванный воздействием лекарственных препаратов или химических веществ. Возможные вещества, которые вызывают этот вид анемии: противомалярийные препараты (с хинином), металлы, нитриты, некоторые антибактериальные и противовирусные средства, змеиный яд, сульфаниламиды и другие вещества.
Доказано, что бензол, его гомологи и соединения при длительном воздействии на организм в концентрациях, превышающих предельно допустимую концентрацию, могут вызывать угнетение костномозгового кроветворения с развитием гипопластической, апластической анемии, метгемоглобинемию, гемолитическую анемию и способствовать развитию лейкозов.
Гемолитические анемии представлены большой группой разнородных по механизму и происхождению анемических состояний. Их объединяющим признаком является преобладание процессов кроверазрушения над процессами кровообразования. Кроверазрушение может происходить преимущественно внутри сосудов или вне их. Причины внутрисосудистого гемолиза: гемолитические яды, тяжелые ожоги, малярия, сепсис, переливание несовместимой крови, нарушения в работе иммунной системы, вирусные инфекции, хронический лимфолейкоз, системная красная волчанка. Внутриклеточный гемолиз происходит в некоторых внутренних органах, преимущественно в селезенке, сопровождается увеличением селезенки. Вследствие повышенного разрушения эритроцитов в крови нарастает количество непрямого билирубина. Кроверазрушение сопровождается уменьшением общего количества эритроцитов и повышением количества ретикулоцитов в крови, а также увеличением количества эритробластов в костном мозге. Уровень железа в сыворотке крови может быть повышен. При ряде нарушений характерно снижение стойкости эритроцитов, что способствует их быстрому разрушению. [2, с.67–68]
Среди анемий химической этиологии гемолитические встречаются наиболее часто. Вещества, вызывающие внутрисосудистый гемолиз, можно разделить на три группы:
1. Разрушающие эритроциты (при определенной дозе): яд змей и пауков, сульфоны, фенол, бензол, толуол, хлороформ.
2. Гемолизирующие все форменные элементы у лиц с врожденной недостаточностью Г-6Ф-ДГ: ацетилсалициловая кислота, аскорбиновая кислота, хлорамфеникол, сульфаниламиды.
3. Вызывающие иммунные гемолитические анемии: пенициллин и ряд других антибактериальных препаратов, некоторые НПВС.
Часть веществ, относящихся к первой группе, такие как бензол, толуол, хлороформ, действуют непосредственно на мембрану эритроцитов, разрушая ее. Другие – являются метгемоглобинообразователями, и развивающийся при интоксикации ими гемолиз является вторичным явлением. Особенно чувствительны к таким токсикантам лица с дефицитом глутатионредуктазы и Г-6Ф-ДГ, что объединяет их с веществами, составляющими вторую группу. Действуя в высоких дозах, препараты второй группы вызывают гемолиз и у лиц без дефектов энзимов. Таким образом, различие между группами достаточно условно.
Механизмы лекарственно-индуцированных иммунных гемолитических анемий могут быть разными. Некоторые препараты (пенициллин) ковалентно связываются с белками мембраны эритроцитов. Гемолиз развивается вследствие атаки изменённых мембран эритроцитов антителами (обычно IgG) в присутствии комплемента.
Таким образом, гаптеновый механизм развития лекарственно-обусловленных гемолитических анемий заключается в том, что лекарственное средство присоединяется к мембране эритроцита. В последующем вырабатываются аутоантитела против данного комплекса. Прямая проба Кумбса при этом положительная. При фиксации к комплексу комплемента возможно развитие внутрисосудистого гемолиза.
Иммунокомплексный механизм развития лекарственно-обусловленных гемолитических анемий заключается в следующем. Такие лекарственные препараты, как, например, хинидин, вызывают образование антител IgM. В результате образуются иммунные комплексы, оседающие на поверхности эритроцитов. После отмены лекарственных препаратов отмечается, как правило, положительная динамика.
Образующиеся антитела класса IgM или IgG часто фиксируют комплемент. При этом элиминация иммунного комплекса происходит на мембране эритроцита с его повреждением.
Также к механизмам развития лекарственно-обусловленных гемолитических анемий относится аутоиммунный. Лекарственные средства (метилдопа и др.) способны индуцировать выработку аутоантител прямого действия против эритроцитов с развитием заболевания, схожего с идиопатической АИГА с тепловыми агглютининами [3, с. 189].
Гемолитики разрушают эритроциты, и гемоглобин выходит в плазму крови. Растворенный в плазме гемоглобин способен связывать кислород в такой же степени, как и заключенный в эритроциты. Поэтому в первые часы после острого воздействия токсикантов клиническая картина гипоксии практически не выражена.
Важными элементами патогенеза острых интоксикаций гемолитиками являются:
– существенное повышение коллоидно- осмотических свойств крови (содержание белка в плазме крови возрастает с 7 до 20 %);
– ускоренное разрушение гемоглобина (в эритроцитах гемоглобин сохраняется в среднем около 100 дней, т. е. весь период жизни клетки, а в случае тяжелого гемолиза уже через сутки уровень Hb может составлять менее 30 % от нормы);
– затруднение диссоциации оксигемоглобина и, как следствие, ухудшение оксигенации тканей (одна из причин явления – существенно более низкое содержание в плазме крови, в сравнении с эритроцитами, основного биорегулятора сродства кислорода к гемоглобину 2,3–дифосфоглицерата);
– нефротоксическое действие гемоглобина, свободно циркулирующего в плазме крови [4, с.551–553].
Общий механизм гемолиза эритроцитов заключается в дезорганизации фосфолипидно-белковой структуры их мембраны. [5, с.49] Повреждающий фактор вызывает повышение проницаемости мембраны эритроидных клеток и накопление в их гиалоплазме избытка осмотически активных веществ (Na+, K+, Ca2+ и др.). Это, в свою очередь, способствует гиперосмии цитозоля. Развиваются гипергидратация и набухание эритроидных клеток. Способность эритроцитов к деформациям в синусах селезенки снижается. Плазмолемма эритроидных клеток разрушается, то есть развивается гемолиз.
Наиболее объективным критерием тяжести гемолитического процесса следует считать определение содержания свободного гемоглобина в плазме крови, концентрация которого может достигать 10 г/л и более. Гемоглобинурия обычно отмечается при концентрации свободного гемоглобина в крови 0,8 – 1,0 г/л. При этом возможно изменение окраски мочи в характерный красно-бурый цвет, вплоть до чёрного.
Определение формы гемолитической анемии на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Спленомегалия и гепатомегалия подтверждаются при проведении УЗИ печени и селезенки.
Важнейшим диагностическим критерием в постановке диагноза является проведение лабораторного исследования. Изменения в гемограмме характеризуются нормохромной или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В картине крови в первые часы развития анемии отмечается кратковременная «ложная» гиперхромия [5, с. 49].
В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. У части больных отмечается положительный прямой антиглобулиновый тест: появление IgG или IgG и комплемента [6].
Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина [7, с. 30–62].
Также для постановки диагноза используются данные миелограммы. Для цитологического подтверждения выполняется стернальная пункция. При исследовании пунктата костного мозга выявляется гиперплазия эритроидного ростка.
В последнее время увеличивается роль приобретенных гемолитических анемий (как аутоиммунных, так и токсических) в связи с постоянно возрастающими антигенными, в том числе, лекарственными нагрузками. Гемолиз представляет собой преждевременное разрушение эритроцитов, приводящее к гемолитической анемии, когда активность костного мозга не может компенсировать потери эритроцитов. Этиология и патогенез преждевременного разрушения эритроцитов могут быть связаны с дефектами мембраны эритроцитов, нарушением нормальной структуры гемоглобина, дефектами ферментативных систем эритроцитов и их иммунного разрушения. Актуальными методами диагностики являются общий и биохимический анализы крови, прямой антиглобулиновый тест, исследование мочи, а также миелограмма.
Механизм формирования патологических мишеневидных эритроцитов в кровяной плазме

Являясь основной частью клеточной популяции крови млекопитающих, эритроциты и тромбоциты в значительной степени определяют ее реологические свойства [4]. Весьма велика в этом плане роль их агрегации и поверхностной геометрии, и в этой связи остаются весьма востребованными методические подходы к изучению микрореологических эритроцитов и тромбоцитов у людей и животных, что позволит своевременно и адекватно проводить у них их оценку и при необходимости контролируемую, предотвращая дисциркуляторные нарушения в жизненно важных органах [3, 5].
Не вызывает сомнений, что микрореологические дисфункции эритроцитов и тромбоцитов являются также и важным патогенетическим фактором развития многих заболеваний. В условиях патологии ухудшение их реологических свойств может стать первоосновой нарушения функций внутренних органов, что во многом способно определить тяжесть состояния человека или животного и дальнейший прогноз. Все это подчеркивает диагностическую ценность лабораторной оценки агрегации и цитоархитектоники эритроцитов и тромбоцитов.
Имеющие место в кровотоке межэритроцитарные поверхностные взаимодействия определяются пространственной плотностью и качественным составом мембраны (фосфатные, аминные, карбоксильные и др. химические группы) [8]. Понижение плотности поверхностного отрицательного заряда эритроцитов приводит к дестабилизации их суспензии, возможно, за счет сорбции на поверхности мембраны эритроцита макромолекул (чаще всего фибриноген) [10].
Наблюдаемая физиологическая агрегация эритроцитов имеет характер линейных цепочек в виде монетных столбиков, состоящих из 5–6 клеток, с возможностью полной гидродинамической дезагрегации эритроцитов в сосудистом русле. При очень низких скоростях сдвига эритроциты даже в норме почти полностью объединены в монетные столбики. При повышении скорости сдвига монетные столбики полностью разрушаются и кровь течет по сосудам, состоя из отдельных клеток [11].
Наиболее важным признаком патологической агрегации эритроцитов является глыбчатая их агрегация с увеличением прочности сцепления между эритроцитами, сохраняющаяся даже при 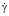 = 250 с-1. Такие агрегаты циркулируют по крови благодаря наличию в организме системы шунтов, минуя капиллярное русло, обеспечивая тем самым не только непрерывность кровотока, но и его централизацию с недостаточностью тканевой перфузии [10, 11].
= 250 с-1. Такие агрегаты циркулируют по крови благодаря наличию в организме системы шунтов, минуя капиллярное русло, обеспечивая тем самым не только непрерывность кровотока, но и его централизацию с недостаточностью тканевой перфузии [10, 11].
Изменения формы эритроцитов от дискоидной до сферической приводит к невозможности свободной упаковки эритроцитов, что ведет к увеличению площади соприкосновения (следовательно, к патологической агрегации). При этом, эхиноцитарная трансформация существенно увеличивает прочность агрегатов.
Колебания соотношения альбумина и фибриногена в плазме является дополнительным показателем суспензионной стабильности крови. Альбумин – наиболее эффективный дезагрегант и естественный антагонист фибриногена [1, 10]. При уменьшении соотношения между концентрацией альбумина и крупномолекулярными белками (глобулины, фибриногеном и продуктами деградации фибрина) ослабляет суспензионную стабильность крови.
Для оценки агрегации эритроцитов кровь из вены забирают в утренние часы после 14-часового голодания из вены через толстую иглу самотеком в пробирку с цитратом натрия в соотношении 9:1 и центрифугируют 10 мин. при 3 000 об./мин. В 96 луночной планшетке заполняют 2 лунки 0,2 мл плазмы обследуемого. Из пробирки удаляется вся плазма и слой лейкоцитов. Эритроциты ресуспепдируются стандартным фосфатным буфером в соотношении 1:4 с последующим центрифугированием в течение 10 мин. при 3 000 об./мин., что позволяет отмыть их от остатков плазмы при удалении надосадочной жидкости. После этого берется 0,02 мл эритроцитов и ресуспендируется в первой заполненной аутологичной плазмой лунке 96 луночной планшетки, что позволяет получить 10 % гематокрит. Затем из этой лунки забирают чистой сухой пипеткой 0,02 мл содержимого и помещают во вторую заполненную лунку, что позволяет получить 1 % гематокрит. После этого 1 сетку в камере Горяева заполняют полученной суспензией эритроцитов, выдерживают 3 мин. для возникновения спонтанной агрегации и проводят подсчет свободных эритроцитов (в т.ч. 2 эритроцита вместе) и агрегатов, начиная с 3 эритроцитов, соединенных в виде «монетных столбиков») в 2-х больших квадратах камеры (объектив х 40, окуляр х 10). Считаются количество «монетных столбиков» и количество эритроцитов, вовлеченных в них.
Агрегационную активность эритроцитов можно регистрировать с помощью светового микроскопа путем подсчета в камере Горяева количества агрегатов эритроцитов, агрегированных и неагрегированных эритроцитов во взвеси отмытых эритроцитов в плазме крови с вычислением среднего размера агрегата (СРА) [5]:
где СЭА – сумма всех эритроцитов в агрегате;
КА – количество агрегатов.
Показатель агрегации (ПА) рассчитывается по следующей формуле:
ПА = (СРА х КА + КСЭ) / (КА + КСЭ),
где КСЭ – количество свободных эритроцитов.
Процент неагрегированных эритроцитов (ПНА) определяется:
ПНА = (КСЭ х 100) / (СРА х КА + КСЭ).
Оценка цитоархитектоники эритроцитов ведется с применением световой фазовоконтрастной микроскопии. Для исследования поверхностной геометрии эритроцитов кровь фиксируется в 1 % растворе глутарового альдегида («Fluka», Switzerland) на среде 199 (рН 7,4) при температуре 4 ºС в течение одних суток, после чего готовится препарат «раздавленная капля». Подсчет клеток производится в процентах на 200 эритроцитов. Регистрируемые эритроциты типируются согласно классификации, предложенной Г.И. Козинцем с соавт. [2], подразделяющей эритроциты на десять классов: дискоциты; дискоциты с одним выростом; дискоциты с гребнем; дискоциты с множественными выростами; эритроциты в виде тутовой ягоды; куполообразные эритроциты (стоматоциты); сфероциты с гладкой поверхностью; сфероциты с шипиками на поверхности; эритроциты в виде «спущенного мяча»; дегенеративные формы эритроцитов.
Первые пять классов эритроцитов (дискоциты, в т.ч. с признаками эхиноцитарной трансформации) считаются обратимо деформированными в виду их способности спонтанно восстанавливать форму. Остальные классы эритроцитов относят к группе необратимо деформированных или предгемолитических форм.
Современная оценка микрореологических свойств крови немыслима без определения агрегации тромбоцитов, осуществляющейся визуальным способом [7], хорошо показавшим себя на практике [6]. С этой целью кровь забирают с цитратом натрия 3,8 % в соотношении 9:1, центрифугируют 5 мин. при 1000 об/мин. для получения богатой тромбоцитами плазмы (БТП). Часть плазмы отбирают, а оставшуюся центрифугируют при 3000 об/мин. в течение 20 мин., получают бедную тромбоцитами плазму (БеТП). БТП стандартизируют по числу тромбоцитов (до 200·109/л.).
Из получившегося объема стандартизированной плазмы отбирают из расчета по 0,02 мл плазмы на каждый исследуемый индуктор и их комбинацию. Оставшийся объем плазмы можно использовать для других гематологических и биохимических исследований. Из отобранного объема стандартизированной плазмы на предметное стекло наносят 0,02 мл плазмы и разными пипетками по 0,02 мл раствора индуктора. В качестве агонистов возможно применение, в т.ч. АДФ (0,5×10-4 М), коллагена (разведение 1:2 основной суспензии), тромбина (0,125 ед/мл), адреналина (5,0×10-6 М), ристомицина (0,8 мг/мл), перекиси водорода (7,3×10-3 м). Стеклянной палочкой смешивают плазму с индукторами и включают секундомер. Смесь перемешивают так, чтобы жидкость занимала окружность диаметром около 2 см. Покачивая стекло круговыми движениями в проходящем свете осветителя, на черном фоне следят через лупу за возникновением агрегатов. При появлении отчетливых агрегатов, просветлении раствора и прилипании части агрегатов к стеклу секундомер отключают и фиксируют время агрегации тромбоцитов. Реакцию повторяют 2–3 раза с каждым индуктором и находят среднее арифметическое из полученных результатов.
Оптимальными значениями агрегации тромбоцитов при концентрации тромбоцитов 200·109/л составляет для АДФ – 37–50 с, коллаген – 27–36 с, ристомицин – 38–50 с, тромбин – 48–59 с, адреналин – 81–106 с, перекись водорода – 40–60 с.
Регистрация внутрисосудистой активности тромбоцитов возможна по методу [9], когда из локтевой вены берут 2 мл в силиконированную центрифужную пробирку с 8 мл раствора 0,125 % глутаральдегида и сразу центрифугируют 6 мин при 1000 об/мин. Супернатант разводят раствором глутаральдегида в четыре раза (0,1 мл + 0,3 мл раствора), перемешивают пипеткой 5 раз и заполняют камеру Горяева, которую помещают на 20 мин. в увлажненную чашку Петри.
При помощи фазовоконтрастного микроскопа определяют процентное распределение описанных выше форм тромбоцитов на 200 клеток. Первым видимым проявлением активации кровяных пластинок является изменение их формы, которое может служить для адекватной оценки этого процесса как индуцируемого in vitro, так и развивающегося в организме. В сосудистом русле при отсутствии патологических активирующих влияний подавляющее большинство интактных тромбоцитов, называемых дискоцитами, имеет характерную дискоидную форму или форму чечевицы и практически гладкую поверхность. Интактное состояние тромбоцитов, сопряженное с формой дискоцита, – один из важнейших факторов, препятствующих неоправданному развитию внутрисосудистого тромбоза. Механизмы его обеспечения достаточно сложны. Это отчасти связано с тем, что интактное состояние этих клеток сочетается с потенциальной возможностью быстрых и специфичных преобразований при появлении в кровотоке активирующих стимулов. Характерное изменение формы при индуцировании гемостатических реакций кровяных пластинок отражает определенные процессы их внутренней ультраструктурной и биохимической перестройки [12]. При этом развивается типичная последовательность изменений: от формы интактного тромбоцита – дискоцита к активированным клеткам – дискоэхиноциту, т.е. дискоциту, у которого на поверхности появляются отростки, и далее к сфероциту или сфероэхиноциту. У последнего не только форма становится все более сферичной, но и возрастает число отростков.
Оценка степени агрегации осуществляется также по относительному числу всех тромбоцитов, вовлеченных в агрегационную реакцию. Последнее может быть выявлено по процентному отношению числа агрегировавших тромбоцитов к общему их числу в препарате (т.е. к сумме свободно лежащих клеток и вовлеченных в агрегацию) по формуле:
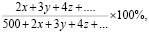
где x, y, z и т.д. – число агрегатов соответствующего размера на 500 свободных тромбоцитов.
Оценка состояния основных микрореологических свойств эритроцитов и тромбоцитов не требует дорогостоящего оборудования, дает полную информацию об их динамике. При применении данных морфофункциональных методов установлено, что и у здорового человека и животных в циркулирующей крови лишь у небольшой части эритроцитов и тромбоцитов изменена форма. Однако в патологических условиях изменения этих показателей могут быть намного более выражены вследствие внутрисосудистой альтерации эритроцитов и кровяных пластинок. Это обуславливает то, что при патологических состояниях микроциркуляция может значительно ухудшаться, т.к. появляется значительное количество эритроцитов и тромбоцитов с измененной формой и их внутрисосудистых агрегатов.
Таким образом, оценка агрегации и цитоархитектоники – это важный элемент диагностики состояния животных и человека, позволяющий при необходимости своевременно определять сроки начала корректирующего вмешательства.
Рецензенты:
Громнацкий Н.И., д.м.н., профессор, профессор кафедры терапии № 2 Курского государственного медицинского университета, г. Курск;
Жукова Л.А., д.м.н., профессор, заведующий кафедрой эндокринологии и диабетологии Курского государственного медицинского университета, г. Курск.
Механизм формирования патологических мишеневидных эритроцитов в кровяной плазме

Гемолитическая анемия объединяет группу заболеваний красной крови наследственного и приобретенного характера, основным признаком которых является выраженный гемолиз. Это может быть связано с двумя причинами: 1 – с воздействием на эритроциты внешних факторов, которые либо непосредственно повреждают клетки, либо так изменяют их свойства, что эритроциты быстро разрушаются (приобретенные гемолитические анемии), 2 – с наследственными дефектами эритроцитов (наследственные гемолитические анемии) [1, с. 562].
Токсическая гемолитическая анемия – вид анемии, вызванный воздействием лекарственных препаратов или химических веществ. Возможные вещества, которые вызывают этот вид анемии: противомалярийные препараты (с хинином), металлы, нитриты, некоторые антибактериальные и противовирусные средства, змеиный яд, сульфаниламиды и другие вещества.
Доказано, что бензол, его гомологи и соединения при длительном воздействии на организм в концентрациях, превышающих предельно допустимую концентрацию, могут вызывать угнетение костномозгового кроветворения с развитием гипопластической, апластической анемии, метгемоглобинемию, гемолитическую анемию и способствовать развитию лейкозов.
Гемолитические анемии представлены большой группой разнородных по механизму и происхождению анемических состояний. Их объединяющим признаком является преобладание процессов кроверазрушения над процессами кровообразования. Кроверазрушение может происходить преимущественно внутри сосудов или вне их. Причины внутрисосудистого гемолиза: гемолитические яды, тяжелые ожоги, малярия, сепсис, переливание несовместимой крови, нарушения в работе иммунной системы, вирусные инфекции, хронический лимфолейкоз, системная красная волчанка. Внутриклеточный гемолиз происходит в некоторых внутренних органах, преимущественно в селезенке, сопровождается увеличением селезенки. Вследствие повышенного разрушения эритроцитов в крови нарастает количество непрямого билирубина. Кроверазрушение сопровождается уменьшением общего количества эритроцитов и повышением количества ретикулоцитов в крови, а также увеличением количества эритробластов в костном мозге. Уровень железа в сыворотке крови может быть повышен. При ряде нарушений характерно снижение стойкости эритроцитов, что способствует их быстрому разрушению. [2, с.67–68]
Среди анемий химической этиологии гемолитические встречаются наиболее часто. Вещества, вызывающие внутрисосудистый гемолиз, можно разделить на три группы:
1. Разрушающие эритроциты (при определенной дозе): яд змей и пауков, сульфоны, фенол, бензол, толуол, хлороформ.
2. Гемолизирующие все форменные элементы у лиц с врожденной недостаточностью Г-6Ф-ДГ: ацетилсалициловая кислота, аскорбиновая кислота, хлорамфеникол, сульфаниламиды.
3. Вызывающие иммунные гемолитические анемии: пенициллин и ряд других антибактериальных препаратов, некоторые НПВС.
Часть веществ, относящихся к первой группе, такие как бензол, толуол, хлороформ, действуют непосредственно на мембрану эритроцитов, разрушая ее. Другие – являются метгемоглобинообразователями, и развивающийся при интоксикации ими гемолиз является вторичным явлением. Особенно чувствительны к таким токсикантам лица с дефицитом глутатионредуктазы и Г-6Ф-ДГ, что объединяет их с веществами, составляющими вторую группу. Действуя в высоких дозах, препараты второй группы вызывают гемолиз и у лиц без дефектов энзимов. Таким образом, различие между группами достаточно условно.
Механизмы лекарственно-индуцированных иммунных гемолитических анемий могут быть разными. Некоторые препараты (пенициллин) ковалентно связываются с белками мембраны эритроцитов. Гемолиз развивается вследствие атаки изменённых мембран эритроцитов антителами (обычно IgG) в присутствии комплемента.
Таким образом, гаптеновый механизм развития лекарственно-обусловленных гемолитических анемий заключается в том, что лекарственное средство присоединяется к мембране эритроцита. В последующем вырабатываются аутоантитела против данного комплекса. Прямая проба Кумбса при этом положительная. При фиксации к комплексу комплемента возможно развитие внутрисосудистого гемолиза.
Иммунокомплексный механизм развития лекарственно-обусловленных гемолитических анемий заключается в следующем. Такие лекарственные препараты, как, например, хинидин, вызывают образование антител IgM. В результате образуются иммунные комплексы, оседающие на поверхности эритроцитов. После отмены лекарственных препаратов отмечается, как правило, положительная динамика.
Образующиеся антитела класса IgM или IgG часто фиксируют комплемент. При этом элиминация иммунного комплекса происходит на мембране эритроцита с его повреждением.
Также к механизмам развития лекарственно-обусловленных гемолитических анемий относится аутоиммунный. Лекарственные средства (метилдопа и др.) способны индуцировать выработку аутоантител прямого действия против эритроцитов с развитием заболевания, схожего с идиопатической АИГА с тепловыми агглютининами [3, с. 189].
Гемолитики разрушают эритроциты, и гемоглобин выходит в плазму крови. Растворенный в плазме гемоглобин способен связывать кислород в такой же степени, как и заключенный в эритроциты. Поэтому в первые часы после острого воздействия токсикантов клиническая картина гипоксии практически не выражена.
Важными элементами патогенеза острых интоксикаций гемолитиками являются:
– существенное повышение коллоидно- осмотических свойств крови (содержание белка в плазме крови возрастает с 7 до 20 %);
– ускоренное разрушение гемоглобина (в эритроцитах гемоглобин сохраняется в среднем около 100 дней, т. е. весь период жизни клетки, а в случае тяжелого гемолиза уже через сутки уровень Hb может составлять менее 30 % от нормы);
– затруднение диссоциации оксигемоглобина и, как следствие, ухудшение оксигенации тканей (одна из причин явления – существенно более низкое содержание в плазме крови, в сравнении с эритроцитами, основного биорегулятора сродства кислорода к гемоглобину 2,3–дифосфоглицерата);
– нефротоксическое действие гемоглобина, свободно циркулирующего в плазме крови [4, с.551–553].
Общий механизм гемолиза эритроцитов заключается в дезорганизации фосфолипидно-белковой структуры их мембраны. [5, с.49] Повреждающий фактор вызывает повышение проницаемости мембраны эритроидных клеток и накопление в их гиалоплазме избытка осмотически активных веществ (Na+, K+, Ca2+ и др.). Это, в свою очередь, способствует гиперосмии цитозоля. Развиваются гипергидратация и набухание эритроидных клеток. Способность эритроцитов к деформациям в синусах селезенки снижается. Плазмолемма эритроидных клеток разрушается, то есть развивается гемолиз.
Наиболее объективным критерием тяжести гемолитического процесса следует считать определение содержания свободного гемоглобина в плазме крови, концентрация которого может достигать 10 г/л и более. Гемоглобинурия обычно отмечается при концентрации свободного гемоглобина в крови 0,8 – 1,0 г/л. При этом возможно изменение окраски мочи в характерный красно-бурый цвет, вплоть до чёрного.
Определение формы гемолитической анемии на основе анализа причин, симптоматики и объективных данных относится к компетенции гематолога. При первичной беседе выясняется семейный анамнез, частота и тяжесть протекания гемолитических кризов. В процессе осмотра оценивается окраска кожных покровов, склер и видимых слизистых, производится пальпация живота для оценки величины печени и селезенки. Спленомегалия и гепатомегалия подтверждаются при проведении УЗИ печени и селезенки.
Важнейшим диагностическим критерием в постановке диагноза является проведение лабораторного исследования. Изменения в гемограмме характеризуются нормохромной или гипохромной анемией, лейкопенией, тромбоцитопенией, ретикулоцитозом, ускорением СОЭ. В картине крови в первые часы развития анемии отмечается кратковременная «ложная» гиперхромия [5, с. 49].
В биохимических пробах крови определяется гипербилирубинемия (увеличение фракции непрямого билирубина), увеличение активности лактатдегидрогеназы. У части больных отмечается положительный прямой антиглобулиновый тест: появление IgG или IgG и комплемента [6].
Исследование мочи выявляет протеинурию, уробилинурию, гемосидеринурию, гемоглобинурию. В копрограмме повышено содержание стеркобилина [7, с. 30–62].
Также для постановки диагноза используются данные миелограммы. Для цитологического подтверждения выполняется стернальная пункция. При исследовании пунктата костного мозга выявляется гиперплазия эритроидного ростка.
В последнее время увеличивается роль приобретенных гемолитических анемий (как аутоиммунных, так и токсических) в связи с постоянно возрастающими антигенными, в том числе, лекарственными нагрузками. Гемолиз представляет собой преждевременное разрушение эритроцитов, приводящее к гемолитической анемии, когда активность костного мозга не может компенсировать потери эритроцитов. Этиология и патогенез преждевременного разрушения эритроцитов могут быть связаны с дефектами мембраны эритроцитов, нарушением нормальной структуры гемоглобина, дефектами ферментативных систем эритроцитов и их иммунного разрушения. Актуальными методами диагностики являются общий и биохимический анализы крови, прямой антиглобулиновый тест, исследование мочи, а также миелограмма.
Стратегия заместительной терапии острой кровопотери. Часть I

Основные принципы коррекции постгеморрагических нарушений гомеостаза.
Заместительной терапии острой кровопотери, возможностях и различных методиках ее коррекции посвящено огромное число работ во всех областях клинической медицины. Само по себе это свидетельствует как о крайней актуальности проблемы, так и об отсутствии единого мнения о путях её решения. То, что совсем недавно принималось за аксиому, на современном этапе развития медицины стало не только ставиться под сомнение, но и порой полностью отвергаться. К примеру, концепция замещения по принципу «капля за каплю» и переливание цельной крови сегодня полностью оставлены. И это притом, что в литературе прошлых лет приводятся десятки и сотни примеров о почти фантастических по своей целебной силе эффектах переливания цельной крови и массивных гемотрансфузий. Эволюция биотехнологий и достижения фарминдустрии сегодня позволяют всё чаще говорить об ограничении трансфузии компонентов крови, порой даже в случаях массивной кровопотери. Однако, возможности использования последних достижений гемотрансфузиологии, к сожалению, ограничены в стационарах неотложной хирургии, хотя именно в них сосредотачивается основная масса пациентов с кровотечениями различной этиологии.
Остро возникшая кровопотеря приводит к двум основным последствиям: гиповолемии и гипоксии. Причем тяжесть патофизиологических сдвигов определяется как скоростью кровопотери, так и её объемом. Продолжающее артериальное кровотечение приводит к быстрому снижению ОЦК, как следствие возникает патологическое несоответствие между емкостью сосудистого русла и оставшимся относительно малым объемом циркулирующей крови, развивается прогрессирующая гипотония, централизация кровообращения. Именно большая скорость кровопотери не позволяет эффективно включиться одному из главных физиологических механизмов компенсации кровопотери – аутогемодилюции. Аутогемодилюция в свою очередь состоит из быстрой первой фазы и замедленной второй фазы. Первая фаза, продолжающаяся в первые 2 – 6 часов с момента кровотечения позволяет восстановить до 25% ОЦК. Скорость перемещения интерстициальной жидкости в сосудистое русло и, соответственно, аутогемодилюции в первой фазе составляет до 2 мл/мин. Вторая фаза более продолжительна, требует от 12 до 48 часов, и должна приводить к практически полному восстановлению ОЦК. Второй механизм быстрой компенсации кровопотери – нервный – приводит к спазму сосудов и тем самым уменьшению емкости сосудистого русла, что влечет за собой гипоперфузию тканей и является пусковым механизмом централизации кровообращения с повышением венозного возврата. Следует отметить, что при падении АД ниже 50 мм рт. ст. компенсация гемодинамики за счет повышения тонуса сосудов становится малоэффективной.
Гипоксия при кровотечении носит как циркуляторный, так и гемический (анемический) характер. Именно двойственность патогенеза нарушений кислородного режима организма при кровотечении обуславливает как тяжелые патофизиологические сдвиги, так и сложность их патогенетической коррекции. Циркуляторная гипоксия, связанная с падением сердечного выброса приводит к снижению величины рО2 в клетках, включению анаэробного пути метаболизма и развитию ацидоза. Особый практический интерес представляет наблюдающаяся с течением времени трансформация нарушений кислородного режима в постгеморрагическом периоде. Так, выходящая на первый план в период продолжающегося кровотечения циркуляторная гипоксия после остановки кровотечения и компенсации макроциркуляции постепенно сменяется на гемическую гипоксию в результате аутогемодилюции, либо вследствие интенсивной инфузионной терапии. В последние годы особое значение уделяется так называемой постинфузионной гемической гипоксии, определена её роль в нарушениях кислородного режима организма и тяжелые патофизиологические последствия. Оптимальным уровнем гемодилюции на фоне введения инфузионных сред большинством автором признается уровень гематокрита не ниже 30%. Именно при этом уровне гемодилюции наблюдается выраженное улучшение реологических свойств крови, и, что самое главное, происходит повышение сердечного выброса без увеличения силы сердечных сокращений и потребности миокарда в кислороде, а лишь за счет улучшения реологических свойств и снижения общего периферического сосудистого сопротивления. Однако, принятая концепция лечения острой кровопотери по принципу «сначала восполняется объем циркулирующей крови, а затем ее качество» порой приводит к выраженной постинфузионной гемодилюции (гематокрит
Эта статья.
. про отделения

Читайте также
Ограничения в связи с профилактикой распространения коронавирусной инфекции COVID-19
© 2021 – ФГБУ «Клиническая больница №1» (Волынская) Управления делами Президента РФ. Использование материалов разрешается только при условии указания ссылки на сайт volynka.ru Сайт носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями статьи 437 (п.2) ГК РФ. Лицензия ФС-99-01-009740 от 31.03.2020. Выдана Федеральной службой по надзору в сфере здравоохранения. Без ограничения срока действия.
Колл-центр
(пн-пт 8:00-20:00, сб-вс 9:00-15:00)
8 (495) 620-80-95
Госпитализация (круглосуточно)
8 (499) 394-67-57
Скорая помощь (круглосуточно)
8 (495) 620-84-04
8 (499) 390-80-84


