Роль белков, жиров и углеводов в организме человека
Питание это основа нашей жизни. Именно из пищи мы ежедневно получаем самые разнообразные и необходимые нам вещества. Питание обеспечивает развитие человека, процессы роста, физическую и умственную активность, настроение, и, в конечном счете, качество всей нашей жизни. Для обеспечения внутреннего баланса организма в нашем распоряжении есть три компонента: белки, жиры и углеводы.
Суточная потребность человека в этих компонентах может разниться в зависимости от многих факторов, например пол, вес, возраст, уровень физической активности и др.
Белки.
Белки представляют собой важнейшую составляющую часть пищи. Это своего рода строительный материал, обеспечивающий создание и обмен клеток и тканей организма, обмена веществ.
При недостаточности белков в пище появляется повышенная восприимчивость организма к инфекционным заболеваниям, также может нарушаться деятельность нервной системы, печени и других органов.
Физиологическая потребность в белке для взрослого населения – от 65 до 117 г/сутки  для мужчин и от 58 до 87 г/сутки для женщин.
для мужчин и от 58 до 87 г/сутки для женщин.
Физиологическая потребность в белке детей до 1 года – 2,2 – 2,9 г/кг массы тела, детей старше 1 года от 36 до 87 г/сутки.
1 грамм белка при окислении в организме даёт 4 ккал.
Белки подразделяются на белки животного и растительного происхождения.
Белки животного происхождения имеют очень высокую биологическую ценность, так как именно животные белки являются основными перевозчиками незаменимых аминокислот. Белки животного происхождения содержатся в молочных продуктах, во всех видах мяса, морепродуктах, яйцах.
Для взрослого человека рекомендуемая в суточном рационе доля белков животного происхождения от общего количества белков составляет 50 %, для детей 60 %.
Белки растительного происхождения, в отличие от животных содержат такой тип жира, который не позволяет увеличить уровень холестерина, и небольшое его количество помогает сократить каллорийность.
Белки растительного происхождения содержатся в овощах, фруктах, злаковых культурах.
Жиры.
Жиры это ещё одна важная составляющая нашего питания. Жиры это источник энергии. Они придают блюдам высокие вкусовые качества, тем самым способствуют возбуждению аппетита.
Физиологическая потребность в жирах – от 70 до 154 г/сутки для мужчин и от 60 до 102 г/сутки для женщин.
Физиологическая потребность в жирах – для детей до года 6 – 6,5 г/кг массы тела, для детей старше года – от 40 до 97 г/сутки.
Жиры подразделяются на два основных класса насыщенные и ненасыщенные.
Насыщенные жиры это жиры животного происхождения. К таким жирам относятся  бараний, говяжий, свиной и ряд других. Насыщенные жиры участвуют в строении клеток. Поэтому избыточное потребление насыщенных жиров является важнейшим фактором риска развития диабета, ожирения, сердечно-сосудистых и других заболеваний.
бараний, говяжий, свиной и ряд других. Насыщенные жиры участвуют в строении клеток. Поэтому избыточное потребление насыщенных жиров является важнейшим фактором риска развития диабета, ожирения, сердечно-сосудистых и других заболеваний.
Ненасыщенные жирные кислоты в основном содержатся в растительной пище, а также встречаются в морепродуктах.
Эти кислоты подразделяются на мононенасыщенные и полиненасыщенные. К мононенасыщенным кислотам относятся жиры рыб, морских млекопитающих, оливковое, кунжутное масла.
Физиологическая потребность в мононенасыщенных жирных кислотах для взрослых должно составлять 10% от калорийности суточного рациона.
1 грамм жира при окислении в организме даёт 9 ккал.
Полиненасыщенные жиры содержатся в подсолнечном, кукурузных маслах, в масле градских орехов, льняном, конопляном маслах, жирной морской рыбе.
Углеводы
Большую часть энергии, которая необходима для нормальной жизнедеятельности организма организм человека получает с углеводами.
Углеводы делятся на два основных класса: простые и сложные. Простые состоят из моносахаридов и олигосахаридов, сложные из полисахаридов и пищевых волокон.
К моносахаридам относятся глюкоза, фруктоза и галактоза. При снижении уровня глюкозы и наоборот высокой её концентрации наступает сонливость, потеря сознания. Моносахариды содержатся в чистом виде в овощах, фруктах, винограде, вишне, землянике, сливе, арбузе также в мёде.
Основными представителями олигосахаридов в питании человека являются сахароза и лактоза.
 Самый распространённый вид сахарозы это сахар. Лактоза это так называемый молочный сахар. Она содержится в молочных и кисломолочный продуктах.
Самый распространённый вид сахарозы это сахар. Лактоза это так называемый молочный сахар. Она содержится в молочных и кисломолочный продуктах.
Полисахариды подразделяются на крахмальные полисахариды (крахмал и гликоген) и неусвояемые полисахариды пищевые волокна (клетчатка, пектины).
Физиологическая потребность в усвояемых углеводах для взрослого человека составляет 50 – 60% от энергетической суточной потребности (от 257 до 586 г/сутки).
Физиологическая потребность в углеводах – для детей до года 13 г/кг массы тела, для детей старше года от 170 до 420 г/сутки.
1 грамм углеводов при окислении в организме даёт 4 ккал.
Белки, жиры, углеводы играют очень важную роль, поэтому нельзя обеспечить полноценное существование и развитие организма без достаточного поступления питательных веществ, так как каждое из них выполняет свою функцию.
Тем, насколько правильно мы будем питаться, обусловлено состояние нашего здоровья, долголетие, счастливая жизнь.
Структура и физиологическое значение липидов и липопротеидов в плазме крови
Международные названия
Содержание
- Дефиниция
- Современная классификация системы липидов
- Классы и подклассы липидов
- Свободные жирные кислоты
- Глицеролипиды
- Глицерофосфолипиды
- Сфинголипиды
- Стеролы
- Пренолы
- Сахаролипиды
- Поликетиды
- Липопротеиды
- Литература
Дефиниция
Липиды идентифицируются как биологические субстанции, включающие в себя молекулы с широким спектром химических свойств, такие как жирные кислоты, фосфолипиды, стеролы, сфинголипиды, терпены и т.п., для которых характерны преимущественно гидрофобные качества и способность растворяться в органических растворителях (Smith A., 2000; Christie W.W., 2003). Важнейшей биологической ролью липидов является их участие в образовании клеточных мембран, внутриклеточных структур и органелл, а также в энергетическом метаболизме и синтезе ряда биологически активных соединений, таких как простагландины, стероидные гормоны, жирорастворимые витамины и некоторые коферменты (убихинон).
Современная классификация системы липидов
К настоящему времени создана и унифицирована современная классификация системы липидов, основанная на уникальных особенностях их строения и молекулярной структуры, а также их гидрофильных или гидрофобных свойствах. В соответствии с номенклатурой IUPAC-IUB (International Union of Pure and Applied Chemistry — International Union of Biochemistry) Commission on Biochemical Nomenclature выделяют восемь классов липидов, включающих жирные кислоты, глицеролипиды, глицерофосфолипиды, сфинголипиды, стеролы, пренолы, сахаролипиды и поликетиды (IUPAC-IUB Commission on Biochemical Nomenclature, 1977–2000). Химическая структура каждого из классов липидов представлена на рис. 1.1.

Рис. 1.1. Химическая структура основных классов липидов в соответствии с номенклатурой IUPAC-IUB Commission on Biochemical Nomenclature
Классы и подклассы липидов
Свободные жирные кислоты
Свободные жирные кислоты (СЖК) относятся к наиболее распространенным в организме человека классам липидов. Они имеют длинную неразветвленную цепь, состоящую из атомов углерода, и завершающуюся карбоксильным остатком (Caffrey M., Hogan J., 1992). Эти соединения обладают гидрофобными качествами благодаря наличию в составе молекулы СЖК повторяющейся серии из метиленовых групп. В зависимости от наличия или отсутствия в структуре СЖК двойных связей различают насыщенные (пальмитиновая, стеариновая и др.) и ненасыщенные (олеиновая, линолевая, линоленовая, арахидоновая) жирные кислоты соответственно (Small D.M., 1986).
Кроме того, существуют и другие классы СЖК: СЖК с прямой цепью (гексадеканоиды), метилсодержащие октадеканоиды, гидроксижирные кислоты, оксожирные кислоты (оксо-деканоиды), эпоксижирные кислоты (окстадеканоиды), метоксижирные кислоты, липокси-жирные кислоты (пентакоиды), гидропероксижирные кислоты, карбоциклические и гетероциклические производные, аминосодержащие жирные кислоты, нитрожирные кислоты (нитроокстадеканоиды), галогенированные и декарбоксилированные производные (Vance D.E., Vance J.E., 2002).
Ненасыщенные жирные кислоты, содержащие в структуре молекулы от 2 до 4 двойных связей, относят к незаменимым соединениям, поскольку в организме человека они не синтезируются и должны поступать с пищей, преимущественно с растительными маслами (Small D.M., 1986). Наиболее распространенные полиненасыщенные жирные кислоты (ПНЖК) — линолевая, линоленовая и арахидоновая, имеющие, соответственно, 2, 3 и 4 двойные связи. Биологическая роль полиненасыщенных жирных кислот в организме заключается в регуляции амфифильного состояния липидов клеточных мембран и в предотвращении депонирования холестерина (ХС) и других липидов в субинтиме стенки артерий. Кроме того, ПНЖК являются предшественниками простагландинов, лейкотриенов и других дериватов, а их w-3 производные принимают участие в метаболизме зрительных пигментов (Bazan N.G., 1989). СЖК с прямой цепью (гексадеканоиды) содержат терминальный карбоксильный остаток и часто являются конечным продуктом деградации поликетидов. Метилсодержащие октадеканоиды, а также циклические и гетероциклические СЖК широко представлены в природе (Ohlrogge J.B., 1997). Подклассы серосодержащих СЖК входят в состав биотина. Тиолы и их дериваты участвуют в синтезе и метаболизме полиненасыщенных жирных кислот. Многие подклассы СЖК, такие как гидроксижирные, оксожирные кислоты, а также окстадеканоиды являются прекурсорами критических этапов биологического синтеза ряда важнейших соединений, растительных эстрогенов, простагландинов и лейкотриенов (Murphy R.C., Smith W.L., 2002; Agrawal G.K. et al., 2004). Кроме того, многие эстерифицированные СЖК, такие как моно- и диэстерифицированные производные, а также лактоны, играют важную роль в обмене медиаторов, коэнзимов и карнитина. Липокси- и метоксижирные кислоты (пентакоиды), а также аминосодержащие СЖК занимают важное место в стабилизации клеточных мембран в организме человека и формировании устойчивости бактериальной стенки к антибиотикам (Roche D.M. et al., 2004). Химическая структура различных подклассов СЖК представлена на рис. 1.2.

Рис. 1.2. Химическая структура различных подклассов СЖК
Глицеролипиды
Несмотря на то что в структуре глицеролипидов и глицерофосфолипидов содержатся остатки молекулы глицерина, последние выделены в отдельную группу, поскольку часто выступают в роли биологических регуляторов синтеза триглицеридов (ТГ) в различных органах и тканях, а также в качестве сигнальных молекул. Среди глицеролипидов доминируют моно-, ди- и тризамещенные глицеролы, хорошо известные как ацилглицерины (так называемые нейтральные жиры) (Stam H. et al., 1987; Coleman R.A., Lee D.P., 2004). Другие подклассы представлены глицерогликанами, которые содержат один или несколько остатков гликолизированного глицерина (Pahlsson P. et al., 1998). Химическая структуры глицеролипидов представлена на рис. 1.3.

Рис. 1.3. Химическая структура глицеролипидов
Глицерофосфолипиды
Глицерофосфолипиды образуются в результате связывания одной из гидроксильных групп глицерина с фосфатной группой, а двух других — с СЖК (Ivanova P.T. et al., 2004). Этот класс липидов является ключевым компонентом желчных кислот, предшественником кардиолипина, внутриклеточных мессенджеров, сигнальных молекул, факторов свертывания крови, а также входит в состав биологических мембран и цитоскелета (Kennedy E.P., 1962; Cevc G., 1993; Forrester J.S. et al., 2004; Ivanova P.T. et al., 2004; Pereto J. et al., 2004). Большая часть глицерофосфолипидов представлена фосфатидилхолинами (лецитином) и фосфатидилэтаноламинами. Химическая структура глицерофосфолипидов представлена на рис. 1.4.

Рис. 1.4. Химическая структура глицерофосфолипидов
Сфинголипиды
Сфинголипиды — одно из наиболее широко представленных в природе семейств липидов, синтезирующихся de novo из серина и длинноцепочечного ацил-коэнзима А (ацил-КoA), а затем конвертирующегося в различные дериваты, такие как керамиды, фосфосфинголипиды, гликосфинголипиды и другие продукты (Taniguchi N. et al., 2002). Сфинголипиды входят в состав миелиновых оболочек и биологических мембран различных клеток, особенно эпидермальных. Химическая структура сфинголипидов представлена на рис. 1.5.

Рис. 1.5. Химическая структура сфинголипидов
Стеролы
Стеролы представляют собой производные восстановленных конденсированных циклических систем — циклопентанпергидрофенантренов. К числу производных C21-стеролов относятся прогестерон, кортикостерон, минералкортикоиды, к дериватам C18-стеролов — кортизол, тестостерон, андростерон, эстрогены, а также многие сигнальные молекулы. Кроме того, производными стеролов являются желчные кислоты, ХС, витамин D, таурин, глицин, глюкуроновая кислота и др. (Jones G. et al., 1998; Taniguchi N. et al., 2008). Стеролы входят в состав биологических мембран и цитоскелета вместе с глицеролипидами, лизофосфатидами, сфингомиелином (Merrill A.H. Jr., Sandhoff K., 2002; Bach D., Wachtel E., 2003; Russell D.W., 2003). Химическая структура стеролов представлена на рис. 1.6.

Рис. 1.6. Химическая структура стеролов
Пренолы
Пренолы синтезируются из пяти углеродных предшественников изопентилдифосфата и диметилалилдифосфата, которые являются промежуточными продуктами метаболизма мевалоната (Kuzuyama T., Seto H., 2003). Необходимо отметить, что дериватами пренолов являются многие жирорастворимые витамины, такие как витамин А, Е и К, а также природные антиоксиданты и коэнзимы (убихинон) (Porter J.W., Spurgeon S.L., 1981; Meganathan R., 2001; Ricciarelli R. et al., 2001; Demming-Adams B., Adams W.W., 2002). Полипренолы (долихолы) играют важную роль в обеспечении транспорта олигосахаридов через биологические мембраны, модулировании гликации белков и липидов, а также синтезе полисахаридов (Lazar K., Walker S., 2002; Raetz C.R.H., Whitfield C., 2002). Химическая структура пренолов представлена на рис. 1.7.

Рис. 1.7. Химическая структура пренолов
Сахаролипиды
В соответствии с современной номенклатурой термин «гликолипиды» заменен на «сахаролипиды», поскольку все восемь основных классов липидов имеют гликолипидные и фосфогликолипидные дериваты. Сахаролипиды входят в состав биологических мембран, а также являются компонентом бактериальной стенки грамотрицательных бактерий, обладающей чрезвычайно высокой иммунно- и анафилактогенностью (Spaink H.P., 2000; Lazar K., Walker S., 2002; Raetz C.R.H., Whitfield C., 2002). Химическая структура сахаролипидов представлена на рис. 1.8.

Рис. 1.8. Химическая структура сахаролипидов
Поликетиды
Поликетиды представлены ароматическими, макролидными и гибридными производными, основной биологической ролью которых является непосредственное участие в синтезе липидов различных классов (Walsh C.T., 2004). Структура поликетидов подвергается модификации в ходе реакций гликолизации, окисления, гидроксилирования и метилирования и некоторых других (Khosla C. et al., 1999). Сами поликетиды часто вовлекаются в процессы рибосомального протеинсинтеза. Кроме того, большинство эпитопов различных антибиотиков и антифунгицидов являются поликетидами или их дериватами. С другой стороны, многие поликетиды являются потенциальными токсинами (Moore B.S., Hartweck C., 2002; Reeves C.D., 2003). Химическая структура поликетидов представлена на рис. 1.9.

Рис. 1.9. Химическая структура поликетидов
Липопротеиды
Липопротеиды являются транспортными формами липидов, имеют глобулярную структуру в виде радиально расположенных вокруг молекул ТГ и ХС полярных молекул фосфолипидов, направленных гидрофильным полюсом центрально. Они состоят из апопротеина и липидного компонента. Основные свойства липопротеидов определяются преимущественно протеиновыми компонентами, тогда как их липидная часть обладает значительно меньшей специфичностью. Большинство клеточных рецепторов способны распознавать именно молекулу апопротеина, благодаря которой осуществляются кооперация, поглощение, деградация и клиренс липопротеида, а также обмен ХС и ТГ между липопротеидами различных классов.
Основные классы липопротеидов отличаются по своим физико-химическим свойствам: размеру частиц, их плотности и соотношению входящих в их состав апопротеина, ТГ, ХС и фосфолипидов (табл. 1.1).
В физиологических условиях у человека ХС и ТГ распределены в различных липопротеидах в определенных взаимоотношениях (рис. 1.10). Причем последние не являются «жесткими» и могут существенно модифицироваться при различных состояниях, таких как голодание, прием пищи, обогащенной экзогенными жирами, вегетарианском питании, после физических нагрузок высокой интенсивности и т.п.

Рис. 1.10. Удельное распределение ХС и ТГ в липопротеидах у здоровых лиц натощак ХМ — хиломикроны.
Основные апопротеины, входящие в состав липопротеидов, указаны в табл. 1.2. Так, хиломикроны и липопротеиды очень низкой плотности (ЛПОНП) состоят главным образом из ТГ и содержат апо-В48-, апо-С- и апо-Е-протеины. Они отличаются очень низкой плотностью и достаточно крупными размерами частиц (от 30–80 нм до 100–150 нм). Липопротеиды низкой плотности (ЛПНП) относятся к апо-В100-содержащим липопротеидам, имеют менее крупные частицы (20 нм) и обогащены ХС. Удельное содержание в них апо-В100-протеина не превышает 25%. Наиболее мелкими частицами являются липопротеиды высокой плотности (ЛПВП), состоящие преимущественно из апо-А-I-, апо-А-II- и апо-С-липопротеина, а также фосфолипидов. Апо-В-содержащие липопротеиды являются основной транспортной формой эндогенного ХС, обеспечивая его транспорт в клетки периферических тканей, и обладают потенциально атерогенными качествами, тогда как ЛПВП участвуют в процессах обратного транспорта ХС в гепатоциты и проявляют антиатерогенные качества (рис. 1.11). Более подробно о процессах эндогенного синтеза ХС и взаимоотношениях различных вне- и внутриклеточных липидных транспортных систем изложено в главе 2.
Кроме ТГ, ХС и фосфолипидов в плазме крови присутствуют так называемые неэстерифицированные жирные кислоты (НЭЖК), адсорбированные на альбумине, и хиломикроны, хотя период их полужизни чрезвычайно ограничен. НЭЖК освобождаются из липоцитов и транспортируются к различным органам и тканям. Хиломикроны являются основной транспортной формой экзогенных ТГ.
Таблица 1.1 Физико-химические характеристики липопротеидов
| Липопротеиды | Плотность, г/мл | Содержание липидов, % | ||
| ТГ | ХС | Фосфолипиды | ||
| ХМ | 0,95 | 80–95 | 2–7 | 3–9 |
| ЛПОНП | 0,95–1,006 | 55–80 | 5–15 | 10–20 |
| ЛППП | 1,006–1,019 | 20–50 | 20–40 | 15–25 |
| ЛПНП | 1,019–1,063 | 5–15 | 40–50 | 20–25 |
| ЛПВП | 1,063–1,21 | 5–10 | 15–25 | 20–30 |
В табл. 1 и 2: ХМ — хиломикроны, ЛПОНП — липопротеиды очень низкой плотности, ЛППП — липопротеиды промежуточной плотности, ЛПНП — липопротеиды низкой плотности, ЛПВП — липопротеиды высокой плотности.
Таблица 1.2 Основные апопротеины, входящие в состав липопротеидов
| Липопротеиды | Апопротеины |
| ХМ | Апо-В48, апо-С, апо-Е |
| ЛПОНП | Апо-В100, апо-С, апо-Е |
| ЛПНП | Апо-В100 |
| ЛППП | Апо-В100, апо-Е |
| ЛПВП | – |
| Субфракция 2 | Апо-А-I, апо-А-II, апо-С |
| Субфракция 3 | Апо-А-II, апо-А-I, апо-С |

Рис. 1.11. Потенциально про- и антиатерогенные липопротеиды
Таким образом, биологическая роль липидов в организме человека многообразна и не сводится только к выполнению пластической функции и участию в энергетическом метаболизме. Многие коферменты, энзимы, сигнальные молекулы и рецепторные субъединицы либо сами являются дериватами липидов, либо инкорпорируют последние в свою структуру. Если клинические значения для многих компонентов системы экзогенного и эндогенного путей метаболизма липидов уже установлены (общий ХС, хиломикроны, фракции липопротеидов, ТГ, НЭЖК, мицеллы, содержащие СЖК, субклассы СЖК, апопротеины, липопротеиды (a) — ЛП (a), фосфолипиды), то для регуляторных субъединиц, сигнальных молекул и многих других соединений такую роль еще придется документировать.
Жир — состав, свойства и роль в диете
” data-image-caption=”” data-medium-file=”https://unclinic.ru/wp-content/uploads/2020/08/zhir-sostav-svojstva-i-rol-v-diete-900×600.jpg” data-large-file=”https://unclinic.ru/wp-content/uploads/2020/08/zhir-sostav-svojstva-i-rol-v-diete.jpg” title=”Жир — состав, свойства и роль в диете”>
Алена Герасимова (Dalles) Разработчик сайта, редактор
- Запись опубликована: 19.08.2020
- Время чтения: 1 mins read
Жиры или липиды плохо растворимы в воде, но растворимы в органических растворителях. Термин «жир» чаще всего используется для обозначения пищи и липидного обмена. Около 90% жиров в пище — триглицериды. Другие типы жиров включают холестерин, фосфолипиды, стерины и каротиноиды
Жиры содержат три типа жирных кислот: насыщенные, мононенасыщенные и полиненасыщенные. Именно их соотношение определяет диетическую ценность.
Что такое липиды
Липиды — это различные классы соединений, таких как стероиды, жиры, сфинголипиды и т.п. Липиды включены в биологические мембраны и, следовательно, от них зависит проводимость мембраны, передача нервных импульсов и образование межклеточных связей.
Они образуют основные запасы энергии клеток. Также липиды — источник эндогенной воды. Они делятся на гидролизуемые и негидролизуемые. К последним относятся терпены и стероиды.
Классификация гидролизуемых липидов намного сложнее. Они делятся на:
- обычные , включающие триглицериды (сложные эфиры глицерина и жирных кислот);
- воски — сложные эфиры длинноцепочечных жирных кислот и длинноцепочечных одноатомных спиртов.
Классификация липидов
” data-medium-file=”https://unclinic.ru/wp-content/uploads/2020/08/klassifikacija-lipidov.jpg” data-large-file=”https://unclinic.ru/wp-content/uploads/2020/08/klassifikacija-lipidov.jpg” loading=”lazy” src=”https://unclinic.ru/wp-content/uploads/2020/08/klassifikacija-lipidov.jpg” alt=”Классификация липидов” width=”900″ height=”424″ srcset=”https://unclinic.ru/wp-content/uploads/2020/08/klassifikacija-lipidov.jpg 900w, https://unclinic.ru/wp-content/uploads/2020/08/klassifikacija-lipidov-768×362.jpg 768w” sizes=”(max-width: 900px) 100vw, 900px” title=”Жир — состав, свойства и роль в диете”> Классификация липидов
К сложным липидам относятся соединения, которые помимо жирных кислот и спирта содержат молекулы других веществ.
Функции жира в организме
Липиды являются концентрированными источниками энергии. В сутки при нормальном питании потребляется около 100 г липидов. Основные пищевые липиды — триглицериды. С пищей организму необходимо получать липиды животного и растительного происхождения — полиненасыщенные жирные кислоты.
- источник энергии – 1 грамм жира выделяет 9 ккал;
- источник незаменимых жирных кислот;
- переносчик жирорастворимых витаминов A, D, E и K;
- улучшитель вкуса и внешнего вида пищи.
Некоторые типы жиров важны для производства стероидных гормонов, интерлейкинов, тромбоксанов и простагландинов.
Холестерин необходим для производства желчных кислот, которые переваривают жиры.
Триглицериды
Триглецириды — это нейтральные жиры — сложные эфиры глицерина и жирных кислот. Это резервные жиры, которые являются основным источником эндогенной энергии. В жировой ткани триглицериды составляют 60-85% ее массы.
Триглицерид — это сложный эфир, состоящий из глицерина, связанного с тремя жирными кислотами, которые могут быть насыщенными или ненасыщенными. В организме человека преобладают насыщенные пальмитиновая и олеиновая (омега-9) кислоты.
” data-medium-file=”https://unclinic.ru/wp-content/uploads/2020/08/trigliceridy-800×600.jpg” data-large-file=”https://unclinic.ru/wp-content/uploads/2020/08/trigliceridy-800×600.jpg” loading=”lazy” src=”https://unclinic.ru/wp-content/uploads/2020/08/trigliceridy-800×600.jpg” alt=”Триглицериды” width=”800″ height=”600″ srcset=”https://unclinic.ru/wp-content/uploads/2020/08/trigliceridy-800×600.jpg 800w, https://unclinic.ru/wp-content/uploads/2020/08/trigliceridy-768×576.jpg 768w, https://unclinic.ru/wp-content/uploads/2020/08/trigliceridy.jpg 900w” sizes=”(max-width: 800px) 100vw, 800px” title=”Жир — состав, свойства и роль в диете”> Триглицериды
Триглицериды попадают с пищей или синтезируются в самом организме (печень, жировая ткань, слизистая тонкого кишечника, мышцы). Триглицериды, поступающие с пищей, гидролизуются в желудочно-кишечном тракте ферментом липазой. Скорость синтеза зависит от количества жирных кислот, полученных с пищей.
Триглицериды попадают в кровь в виде хиломикронов (липопротеин, несущий триглицериды). Произведенные жирные кислоты потребляются в тканях или повторно синтезируются из них, а триглицериды сохраняются.
Фосфолипиды
Состоят из двух групп соединений. Это глицерофосфолипиды (спирт-глицерин) и сфингомиелины (спиртовой сфингозин). Фосфолипиды имеют повышенную гидрофильную часть по сравнению с триглицеридами, состоящую из фосфатной группы и определенного аминоспирта, такого как холин. Из-за этой повышенной гидрофильной части фосфолипиды характеризуются полярностью и поэтому также называются полярными липидами.
Фосфолипиды являются основными липидами мембран. Их очень много в нервных клетках. Фосфолипиды образуют миелиновую оболочку нервных волокон и активно участвуют в энергетическом обмене.
” data-medium-file=”https://unclinic.ru/wp-content/uploads/2020/08/fosfolipidy-801×600.jpg” data-large-file=”https://unclinic.ru/wp-content/uploads/2020/08/fosfolipidy-801×600.jpg” loading=”lazy” src=”https://unclinic.ru/wp-content/uploads/2020/08/fosfolipidy-801×600.jpg” alt=”Фосфолипиды” width=”801″ height=”600″ srcset=”https://unclinic.ru/wp-content/uploads/2020/08/fosfolipidy-801×600.jpg 801w, https://unclinic.ru/wp-content/uploads/2020/08/fosfolipidy-768×575.jpg 768w, https://unclinic.ru/wp-content/uploads/2020/08/fosfolipidy.jpg 900w” sizes=”(max-width: 801px) 100vw, 801px” title=”Жир — состав, свойства и роль в диете”> Фосфолипиды
Жирные кислоты
- Насыщенные жирные кислоты . Они имеют высокую температуру плавления и поэтому сохраняют твердую консистенцию при комнатной температуре. Насыщенные жирные кислоты получают из животных источников. В растительных маслах (жирах) преобладают ненасыщенные жирные кислоты, за исключением кокосового и пальмового масел. Некоторые промышленные маргарины и спреды содержат много насыщенных жирных кислот.
- Мононенасыщенные жирные кислоты . Эти жирные кислоты находятся в жидкой форме при комнатной температуре. Оливковое и рапсовое масла — лучший источник мононенасыщенных жирных кислот.
- Полиненасыщенные жирные кислоты (PNRR) . PNRR находятся в жидкой форме при комнатной температуре. Они легко окисляются в пище и в организме. PNRR участвуют в процессе метаболизма холестерина и входят в состав фосфолипидов клеточных мембран. Кроме того, они являются предшественниками таких активных биологических веществ, как простагландины, интерлейкины, тромбоксаны, играющих решающую роль в формировании иммунного ответа, регулировании свертывания крови и уменьшении воспаления.
Полиненасыщенные RR делятся на:
- Омега-3 (альфа-линоленовые) – содержатся в льняном, тыквенном, грецком, рапсовом и соевом маслах и зеленых листовых овощах;
- Эйкозапантан, докозагексаен — содержатся в масле морских рыб, масле морских водорослей.
Линоленовые жиры, арахидон — их производные. Они присутствуют в молочном жире, особенно летом, потому что в организме животных они состоят из линолевой кислоты, полученной с кормом.
Более длинные цепи RR: арахидон (AA), докозагексаеновая кислота (DHR), эйкозапентаеновая кислота (EPR) не считаются незаменимыми, но при отсутствии RR омега-3 и омега-6 в пище их выработка в организме может достигать критических уровней. Прямое поступление АК, ЭПК и ДГК с пищей позволяет избежать метаболизма линолевой и альфа линоленовой кислоты.
DHR и EPR очень важны для неврологического развития плода и ребенка. Дефицит DHR связан с болезнью Альцгеймера, синдромом дефицита внимания, фенилкетонурией, муковисцидозом и другими заболеваниями. Растительный α-линоленовый RR омега-3 может быть преобразован ферментами в физиологически важные EPR и DHR или соединения класса гормоноподобных эйкозаноидов.
Жирные кислоты омега-3 активно участвуют в клеточном метаболизме, в регуляции холестерина в организме человека: они снижают количество холестерина липопротеидов низкой плотности (так называемый плохой холестерин) в организме, а также вероятность сердечных заболеваний. Они также очень важны для функционирования клеток мозга, нейронных синапсов, сетчатки глаза, а также для выработки половых гормонов.
Метаболизм жирных кислот
Метаболизм жирных кислот
” data-medium-file=”https://unclinic.ru/wp-content/uploads/2020/08/metabolizm-zhirnyh-kislot-800×600.jpg” data-large-file=”https://unclinic.ru/wp-content/uploads/2020/08/metabolizm-zhirnyh-kislot-800×600.jpg” loading=”lazy” src=”https://unclinic.ru/wp-content/uploads/2020/08/metabolizm-zhirnyh-kislot-800×600.jpg” alt=”Метаболизм жирных кислот” width=”800″ height=”600″ srcset=”https://unclinic.ru/wp-content/uploads/2020/08/metabolizm-zhirnyh-kislot-800×600.jpg 800w, https://unclinic.ru/wp-content/uploads/2020/08/metabolizm-zhirnyh-kislot-768×576.jpg 768w, https://unclinic.ru/wp-content/uploads/2020/08/metabolizm-zhirnyh-kislot.jpg 900w” sizes=”(max-width: 800px) 100vw, 800px” title=”Жир — состав, свойства и роль в диете”> Метаболизм жирных кислот
Оптимальное соотношение жирных кислот омега-6 к омега-3 составляет 5:1. В современном рационе это соотношение превышает 15 раз и более. Неправильное соотношение Омега-3 и Омега-6 опасно для здоровья.
Трансизомерные кислоты
Трансизомерные кислоты в небольших количествах содержатся в натуральных жирах, в желудках коров и овец, баранине, говядине, молоке и сыре. Важнейшим источником транс-изомерных кислот являются гидрогенизированные спреды PNRR, маргарины.
Маргарин – источник транс-изомерных кислот
Маргарин – источник транс-изомерных кислот
” data-medium-file=”https://unclinic.ru/wp-content/uploads/2020/08/margarin-istochnik-trans-izomernyh-kislot-900×600.jpg” data-large-file=”https://unclinic.ru/wp-content/uploads/2020/08/margarin-istochnik-trans-izomernyh-kislot.jpg” loading=”lazy” src=”https://unclinic.ru/wp-content/uploads/2020/08/margarin-istochnik-trans-izomernyh-kislot-900×600.jpg” alt=”Маргарин – источник транс-изомерных кислот” width=”900″ height=”600″ srcset=”https://unclinic.ru/wp-content/uploads/2020/08/margarin-istochnik-trans-izomernyh-kislot.jpg 900w, https://unclinic.ru/wp-content/uploads/2020/08/margarin-istochnik-trans-izomernyh-kislot-768×512.jpg 768w” sizes=”(max-width: 900px) 100vw, 900px” title=”Жир — состав, свойства и роль в диете”> Маргарин – источник транс-изомерных кислот
В процессе нагревания растительного масла ненасыщенные кислоты становятся насыщенными, а жидкие жиры становятся твердыми. Гидратированные диетические жиры имеют ряд преимуществ. Они дешевле, портятся медленнее, чем животные жиры, более устойчивы к окислению и высоким температурам.
Транс-изомерные кислоты, образующиеся во время гидрогенизации, связаны с увеличением холестерина ЛПНП и снижением холестерина ЛПВП, что увеличивает риск сердечно-сосудистых заболеваний, ожирения, диабета, а высокие уровни которых могут быть канцерогенными.
Стерины
Производные стероидов — это стероидные спирты, состоящие из четырех конденсированных колец атомов углерода, которые отличаются друг от друга функциональными группами (например, тестостерон, холестерин). Содержится в растениях, мясе и вырабатывается в организме.
В организме человека могут содержаться свободные стерины или сложные эфиры (стериды), образованные с жирными кислотами. Существует множество стеринов и стероидов, включая желчные кислоты, половые гормоны и гормоны коры надпочечников, витамины группы D, сердечные гликозиды, растительные фитостерины и некоторые алкалоиды.
В растениях есть стерины (эргостерин, стигмастерин и т. д.), но эти стерины не очень хорошо усваиваются организмом и, как считается, блокируют всасывание холестерина.
Самый распространенный стерол — это воскоподобный холестерин, который содержится только в продуктах животного происхождения. Фитостерины содержатся в растительной пище.
Холестерин является предшественником желчных кислот, стероидных гормонов и витамина D и представляет собой пергидрофенантреновое производное циклопентана. Это циклический ненасыщенный одноатомный спирт, имеющий полярную гидроксигруппу. Из холестерина в организме синтезируются другие стероиды: гормоны надпочечников, кортикостероиды, половые гормоны, желчные кислоты. Он синтезируется во многих клетках организма, но наиболее интенсивно в эндоплазматическом ретикулуме и цитоплазме эпителиальных клеток печени и кишечника. Холестерин синтезируется из ацетил-КоА. Выводится из организма с желчью или в виде солей желчных кислот.
Пищевой холестерин слабо влияет на уровень холестерина в плазме крови, поскольку большая его часть имеет эндогенное происхождение. Однако уменьшение количества насыщенных жиров в пище также резко снижает уровень холестерина в крови.
Животные и растительные жиры в диете
Животные жиры содержат много насыщенных жирных кислот. Они повышают уровень холестерина в крови и, следовательно, способствуют развитию атеросклероза, сердечно-сосудистых заболеваний и рака. Чрезмерное потребление насыщенных жирных кислот может привести к раку легких, кишечника, прямой кишки, груди и простаты.
Единственное исключение составляет один вид животного жира — жир морской рыбы , такой как скумбрия, сельдь, лосось, треска. Рекомендуется есть их как можно чаще из-за наличия полиненасыщенных жирных кислот омега-3.
Жиры в морской рыбе
Жиры в морской рыбе
” data-medium-file=”https://unclinic.ru/wp-content/uploads/2020/08/zhiry-v-morskoj-rybe.jpg” data-large-file=”https://unclinic.ru/wp-content/uploads/2020/08/zhiry-v-morskoj-rybe.jpg” loading=”lazy” src=”https://unclinic.ru/wp-content/uploads/2020/08/zhiry-v-morskoj-rybe.jpg” alt=”Жиры в морской рыбе” width=”900″ height=”553″ srcset=”https://unclinic.ru/wp-content/uploads/2020/08/zhiry-v-morskoj-rybe.jpg 900w, https://unclinic.ru/wp-content/uploads/2020/08/zhiry-v-morskoj-rybe-768×472.jpg 768w” sizes=”(max-width: 900px) 100vw, 900px” title=”Жир — состав, свойства и роль в диете”> Жиры в морской рыбе
Пищевая ценность масла определяется соотношением содержащихся в нем жирных кислот и количества жирорастворимых витаминов. В растительных маслах ненасыщенные жирные кислоты, то есть олеиновая, линолевая и α-линоленовая кислоты, составляют значительную часть всех жирных кислот. Особенно важны группы PNRR омега-6 и омега-3.
- Считается, что дефицит производных омега-6 RR может быть одним из факторов риска, связанных с развитием рака.
- Омега-3 PNRR снижает агрегацию тромбоцитов, а также риск образования тромбов, влияет на электрическую активность сердечной мышцы, тормозит возникновение аритмий. Они снижают уровень триглицеридов в крови, а также частоту ишемической болезни сердца.
Соотношение RR омега-6 и омега-3 в пищевых продуктах, рекомендованных Всемирной организацией здравоохранения (ВОЗ), должно составлять от 1:1 до 5:1. В последние десятилетия стала очевидной искаженная тенденция в этой рекомендации: растет потребление масел с высоким содержанием омега-6 и слишком низким содержанием омега-3 RR. Например, подсолнечное масло.
Соотношение этих кислот в различных продуктах питания колеблется от 10:1 до 20:1. Превышение омега-6 снижает уровень холестерина ЛПВП и увеличивает холестерин ЛПНП. Арахидон, производимый из кислот омега-6 и его метаболиты вызывают сужение сосудов и агрегацию тромбоцитов.
Более насыщенных транс-изомерных кислот, образующихся при гидрогенизации растительных масел, то есть при их затвердевании, увеличивают риск дислипидемии, CD типа II, а также попадания канцерогенов в клетки.
Качество растительного масла определяется его химическим составом, способом экстракции, технологией рафинирования и сохраняемыми при нем естественными физиологически активными веществами. Рекомендуется употреблять не менее 2-3 столовых ложек ненагретого масла в день с различными блюдами или салатами.
ФМБА РОССИИ
Межрегиональное управление №1 ФМБА России г. Москва
Выберите территориальное управление ФМБА России



- Новости
- Мероприятия
Роль жиров в питании человека
Известно, что несбалансированное употребление жира становится причиной ряда серьезных заболеваний. И поэтому – думаем мы – стоит убрать из рациона жиры, как решатся все проблемы. Однако исключение или резкое ограничение поступления жиров с пищей в организм – может нанести еще больший вред здоровью человека.
Дело в том, что жиры являются одним из важнейших пищевых веществ, необходимых для нормального функционирования организма человека . Они:
– служат важнейшим источником энергии. Один грамм жиров, окисляясь в организме, дает более 9 ккал (для сравнения: один грамм углевода – около 4 ккал);
– входят в состав клеточных мембран и внутриклеточных образований;
– необходимы для хорошей мозговой деятельности, концентрации внимания, памяти;
– предохраняют кожу от пересыхания, создавая липидный барьер;
– поставляют в ткани биологически активные вещества: фосфатиды (фосфолипиды), жирорастворимые витамины (A, D, E и K), в результате чего делают организм более устойчивым к инфекционным заболеваниям;
– являются единственным источником важнейших жирных кислот;
– способствуют выработке желчи;
– служат для выработки гормонов и простагландинов;
– помогают более эффективно использовать белки и углеводы.
Пищевые жиры бывают животного и растительного происхождения. Источники животных жиров: свиное сало (90–92 % жира), сливочное масло (72–82 %), жирная свинина (49 %), колбасы (20–40 %), сметана (до 30 %), сыры (15–30 %). Источники растительных жиров: растительные масла (99,9 % жира), орехи (53–65 %), овсяная (6,1 %), гречневая (3,3 %) крупы.
Кроме того, жиры условно подразделяются на два основных класса: насыщенные и ненасыщенные, так как любой жир представляет собой смесь насыщенных и ненасыщенных жирных кислот.
Насыщенные жирные кислоты – это жиры животного происхождения. Они отличаются от других жиров тем, что остаются твердыми даже при комнатной температуре. Насыщенные жиры нужны для энергии, они участвуют в строении клеток. Именно поэтому их избыток приводит к накоплению лишнего веса, а также к повышению уровня холестерина в организме, к заболеваниям сердца. Важно то, что насыщенные жирные кислоты, организм сможет синтезировать самостоятельно из другой пищи, поэтому такие жиры необходимы организму в небольших количествах.
Ненасыщенные жирные кислоты – э то в основном жиры растительного происхождения. Они не застывают даже в холодильнике. Они защищают сосуды и сердце, выводят «плохой» холестерин, благотворно влияют на состояние кожи. Самые известные ингредиенты ненасыщенных жиров – это Омега-3 и Омега-6 полиненасыщенные жирные кислоты. Практически всю ту пользу, которую приносят жиры организму, можно записать в актив ненасыщенным жирным кислотам. Что очень важно: ненасыщенные жирные кислоты не синтезируются организмом, и продукты, содержащие их, должны обязательно присутствовать в рационе человека.
В составе продуктов может встретиться еще один вид жира – гидрогенизированный (саломасла) . Он используется в качестве заменителя дорогого молочного жира. Это вещество искусственного происхождения, получают которое в основном из дешевых растительных масел. Но, в результате реакции гидрогенизации при получении саломасов, могут образовываться побочные продукты, превращаясь в опасные соединения – трансжиры . Этот вид жиров считается самым вредным, он совершенно не нужен организму. Употребление трансжиров ведет к нарушению обмена веществ и накоплению токсинов: трансжиры имеют способность замещать липиды, которые входят в состав мембраны клетки, нарушая ее структуру. Пораженная клетка утрачивает способность полноценно питаться и выводить вредные вещества.
Практически все продукты рациона человека, за исключением сахара, меда, соков, алкоголя, содержат жиры.
Наибольшие количества жиров – более 40 г на 100 г продукта – содержат масла, маргарины, сало, свиной шпик, орехи, семечки, жирная свинина, мясо утки, рыбий жир, печень трески, сырокопченые колбасы, майонез, белый шоколад.
Среднее количество жиров – 20-40 г на 100 г продукта –содержат сливки, жирная сметана, домашний творог, некоторые виды сыров, свинина, жирная говядина, жирные виды рыбы, мясо гуся, колбасы, сосиски, шпроты, шоколад, торты, сладости, халва, кокосовые орехи.
Малое количество жиров – менее 20 г на 100 г продукта – содержат большинство молочных продуктов, нежирные сыры, хлеб и хлебобулочные изделия, крупы, злаки, авокадо, бобовые, курятина, субпродукты, яйца, большинство рыб, морепродукты, грибы.
Исходя из выше изложенного, становится понятно, что жиры совершенно необходимы в здоровом питании, их роль огромна.
Физиологическое значение жиров в питании
Жиры и жировые продукты – одни из важных незаменимых компонентов питания, энергетических и пластический материал, источник незаменимых полиненасыщенных кислот, жирорастворимых витаминов и других биологически активных соединений.
Жиры в организме играют роль резервного энергетического материала, используемого при ухудшении питания или заболеваниях. Количество жира в организме человека различно и связано с физиологическими особенностями. Даже при нормальной массе тела запасы жира составляют 7-9 кг и могут обеспечить энергетические потребности человека при полном голодании почти в течение одного месяца. Жиры входят в состав клеточных оболочек, в нервной ткани содержится до 25% жиров, в клеточных мембранах – до 40%. Жиры являются источником синтеза гормонов, простагландинов, тромбоксанов и лейкотриенов, выполняют транспортную функцию, переносят жирорастворимые витамины, участвуют в процессах терморегуляции, защищая организм от переохлаждения, способствуют поддержанию внутренних органов в определенном положении.
Длительное ограничение жиров в питании приводит к нарушению обмена веществ, нарушается деятельность центральной нервной системы, снижается иммунитет, а, следовательно, и устойчивость организма к инфекционным заболеваниям.
При избытке жиров в рационе питания возникает расстройство обменных процессов, сопровождающееся повышенным выделением солей кальция и магния, отложение жира в организме, что приводит к ожирению. В результате перекисного окисления липидов образуется много свободных радикалов, которые, по оценкам ученых, оказывают канцерогенное действие на организм человека.
Важная роль в поддержании здоровья человека отводится полиненасыщенным жирным кислотам, которые в организме не синтезируются и относятся к незаменимым жирным кислотам. К ним относятся линолевая и линоленовая жирные кислоты, более известные как омега-3 и омега-6 кислоты. Они называются полиненасыщенными, потому что в их молекулярной структуре присутствует много двойных связей. Организм человека не имеет ферментов для их производства и, следовательно, они должны поступать с пищей. У млекопитающих, включая человека, сетчатка глаза, кора головного мозга, семенники, сперматозоиды богаты омега-3 жирными кислотами.
Если поступление омега-3 и омега-6 недостаточно, то в организме развивается их дефицит и начинается развитие всевозможных патологий (болезней). Они не просто используются организмом человека для хранения и получения энергии, но и играют важнейшую роль в таких процессах в человеческом организме, как воспаление и свертывание крови. Воспалительные процессы помогают организму защищаться от различных инфекций и травм, но могут привести и к серьезному повреждению органов и систем организма (болезням), когда воспалительный ответ слишком силен. Омега-3 и омега-6 кислоты содействуют регулированию обмена веществ в клетках, нормализации кровяного давления, агрегации тромбоцитов, участвуют в обмене витаминов группы В, участвуют в регуляции гормонов, влияют на транспорт ионов через мембраны клеток, контролируют передачу нервного импульса, стимулируют защитные механизмы организма, повышают устойчивость к инфекционным заболеваниям. Недостаток этих кислот приводит к прекращению роста организма, некротическим поражениям кожи, нарушению функции почек, ухудшению усвоения пищи. С их дефицитом также связывают образование злокачественных опухолей.
Симптомы дефицита омега кислот
Так, симптомами недостаточного потребления являются:
- повышенное артериальное давление
- частые инфекционные и воспалительные болезни
- сухость кожных покровов
- отеки
- ухудшение памяти, внимания, способности концентрироваться
- затруднение координации движений
- нарушение зрения
- отставание в росте у детей
Могут развиваться тяжелые заболевания:
- артериальная гипертензия
- сахарный диабет
- дерматиты
- бронхиальная астма
- тромбозы
- артриты
- остеопороз
- иммунодефицитное состояние
- повышается риск развития сердечно-сосудистых заболеваний
- повышается риск развития аутоиммунных заболеваний
Продукты, богатые омега-3 и омега-6 жирными кислотами, содержание в 100 граммах:
Из липидов — в дирижеры клеточных реакций, или Как общаются клетки
- 671
- 0,0
- 0
- 3
Снимок конфокальной микроскопии эмбриональных фибробластов мыши, обработанных индуктором ферроптоза RSL3 (100 nM, 6h)
Авторы
 Наиля Урмантаева
Наиля УрмантаеваЕкатерина Спиридонова
Шакир Сулейманов
Редакторы
 Анастасия Волчок
Анастасия Волчок Андрей Панов
Андрей Панов
- «Био/мол/текст»-2020/2021
- Апоптоз
- Биология
- Биомолекулы
- Цитология
Статья на конкурс «Био/Мол/Текст»: Задумывались ли вы когда-нибудь о том, что клетки общаются между собой? Ведь клеточный мир настолько многообразен и велик, что в нем без языка не обойтись! Всем известные гормоны — только один из диалектов такого «языка»! В этой статье мы расскажем о том, как липиды помогают клеткам «общаться». Почему такой, казалось бы, простой химический процесс, как окисление липидов, может приводить к гибели клетки? Как клетки понимают, когда пора заканчивать фазу воспаления и переходить к восстановлению? Что такое ферроптоз. Вы все еще читаете аннотацию? Давайте скорее окунемся в удивительный мир редокс-липидомики и взглянем на липиды по-новому!

Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Давно известно, что без липидов человеческий организм не может существовать. Эта обширная группа природных органических соединений, включающая жиры и жироподобные вещества, необходима для построения клеточных мембран и регуляции обмена веществ. Изучением липидов занимается липидомика, а появление раздела «редокс-липидомика» (окислительно-восстановительная липидомика, часть липидомики, занимающаяся характеристикой окисленных липидов) позволило по-новому взглянуть на роль продуктов окисления липидов и оценить их влияние на ключевые процессы, происходящие в клетках.
О липидах в составе клеточных мембран читайте в статье «Липидный фундамент жизни» [1]. — Ред.
В дополнение к природному липидому (совокупности всех липидов организма), существуют виды липидов, полученные в результате ферментативных и неферментативных модификаций (эпилипидом), что делает общую картину еще более сложной, поскольку их функции все еще в значительной степени неизвестны. Окисленные липиды представляют собой фракцию эпилипидома, которая привлекла большое внимание ученых из-за их роли в возникновении и развитии многих заболеваний человека. Однако основной проблемой редокс-липидомики остается отсутствие оптимальных вычислительных инструментов для надежной, точной и специфической идентификации уже открытых и еще неизвестных модифицированных липидов. В настоящее время жидкостная хроматография и масс-спектрометрия являются основными методами, позволяющими определить количество липидов в клетке, оценить их участие в ряде физиологических механизмов и даже изучить структуру продуктов окисления этих веществ [2].
Знакомство с липидами
Молекулы липидов чрезвычайно разнообразны, их насчитывают более миллиона вариантов [3]! Впечатляющее количество, по сравнению с 70 000 выявленных белков и 30 000 генов! Для удобства химики разделили все липиды на две большие группы:
- омыляемые, которые легко гидролизуются в воде под действием щелочей;
- неомыляемые, которые не гидролизуются в щелочной среде.
К первой группе относятся простые липиды, состоящие исключительно из спирта и жирных кислот (воски, триацилглицеролы, эфиры холестерола), и сложные липиды, в состав которых входят и другие компоненты (фосфолипиды, гликолипиды, сфинголипиды). К неомыляемым липидам относится большая группа стероидов, включающая холестерин и его производные: стероидные гормоны, витамины, желчные кислоты.
Большая роль маленьких молекул
Липиды, содержащие полиненасыщенные жирные кислоты (ПНЖК — кислоты, содержащие две и более двойных связей), являются важными сигнальными молекулами, регулирующими многие метаболические процессы и клеточные реакции, включая воспаление. Для выполнения этих функций они подвергаются реакциям окисления, то есть присоединяют кислородсодержащие группы.
Окисление липидов происходит с помощью двух основных механизмов. Первый способ — неферментативное перекисное окисление. При этом липиды взаимодействуют с активными формами кислорода (АФК), в результате чего происходит накопление гидроперекисей липидов (LOOH) (рис. 1). В норме процессы перекисного окисления необходимы для поддержания структуры клеточных мембран, функционирования ионных каналов, рецепторов и ферментных систем. Их роль велика и в синтезе липидных медиаторов — биорегуляторов (простагландинов, тромбоксанов, лейкотриенов и др.). Однако неконтролируемое свободнорадикальное окисление липидов может приводить к изменению проницаемости мембраны, нарушению ее целостности, а это прямая угроза гибели клетки [3]!
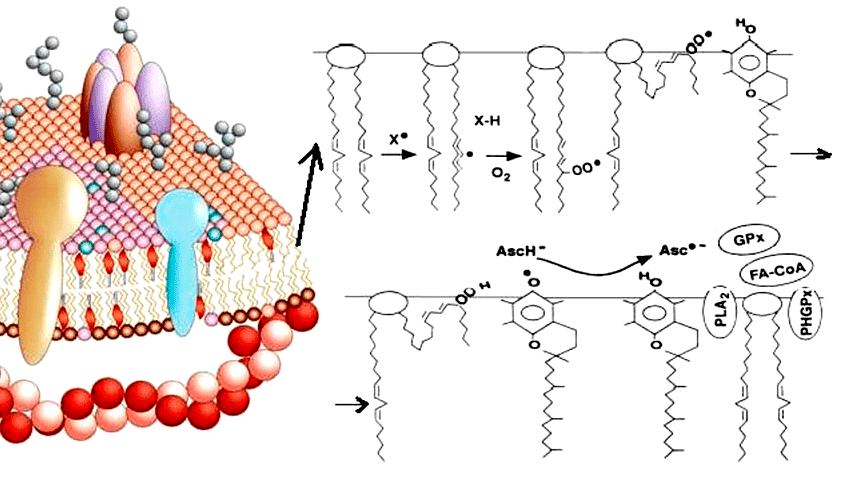
Рисунок 1. Зарождение цепной реакции перекисного окисления липидов. Фосфолипиды клеточных мембран, взаимодействуя со свободными радикалами, превращаются в гидроперекиси липидов, что может влиять на функции мембраны клетки.
Второй путь окисления — ферментативные изменения, отличающиеся высокой селективностью и специфичностью. Ферментативное окисление происходит под действием металлопротеинов: липоксигеназы, циклооксигеназы, цитохрома Р450, пероксидазы. Продукты реакций окисления ПНЖК, выступая в качестве сигнальных молекул, координируют метаболизм и другие физиологические процессы, иными словами, управляют судьбой клетки [4]! Такие вещества носят название эйкозаноидов. Они принимают участие во многих важнейших процессах: росте мышечной ткани, реакциях иммунитета на токсины и патогены, выступают в роли нейромедиаторов и даже гормонов!
К сожалению, человеческий организм не научился синтезировать все необходимые ПНЖК. Возникает вопрос: можно ли их получить извне? Разумеется! Пищевыми источниками полиненасыщенных жирных кислот являются растительные масла, рыбий жир и препараты омега-3-жирных кислот. Таким образом, казалось бы невкусный рыбий жир — просто лакомство для наших клеток!
Из липидов — в дирижеры клеточных реакций
Исследования редокс-липидомики, проведенные при помощи масс-спектрометрии в сочетании с обращенно-фазовой хроматографией, выявили удивительный факт: липиды контролируют активность иммунной системы [4]! При попадании в организм чужеродных агентов, желающих нанести вред и повредить ткани, развивается воспаление, цель которого — устранить патоген. Иммунные клетки, встав на защиту организма, в зоне повреждения вырабатывают «провоспалительные» производные ПНЖК (лейкотриены, липоксины, гипоксины и т.д.), которые усиливают воспаление и таким образом избавляют организм от патогена (рис. 2).

Рисунок 2. Провоспалительные производные арахидоновой кислоты: простагландины, тромбоксаны и лейкотриены
рисунок авторов статьи
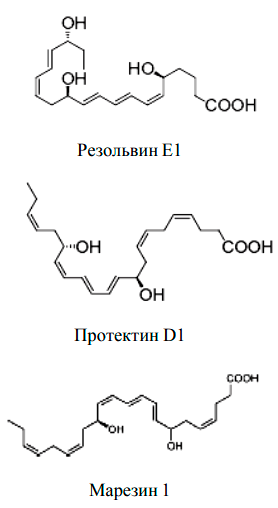
Рисунок 3. Противовоспалительные медиаторы: резолвины, протектины, марезины
Но воспаление — патологический процесс, и при удалении повреждающего фактора важно вовремя остановиться и прекратить воспалительный ответ. Здесь на помощь приходят противовоспалительные липидные медиаторы — резолвины, протектины, марезины (рис.3). Они останавливают образование «провоспалительных» медиаторов и обеспечивают защиту клеток от повреждающих факторов.
Кроме того, собственные поврежденные клетки, не способные восстановиться, для перехода воспаления в завершающую фазу и сохранения постоянства внутренней среды должны подвергнуться уничтожению, чему также способствуют липидные медиаторы. Как это возможно? Оказалось, что липидные молекулы фосфатидилсерина (фосфолипида клеточной мембраны) выставляются на мембрану поврежденных клеток и «помечают» их. Фосфатидилсерин на поверхности клеток является сигналом для их поглощения макрофагами и клетками микроглии [5]. В исследованиях также была продемонстрирована значимость этого медиатора: наличие даже одной молекулы фосфатидилсерина уже достаточно для активации фагоцитоза!
Две стороны одной медали
Оказалось, что роль липидов велика не только в уничтожении старых или поврежденных клеток, но и их компонентов, или органелл. Например, для удаления митохондрий, безвозвратно утративших свои функции, на поверхности ее внешней мембраны появляется кардиолипин — фосфолипид, который в норме присутствует только на внутренней мембране органелл. Именно он и служит сигналом митофагии, или уничтожения митохондрий [5]. Удаление исключительно ненужных организму структур без повреждения нормальных клеток требует точной передачи сигналов и имеет решающее значение для поддержания постоянства внутренней среды.
Однако данный процесс может стать опасным для организма. Чрезмерная митофагия описана при многих острых и хронических заболеваниях центральной нервной системы. Так, при болезни Паркинсона она может привести к гибели нейронов [6]. Контроль качества митохондрий с целью избежания излишнего уничтожения имеет центральное значение для функционирования и благополучия нейронов. Это открывает новые возможности для исследований в области лечения нейродегенеративных заболеваний!
Как липиды «помогают» клетке погибнуть?
Что же делать со старыми клетками, честно отслужившими свой срок? Безусловно, оставлять их на своем месте нельзя, иначе новым здоровым клеткам будет некуда деться. Остается один вариант — аккуратно разобрать и удалить из организма те из них, которые не способны более функционировать. Данный процесс носит названия апоптоза. Валериан Каган и его соавторы доказали, что для осуществления этого процесса необходимо окислить ПНЖК кардиолипина [7]. При необратимых изменениях в клетке знакомый нам кардиолипин образует комплекс с белком дыхательной цепи — цитохромом c — и превращает его в фермент пероксидазу. Пероксидаза тотчас окисляет ПНЖК кардиолипина, и он перемещается на внешнюю мембрану митохондрий, увеличивая ее проницаемость (рис.4). Это приводит к высвобождению других проапоптотических факторов клетки, действие которых приводит к клеточной гибели.

Рисунок 4. Окисление кардиолипина как фактор апоптоза. На рисунке представлена клеточная мембрана, состоящая из бислоя липидов, один из которых — кардиолипин (показан желтым цветом). При взаимодействии с белком цитохромом c (cyt c) кардиолипин превращает его в пероксидазу, которая, в свою очередь, окисляет ПНЖК кардиолипина (на рисунке — cardiolipin hydroperoxide, CL-OOH). Гидроперекись кардиолипина выходит на внешнюю мембрану митохондрии, изменяя ее проницаемость, что приводит к апоптозу.
Новый взгляд на клеточную смерть
Одним из важнейших достижений редокс-липидомики является открытие уникального варианта неапоптотической программируемой гибели клетки — ферроптоза [8]. По сравнению с другими формами этот путь клеточной гибели неповторим. В чем же его особенность? Оказалось, что, в отличие от апоптоза, при котором происходит аккуратная разборка клетки, ферроптоз приводит к клеточному коллапсу, в котором железо и АФК принимают активное участие. Давайте разберемся, как это происходит!
Ферроптоз назван так неспроста. Железо (Fe от лат. ferrum) — основной элемент, необходимый для осуществления ключевого звена данного пути гибели клетки: перекисного окисления липидов (рис. 5) [9], [10]. Перекисное окисление может происходить под действием свободного двухвалентного железа (через реакцию Фентона), а также посредством фермента липоксигеназы, содержащей железо.
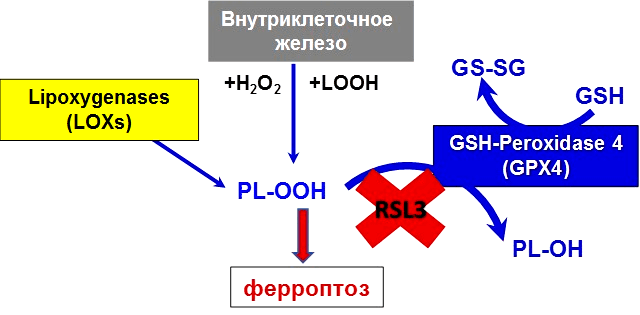
Рисунок 5. Ионы железа в организме находятся под строгим метаболическим контролем. Нарушение баланса ионов железа в клетке и возникновение окислительного стресса приводит к цепной реакции окисления липидов и формированию избытка гидроперекисей. Накопление гидроперекисей липидов приводит к развитию ферроптоза. Гидроперекиси фосфолипидов (PL-OOH) образуются внутри клетки с участием различных форм низкомолекулярного внутриклеточного железа и железосодержащих ферментов. Активная GPX4 восстанавливает гидроперекиси липидов до спиртов. В случае ингибирования фермента, например, специфическим ингибитором RSL3, PL-OOH накапливаются в клетках, усиливая развитие окислительного стресса.
Конкретные механизмы редокс-модификации липидов, задействованные в выполнении программы ферроптоза, на сегодняшний день остаются тайной. Но, окрасив клетку различными флуоресцентными красителями, можно увидеть, насколько удивительные очертания они приобретают при ферроптозе (рис. 6) [11]!
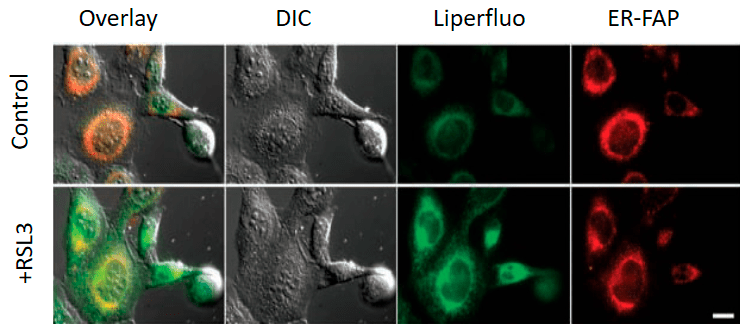
Рисунок 6. Снимок конфокальной микроскопии эмбриональных фибробластов мыши, обработанных индуктором ферроптоза RSL3 (100 nM, 6h). Control — необработанные клетки. Liperfluo — флуоресцентный зонд, который после взаимодействия с гидроперекисями липидов способен флуоресцировать, если он встроен в плазматическую мембрану клеток. ER-FAP (ER-targeted fluorogen-activating protein) — флуоресцентный белок, чья флуоресценция активируется при связывании метки с эндоплазматическим ретикулумом.
В клетках организма существуют механизмы, препятствующие неконтролируемому перекисному окислению. Одним из ключевых ферментов здесь является глутатионпероксидаза 4 (GPX4), которая восстанавливает гидроперекиси липидов до спиртов за счет окисления глутатиона (GSH). Далее окисленная молекула глутатиона (GS-SG) восстанавливается с помощью фермента глутатион-редуктазы. В случае инактивации клеточного глутатиона и GSH-зависимой антиоксидантной защиты происходит накопление токсичных липидных АФК и запуск ферроптоза [12].
Две крайности одной и той же сущности. Как ферроптоз реализуется в целом организме и можно ли обернуть его в свою пользу?
Проведенные исследования показывают, что ферроптоз осуществляется во многих типах тканей человека. Так, при отравлении парацетамолом в организме накапливается N-ацетил-p-бензохинонимин, при этом наблюдается истощение глутатиона, в результате чего происходит массивная гибель клетки по механизму ферроптоза [13].
Имеющиеся данные указывают на то, что ферроптоз может выступать одним из ключевых механизмов развития некоторых нейродегенеративных заболеваний, а также является одной из возможных причин гибели клеток в условиях глутаматной эксайтотоксичности [14].
Ионы железа могут играть ключевую роль в гибели эпителиальных клеток почечных канальцев в условиях острой почечной недостаточности [13]. Данный механизм обусловлен нарушением гломерулярной фильтрации и накоплением ионов железа как внутриклеточно, так и в полости канальца, что приводит к реализации клеточной смерти.
Ферроптоз, как механизм регулируемой клеточной смерти, имеет и терапевтическую ценность. Существует ряд потенциальных молекул, ингибирующих Xc – — транспортную систему (эрастин, RSL3), которые, воздействуя на культуру опухолевых клеток, вызывают их гибель по механизму ферроптоза [12], [13]. Как доказать, что это происходит благодаря ферроптозу, а не случайному совпадению? При добавлении к клеткам веществ, связывающих железо, оно становится «неподвижным» и не может участвовать в химических процессах. В этом случае процессы ферроптоза значительно замедляются. Однако не все так просто и радужно! Эти молекулы не обладают высокой специфичностью, и при более высоких дозах клеточная гибель может происходить по механизму апоптоза!
Вывод
Благодаря редокс-липидомике стало известно, что кислородсодержащие липиды играют огромную роль в сохранении постоянства внутренней среды, запуская апоптоз, ферроптоз и контролируя воспаление. Однако стоит принять во внимание, что, несмотря на очевидное значение в регуляции множества биологических функций, содержание окисленных липидов в организме крайне мало (0,03–3,0 моль% от всего липидома организма) [4]. Кроме того, трудности анализа окисленных липидов заключаются в их химической нестабильности, термолабильности и неоднородности окисленных продуктов. Не зря их сравнивают с иголкой в стоге сена!
Биохимические процессы в организме
| Листать назад | Оглавление | Листать вперед |
Гуморальные механизмы регуляции в организме осуществляются с помощью химических веществ, которые образуются в процессе различных биохимических реакций.
Биохимические процессы в организме основываются на молекулярном строении вещества, атомы которого соединены разными связями. При этом атомы одних веществ несут на себе положительный заряд, другие – отрицательный. При определенных условиях, делающих возможным течение химических реакций, молекулы веществ обмениваются своими составляющими (атомами или ионами). В результате комбинации атомов и молекул образуются тысячи новых химических веществ. При этом может создаться впечатление, что вещества в клетке находятся в относительном покое. Однако молекулы веществ, подобно персонажам какого-нибудь светского бала, перемещаются в заданных направлениях, периодически обмениваясь между собой партнерами. При рассмотрении функционирования клетки и ее составляющих (мембраны, цитоплазмы, органелл, ядра), в том числе генетического аппарата с биохимической точки зрения все происходящие в них процессы сводятся к разрыву одних химических связей и образованию других. Это дает возможность клетке поддерживать свою жизнедеятельность получая энергию, необходимую для поддержания подсистемы жизнеобеспечения, и выполняя специфические функции. Биохимические процессы являются основой обмена веществ.
Питательные вещества, поступающие в клетку через один из ее функциональных входов, превращаются в вещества, необходимые для поддержания жизнедеятельности клетки и выполнения ею специфических функций. Остаточные продукты обмена выводятся через выходы системы (смотри рисунок 1.4.1 в разделе 1.4.1).
Конечной целью всех биохимических реакций, протекающих в организме, является выполнение двух основных функций. Первая из них – обеспечение постоянства внутренней среды (гомеостаза), непосредственное поддержание стабильности “подсистемы жизнеобеспечения”. Вторая – выполнение специальных функций, заключающихся в реагировании на определенные внешние воздействия (например, проведение нервного импульса нейроном, выработка гормона, перенос кислорода эритроцитом, сокращение мышечной клетки).
Обе эти задачи решаются с использованием механизма обратной связи, который описан в предыдущем разделе. Его суть состоит в том, что клетка помнит (часто на генетическом уровне) нормальное значение параметра и меняет значение текущего параметра до тех пор, пока оно не достигнет нормального. В этом смысле часто нельзя сказать, когда и где начался биохимический процесс. Можно назвать только параметр, который регулируется, и определить его нормальное значение. Как же реализуется обмен веществ?
Для того чтобы вещество поступило к клеткам, оно должно сначала попасть в кровь. Только после этого, преодолев ряд внутренних барьеров, оно сможет дойти до цели, связаться с клетками-мишенями, вызвать нужные изменения в функционировании тканей, органов и систем (что и является проявлением его биологического действия) и, наконец, подвергнувшись превращениям (биотрансформации), или в неизмененном виде покинуть организм. При этом, как правило, происходит выделение энергии, в некоторых случаях – ее поглощение.
Какими путями питательные вещества могут попадать в кровоток? Из желудочно-кишечного тракта питательные вещества проникают в кровь, которая переносит их по организму и доставляет в различные ткани органов и систем. Этот процесс обозначают термином всасывание (абсорбция). При поступлении белки, углеводы и липиды преобразуются в желудочно-кишечном тракте при участии активных ферментов, которые выделяются железами желудка, кишечника, поджелудочной железой и поступают с желчью. При всасывании вещества проходят через клеточные мембраны, играющие основную роль в процессах транспорта веществ. Именно их ионные каналы и поры (“ворота” клетки структурно отражают понятие функциональных входов и выходов, участвующих в выполнении основных задач клетки.
В дальнейшем из кровяного русла питательные вещества проникают в ткани, где подвергаются различным биохимическим процессам, в ходе которых превращаются в необходимые для клетки формы химических соединений. Графическое изображение процессов представлено на рисунке 1.4.8. Обратите внимание, что на схеме не показана энергетическая сторона обмена – высвобождение, запасание и использование энергии. Более подробно эти процессы будут рассмотрены в этом разделе несколько позже.

Рисунок 1.4.8. Течение биохимических процессов в клетки. Схема обмена веществ
Давайте по рисунку проследим последовательность этапов обмена веществ в клетке. Источниками материалов для обновления структур и энергообеспечения служат пищевые продукты, в составе которых организм получает углеводы, липиды, белки, некоторые биологически активные соединения (например, витамины) и минеральные вещества. Исходные соединения поступают в клетку не в готовом виде, а в виде “заготовок” из питательных веществ, которые она, по мере необходимости, перерабатывает для своих нужд и нужд организма. Изготовление “заготовок” происходит в процессе пищеварения, когда пища в желудочно-кишечном тракте подвергается расщеплению: белки – до аминокислот, углеводы – до моносахаридов (глюкозы и других соединений), жиры – до жирных кислот и моноглицеридов. Низкомолекулярные биологически активные и минеральные вещества всасываются во внутреннюю среду преимущественно без какой-либо предварительной химической трансформации. Химические соединения с током крови поступают к клеткам, где включаются в процессы синтеза (образование специфических белков, углеводов, липидов и регуляторных соединений для клетки) процессы окислительно-восстановительных реакций, в ходе которых высвобождается энергия химических связей. Следующий это этап, на котором питательные вещества подвергаются дальнейшему расщеплению и/или биотрансформации с целью получения в процессе биосинтеза собственных веществ. Основными реакциями, которые при этом протекают, являются окисление, восстановление, отщепление, гидролиз, синтез.
Полученные соединения либо сразу расходуются “на строительные, ремонтные и хозяйственные нужды” клетки, либо аккумулируются в ней для последующего использования. Запасаются главным образом высокоэнергетические соединения – жиры, глюкоза в виде полимера (гликогена), которые при расщеплении высвобождают большое количество энергии. Другие соединения, синтезированные “на экспорт” (гормоны, медиаторы и другие) выделяются (секретируются) за пределы клетки с целью коммуникации с соседними или отдаленно расположенными клетками.
Например, оптимальная концентрация белков в клетке обеспечивается их синтезом из имеющихся в клетке аминокислот “по мере необходимости”. Реакции биосинтеза белка “запускаются” по механизму обратной связи, о котором рассказывалось в предыдущем разделе. Это касается в первую очередь выработки гормонов, медиаторов и других сигнальных молекул. Синтез белка на нужды самой клетки регулируется иначе – без включения механизмов гуморальной и нервной регуляции. Вероятно, клетка каким-то образом ощущает нехватку определенного белка (например компонента клеточной мембраны), сравнивает с генетически запрограммированной должной величиной, и это становится пусковым моментом для его выработки. При рассмотрении механизмов биохимических процессов, протекающих в клетке, и их механизмов возникает много вопросов. Что заставляет клетку вырабатывать определенный белок? Как образуется такое многообразие белковых молекул? Давайте попробуем проследить на следующем примере.
Предположим, мы съели шоколадку. Не углубляясь в последствия этого опрометчивого шага, скажем, что после такой углеводной нагрузки клеткам срочно потребуется переработать углеводы. “Нужен инсулин!” – кричат клетки, и мозг посылает указание бета-клеткам поджелудочной железы: “Прошение удовлетворить. Выработать инсулин!” Дальше начинается самое интересное. Как клетки вырабатывают белок, в частности инсулин?
Белки, согласно определению, – это сложные высокомолекулярные вещества, состоящие из аминокислот, которые, в свою очередь, являются органическими кислотами, содержащими одну или более аминогрупп. Всего аминокислот 20 (представим их бусинами разных цветов), а белки – это бусы, собранные в нужном порядке. Сколько же число белковых молекул (бус) можно составить, при условии, что количество аминокислот (бусин) в одной белковой цепи может достигать нескольких сотен! Это определяет колоссальное разнообразие белков.
Основной процесс, который лежит в основе начала синтеза белка, довольно сложен и до сих пор не изучен. Ученые считают, что в ответ на воздействие внешнего фактора (в данном случае избыток углеводов) сигнал каким-то образом поступает к ядру клетки, который и является инициирующим и основополагающим в запуске синтеза белка. Считается, что синтез белка начинается в ядре клетки. ДНК – основной носитель генетической информации, и, как вы уже знаете, представляет собой двойную спираль, закрученную вокруг общей оси. Ген – это участок ДНК, содержащий программу построения только одного определенного белка, например выше упомянутого инсулина. Афористическая формула “Один ген – один белок” была открыта всего полвека назад. Чтобы “прочитать” информацию, касающуюся синтеза данного белка, надо расплести и разъединить нити ДНК на участке нужного гена (рисунок 1.4.9). Этим занимается определенный фермент (не будем перегружать вас запоминанием сложных названий и специфических терминов).

Рисунок 1.4.9. Транскрипция (первый этап биосинтеза белка)
Важно отметить, что считывание информации с ДНК или с РНК возможно только в одном направлении. Этот механизм позволяет предупредить ошибки считывания (помните – Оля и Яло из сказки “Королевство кривых зеркал”).
Итак, ген на матричной нити ДНК готов. За дело берется другой фермент (РНК-полимераза), и, как мозаику, достраивает РНК напротив гена. Помните принцип “ключ – замок”? Процесс переписывания информации с ДНК и одновременного достраивания РНК в биологии называется транскрипцией. Полученную РНК называют первичным (неактивным) транскриптатом. Процесс “созревания”, активации РНК проходит в ядре с участием ферментов, как ножницами вырезающим интроны (не несущие информации, “молчащие” участки РНК) и сшивающим оставшиеся “куски”. Биологическое значение интронов до сих пор не выяснено, и очередная Нобелевская премия ждет своего обладателя. После всех этих преобразований мы имеем готовую матричную, или информационную мРНК.
Надо заметить, что в одной клетке с одного гена можно переписывать последовательно несколько копий м-РНК, что позволяет, в конечном итоге, значительно увеличить объемы выработки нужного белка.
В цитоплазму мРНК выходит и начинается новый этап – непосредственно синтез белковой цепи, или трансляция. Как только мРНК оказалась в цитоплазме, ее “принимает” в свои “объятья” рибосома (вид Б на рисунке 1.3.9).
Напомним, что рибосома состоит из большой и малой субъединиц, между которыми имеется желобок, своеобразный канал, по которому и протягивается мРНК.
Информация, записанная в мРНК подвергается переводу в другую систему знаков – на “язык белков” (его “алфавит” – аминокислоты). Рибосома перемещается на один шаг (кодон) по цепи мРНК, в ее активном центре оказывается новый триплет (кодон), к которому подходит транспортная РНК, прикрепляется к рибосоме и передает цепочку из аминокислот, рибосома вновь делает шаг и так далее. Этот процесс проще изобразить, чем описать (смотри рисунок 1.4.10). Для повышения “производительности” процесса биосинтеза белка клетка образует полирибосомы (вид В на рисунке 1.3.9), представляющие собой несколько рибосом, последовательно считывающих информацию с мРНК.
Образовавшаяся белковая молекула не остается в клетке в виде нити бус (это всего лишь первичная структура), она компактно “упаковывается” благодаря химическим и физическим связям, возникающим между аминокислотами, по мере удлинения белковой цепи. Вторичная структура белка похожа на спираль, а третичная – на плотный шарик (глобулу). Так называемая четвертичная структура образуется при объединении нескольких белковых молекул между собой и/или с другими молекулами.
Пока вы вникали в материал предыдущего абзаца, в реальной клетке уже собрана значительная по размерам белковая цепь: синтез молекулы белка, состоящей из 100 аминокислот, занимает около 2 мин. Заканчивается сборка конкретной молекулы белка, когда в активный (“считывающий”) центр рибосомы попадает стоп-кодон мРНК, и белковая цепь обрывается (рисунок 1.3.9, вид В).
Описывая биохимические реакции, мы опустили одну важную деталь. Многие реакции могут протекать и без помощи катализатора, но это займет колоссальное время (с учетом времени жизни конкретной клетки). А реакции в клетке идут с такими скоростями, которые недостижимы, при проведении их в пробирке. Здесь работает еще одно изобретение природы – ферменты, о которых мы упоминали, говоря о химическом строении клетки.
Фермент – это катализатор, ускоряющий только одну химическую реакцию. Скорость протекания катализируемой ферментом реакции в организме увеличивается в сотни тысяч или миллионы раз (до 10 14 раз). Например, образование всего лишь одной водородной связи и сопряженное с этим изменение энергии активации может ускорить реакцию в 10 6 раз.
Название фермента чаще всего состоит из двух частей, отражающих субстрат и выполняемую им функцию. Например, сукцинатдегидрогеназа – это фермент, который от субстрата – соединения янтарной кислоты (сукцинат) – отнимает атом водорода (дегидроген). Липаза – фермент, расщепляющий жиры. Окончание “аза” говорит лишь о том, что данное слово обозначает фермент, который в 100% случаев является белком.
Часть веществ, которые образуются в клетке, являются “отходами” метаболизма, они с током крови транспортируются к печени и почкам, а затем выводятся из организма. Образующиеся продукты, как правило, лишены не только специфической активности, но и, что очень важно, – токсичности.
Напомним, что интенсивность протекания биохимических реакций в клетке варьирует на различных этапах жизненного цикла клетки (смотри рисунок 1.3.16). Во время деления клетки она минимальна, в период активного функционирования клетки процессы метаболизма и энергетического обмена протекают с максимальной скоростью. Таким образом, биохимические процессы, протекающие в организме, подчинены главному генетическому алгоритму – жизненному циклу и нацелены на выполнение основных задач.

 Наиля Урмантаева
Наиля Урмантаева Екатерина Спиридонова
Екатерина Спиридонова Анастасия Волчок
Анастасия Волчок Андрей Панов
Андрей Панов
