Типы дифференциальной диагностики инфаркта миокарда, проблемы постановки диагноза
Дифференциальный диагноз инфаркта миокарда проводится со следующими заболеваниями.
• Затянувшийся, тяжелый приступ Ст.
• Острый перикардит — острая боль в грудной клетке (может напоминать стенокардическую) усиливается на вдохе и лежа и несколько уменьшается в положении сидя или наклоне вперед. Боль держится несколько часов или дней (в этот период больной не ощущает ее облегчения). В случае наличия выпота в полость перикарда можно выслушать шум трения перикарда и глухие тоны сердца. Пульс может быть слабого наполнения или парадоксальный. Повышенное венозное давление указывает на возможную тампонаду сердца (что требует проведения перикардиоцентеза). Изменения ЭКГ могут напоминать таковые при ИМ. В целом для перикардита характерно повышение сегмента ST во многих отведениях (но это может быть и при ИМ). На перикардит могут указывать тахикардия, снижение вольтажа, укорочение интервала PQ, остроконечные или вогнутые, «седловидные» зубцы Т (тогда как при ИМ они выпуклые), отсутствие «зеркального» снижения интервала ST и изменения ЭКГ, которые не в полной мере соотносятся с клиническим статусом.
Рентгенография грудной клетки обычно не выявляет изменений или определяется «шаровидное» сердце. По данным ЭхоКГ функция сердца не нарушена или выявляется скопление жидкости в полости перикарда.
• Гипертрофическая кардиомиопатия (ГКМП) — в период ФН у больного может (в 30—50% случаев) отмечаться выраженная загрудинная боль (со всеми признаками ангинозной) вследствие роста П02 гипертрофированным миокардом, под действием повышения давления из-за сужения пути оттока из ЛЖ. В период ФН или после ее окончания (независимо от боли) могут отмечаться сердцебиение, общая слабость, обмороки и ВСС. Эти симптомы – результат дефицита возможностей повысить МОК вследствие сужения устья аорты и нарушения наполнения ЛЖ в диастолу. Заболевание имеет генетический характер. Характерный признак ГКМП – нарушение строения миофибрилл (этим можно объяснить частое появление аритмий). При выслушивании сердца (в проекции аортального клапана) определяется нарастающий и убывающий систолический шум, проводящийся на шею. В случае митральной недостаточности отмечается систолический шум над верхушкой. Размеры сердца увеличены, верхушечный толчок смещается влево. На ЭКГ определяются ГЛЖ, наличие зубцов Q в V4-6 или III, avF-отведениях (из-за гипертрофии межжелудочковой перегородки).
Последнее может ложно указать на имеющийся ИМ. Более информативна ЭхоКГ. позволяющая верифицировать ГКМП.
• Прободная язва желудка или двенадцатиперстной кишки, патология пищевода (ГЭРБ, нарушение моторики пищевода), которая может быть причиной боли (похожей на ишемическую) в грудной клетке (нередко эти нарушения комбинируются с ИБС, что затрудняет дифференциальную диагностику); острый холецистит (изредка сочетается с нижним ИМ; может усилить клинические симптомы и изменения ЭКГ, появляющиеся при ИМ), протекающий с болезненностью в правом подреберье, лихорадкой и лейкоцитозом; панкреатит и аппендицит.
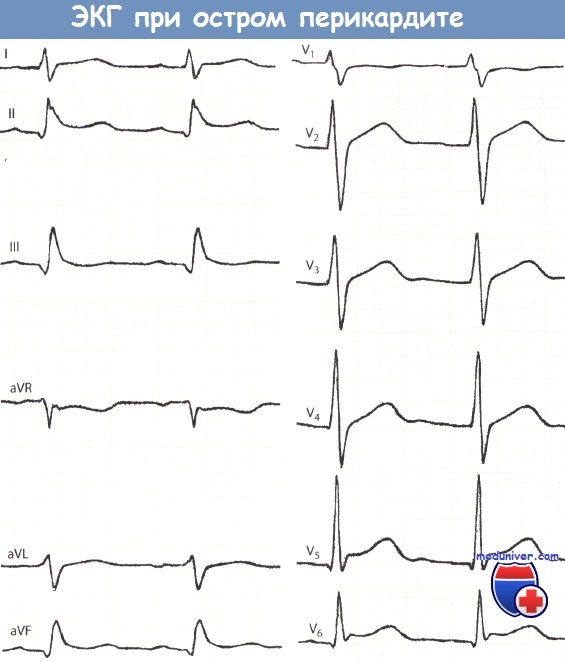 Острый перикардит.
Острый перикардит.
Больной 20 лет с жалобами на острую боль в груди, у которого выслушивался шум трения перикарда.
Синусовая тахикардия с частотой сокращений желудочков 100 в минуту. Незначительный подъем сегмента ST и положительный зубец Т в отведениях I, II и V2-V6, прежде всего в отведениях V5 и V6.
Характерны легкий подъем сегмента ST, отхождение его от восходящего колена зубца S и вогнутая форма.
• Пищевое отравление.
• Спонтанный пневмоторакс — идиопатический или чаще вызванный эмфиземой и ТВС легких. Появляются острая боль на стороне поражения (нередко сохраняющаяся часами), обморок, одышка, отставание пораженной части грудной клетки в акте дыхания, ослабление голосового дрожания, коробочный звук и ослабленное везикулярное дыхание. Рентгенография легких позволяет верифицировать данный диагноз.
• Расслаивающаяся аневризма аорты (встречающаяся чаще на 6-м десятилетии жизни) — драматичное событие с точки зрения высокой летальности. Так, в первые часы от начала болей умирает треть больных, в первый день — 15 больных в час и в первую неделю — более 70% пациентов. Болеют чаще мужчины с АГ, тогда как у женщин эта патология может начаться в молодом возрасте, особенно с синдромом Марфана. Выделяют следующие виды данной патологии: расслоение аневризмы аорты вне покрытия перикардом (тип В) и внутриперикардиально (тип А, характеризующийся худшим прогнозом с точки зрения развития фатальных осложнений — тяжелая аортальная недостаточность, тампонада сердца, инсульт); 2/3 эпизодов касаются внутриперикардиальной аорты (чуть повыше аортальных клапанов), 1/5 случаев локализации – ниже отхождения левой подключичной артерии, еще реже поражается дуга аорты или ее брюшной отдел. У пациентов типа А появляется внезапная «разрывающая» острая (огромной интенсивности), рецидивирующая боль, локализованная в центре грудной клетки и возникающая из грудино-реберных сочленений.
Эта боль в начале имеет максимальную интенсивность, часто иррадиирует в спину и нижние конечности. Пульс и АД на руках асимметричны, обычно отсутствует пульсация на одной или нескольких центральных артериях. Определяются набухание вен шеи и диасто-лический шум над аортальным клапаном. Могут быть признаки ишемии конечностей или инсульт. При типе В боль локализуется в тыльной части грудной клетки, АД повышено симметрично на обеих руках. Отмечается наличие жидкости в плевральной полости. На ЭКГ не определяются признаки острой ишемии миокарда (что указывает на расслаивающуюся аневризму аорты). Иногда отмечаются признаки ИМ нижней стенки вследствие закрытия правой коронарной артерии. Рентгенологически можно выявить расширение средостения из-за увеличения аорты и жидкость в полости перикарда, а на ЭхоКГ — участок расслоения восходящей аорты. Триада признаков (острая боль в грудной клетке, расширение средостения, асимметрия пульса) помогает врачу быстро диагностировать данную патологию и затем ее адекватно лечить
• ТЭЛА — характерна возникшая внезапно одышка, связанная с болью в грудной клетке (в 65% случаев) плеврального характера, нет признаков ОЛ. ТЭЛА следует подозревать в случае появления у больного (особенно с наличием ФР ТЭЛА) неясной одышки и/или болей в грудной клетке с отсутствием ишемических изменений на ЭКГ (иногда определяюгся S1,Q3 и отрицательные зубцы Т в V1-3). Рентгенография легких – обычно без явных отклонений от нормы. По данным ЭхоКГ можно оценить нарушение систолической функции ЛЖ и выявить признаки перегрузки правых отделов сердца. Более информативны – легочная ангиография, КТ легких и оценка уровня Д-димеров
• Левосторонний фибринозный плеврит (чаще сопутствующий болезням легких) — боль часто сильная и связана с дыханием, кашлем (в отличие от постоянной боли при ИМ), больной лежит на больном боку, дыхание поверхностное. На стороне поражения отмечаются снижение подвижности нижнего края, шум трения плевры и ослабление везикулярного дыхания
• Обострение остеохондроза межреберная невралгия.
К неинвазивной визуальной диагностике инфаркта миокарда относят рентгенографию грудной клетки, которая дает важную информацию и в ряде случаев помогает исключить причину болей в грудной клетке (пневмоторакс, ТЭЛА с инфарктом легких, переломы ребер, расслоение аорты). У больных ИМ рентгенография легких может быть полезна в выявлении ОЛ, оценке размеров сердца (есть или нет кардиомигалия), решении вопроса о том, является ли СН (кардиального или клапанного генеза) острой или хронической
Для верификации диагноза инфаркта миокарда (особенно когда при затяжном болевом приступе после снятия ЭКГ типичные изменения на ней отсутствуют и диагноз сомнителен, неясен) важна и неинвазивная ЭхоКГ в двух режимах Определяют симптомы возможного некроза нарушение региональной сократимости миокарда (участки акинезии, гиподискинезии) даже у больных с нетрансмуральным ИМ, ФВЛЖ, размеры камер сердца и разные осложнения ИМ – перфорацию (дефекты) межжелудочковой перегородки (ДМЖП), разрывы миокарда, аневризмы желудочков, выпот в полость перикарда, разрыв или отрыв сосочковых мышц, митральную регургитацию. Нормальная локальная сократимость миокарда ЛЖ часто помогает исключить ИМ в этой зоне. Для ИМ ПЖ характерны расширение ПЖ, тяжелая его дисфункция, которая часто сочетается с таковой нижней стенки ЛЖ Катетеризация ЛА выявляет повышенное давление в ППр на фоне неизмененного ДЗЛА. Недостатки ЭхоКГ — невозможность отличить свежий ИМ от старого рубца (следов ранее перенесенного ИМ) и субъективность анализа данных (в ряде случаев их нельзя оценить количественно)
Если ЭКГ и изменения ферментов не позволяют достоверно подтвердить диагноз инфаркта миокарда, то в течение первых 2—5 дней проводят сцинтиграфию сердца с изотопом технеция (или радионуклидную вентрикулографию) Технеций накапливается в зоне некроза, и на сцинтиграмме появляется «горячий очаг». Сцинтиграфия менее чувствительна, чем определение МВ-КФК Она, как и ЭхоКГ, не позволяет отkичить свежий ИМ от старого рубца. При некрозе миокарда ионы кальция выходят из миокардиоцита и пирофосфат соединяется с ними так, что выявляемые поля его фиксации указывают на участки некроза.
Дифференциальный диагноз инфаркта миокарда и миоперикардита в период пандемии
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Аннотация
Сложности дифференциальной диагностики инфаркта миокарда (ИМ) без подъема сегмента ST (ИМбпST) и острого миоперикардита в период пандемии новой коронавирусной инфекции COVID-19 представляются актуальным и интересным вопросом. Представлено клиническое наблюдение атипичного клинического течения ИМбпST у пациентки 55 лет. Заболевание дебютировало клинически как острая вирусная инфекция и было хронологически связано с контактом пациентки с больным новой коронавирусной инфекцией COVID-19. На основании жалоб на монотонные боли в левой половине грудной клетки, не связанные с физической нагрузкой, субфебрилитета, повышения уровня тропонина-Т, наличия воспалительных изменений при лабораторном обследовании, данных ЭКГ, отсутствия локальных и глобальных изменений при ЭхоКГ-исследовании врачами первично был заподозрен острый миоперикардит. Данные магнитно-резонансной томографии (МРТ) сердца с контрастированием выявили признаки ИМ. Проведенная коронароангиография подтвердила диагноз ИМ, и пациентке было выполнено чрескожное коронарное вмешательство (ЧКВ). В статье обсуждаются вопросы ЭКГ- и ЭхоКГ-диагностики, в ряде случаев не имеющих значимой информативности при постановке диагноза ИМбпST, диагностическая роль метода МРТ и другие вопросы дифференциального диагноза ИМ и миокардита и дополнительные трудности, которые возникли в связи с высокой эпидемиологической настороженностью врачей в период пандемии. Ввиду высокой вероятности развития миоперикардита в данном наблюдении была начата терапия нестероидными противовоспалительными препаратами и отсрочено назначение необходимой двойной антиагрегантной терапии и другой необходимой терапии, пациентка была направлена в рентген-операционную, где выполнено ЧКВ. Представленный клинический случай показал, что, несмотря на период пандемии, при значимом повышении сердечного тропонина в повторных анализах крови перед постановкой диагноза миоперикардита должен быть проведен полный диагностический поиск для исключения ИМ как причины развития клинической симптоматики.
Ключевые слова
Об авторах
д.м.н., доцент кафедры факультетской терапии име акад. А.И. Нестерова, профессор кафедры интервенционной кардиологии и кардиореабилитации, 117997, Москва, ул. Островитянова, д. 1;
119049, Москва, Ленинский проспект, 8
врач кардиологического отделения,
119049, Москва, Ленинский проспект, 8
студентка 6-го курса лечебного факультета,
119991, Москва, ул. Трубецкая, д. 8, стр. 2
заведующий Региональным сосудистым центром,
119049, Москва, Ленинский проспект, 8
д.м.н., заведующий кафедрой интервенционной кардиологии и кардиореабилитации, 117997, Москва, ул. Островитянова, д. 1;
заместитель главного врача по терапевтической помощи, 119049, Москва, Ленинский проспект, 8
Список литературы
1. Скворцова В. Система координат для дальнейшего движения. Медицина: целевые проекты. 2018;(31):6–7. Режим доступа: http://www.sovstrat.ru/files/MCP31_2018.pdf.
2. Гарганеева А.А., Кужелева Е.А., Борель К.Н., Паршин Е.А. Атипичное течение острого инфаркта миокарда: клинико-анамнестическая характеристика пациентов, тактика ведения и исходы (по данным «Регистра острого инфаркта миокарда»). Кардиоваскулярная терапия и профилактика. 2016;15(4):10–15. https://www.doi.org/10.15829/1728-8800-2016-4-10-15.
3. Лебедева А.Ю., Клыков Л.Л., Зайцева В.В. ИБС у молодых женщин: проблемы диагностики и профилактики. Российский кардиологический журнал. 2011;(6):90–97. Режим доступа: https://russjcardiol.elpub.ru/jour/article/view/1179.
4. Caforio A.L.P., Pankuweit S., Arbustini E., Basso C., Gimeno-Blanes J., Felix S.B. et al. Current state of knowledge on aetiology, diagnosis, management, and therapy of myocarditis: a position statement of the European Society of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2013;34(33):2636–2648. https://www.doi.org/10.1093/eurheartj/eht210.
5. Collet J.P., Thiele H., Barbato E., Barthélémy O., Bauersachs J., Bhatt D.L. et al. 2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation: The Task Force for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation of the European Society of Cardiology (ESC). Eur Heart J. 2021;42(14):1289–1367. https://www.doi.org/10.1093/eurheartj/ehaa575.
6. Руда М.Ю. Инфаркт миокарда. В: Чазов Е.И., Кухарчук В.В., Бойцов С.А. (ред.). Руководство по атеросклерозу и ишемической болезни сердца. М.: Медиа Медика; 2007. С. 626–724. Режим доступа: https://search.rsl.ru/ru/record/01003393519.
7. Серафинович И.А., Корнелюк Д.Г. Электрокардиографическая диагностика локализации критической окклюзии в коронарной артерии. Часть 1. Теоретические основы и диагностические критерии. Журнал ГрГМУ. 2015;2(22):115–120. Режим доступа: https://journalgrsmu.by/index.php/ojs/article/view/1120.
8. Thygesen K., Alpert J.S., Jaffe A.S., Chaitman B.R., Bax J.J., Morrow D.A., White H.D. Fourth universal definition of myocardial infarction. Eur Heart J. 2018;40(3):237–269. https://doi.org/10.1093/eurheartj/ehy462.
9. Caforio A.L.P., Marcolongo R., Basso C., Iliceto S. Clinical presentation and diagnosis of myocarditis. Heart. 2015;101(16):1332–1344. https://doi.org/ 10.1136/heartjnl-2014-306363.
10. Арутюнов Г.П., Палеев Ф.Н., Моисеева О.М., Драгунов Д.О., Соколова А.В., Арутюнов А.Г. и др. Миокардиты: клинические рекомендации. М.; 2020. Режим доступа: https://scardio.ru/content/Guidelines/2020/Clinic_rekom_Miokardit.pdf.
11. Zaghrini E.A., Emmanuel N., Zibara V., Terro W.D., Hanna S. COVID-19 myocarditis clinical presentation, diagnosis and management: a narrative review. Int J Clin Res. 2021;1(1):135–150. https://doi.org/10.38179/ijcr.v1i1.27.
12. Mangion K., Morrow A., Bagot C., Bayes H., Blyth K.G., Church C. et al. The Chief Scientist Office cardiovascular and pulmonary imaging in SARS Coronavirus disease-19 (CISCO-19) study. Cardiovascular Research. 2020;116(14):2185–2196. https://www.doi.org/10.1093/cvr/cvaa209.
13. Morgera T., Di Lenerda A., Dreas L., Pinamonti B., Humar F., Russani R. et al. Electrocardiography of myocarditis revisited: clinical and prognostic significance of electrocardiographic changes. Am Heart J. 1992;124(2):455– 467. https://www.doi.org/10.1016/0002-8703(92)90613-z.
14. Friedrich M., Sechtem U., Schulz-Menger J., Holmvang G., Alakija P., Cooper L. et al. Cardiovascular Magnetic Resonance in Myocarditis: A JACC White Paper. JACC. 2009;53(17):1475–1487. https://www.doi.org/10.1016/j.jacc.2009.02.007.
15. Ferreira V.M., Schulz-Menger J., Holmvang G., Kramer C.M., Carbone I., Sechtem U. et al. Cardiovascular Magnetic Resonance in Nonischemic Myocardial Inflammation Expert Recommendations. JACC. 2018;72(24):3158–3176. https://doi.org/10.1016/j.jacc.2018.09.072.
16. Барбараш О.Л., Дупляков Д.В., Затейщиков Д.А., Панченко Е.П., Шахнович Р.М., Явелов И.С. и др. Острый коронарный синдром без подъема сегмента ST электрокардиограммы: клинические рекомендации. М.; 2020. 152 с. Режим доступа: https://scardio.ru/content/Guidelines/2020/Clinic_rekom_OKS_bST.pdf.
17. Kofoed KF., Kelbaek H., Hansen P.R., Torp-Pedersen C., Hofsten D., Klovgaard L. et al. Early versus standard care invasive examination and treatment of patients with non-ST-segment elevation acute coronary syndrome. Circulation. 2018;138(24):2741–2750. https://www.doi.org/10.1161/CIRCULATIONAHA.118.037152.
18. Mehta S.R., Granger C.B., Boden W.E., Steg P.G., Bassand J.P., Faxon D.P. et al. Investigators TIMACS. Early versus delayed invasive intervention in acute coronary syndromes N Engl J Med. 2009;360:2165–2175. https://www.doi.org/10.1056/NEJMoa0807986.
Для цитирования:
Константинова Е.В., Атабегашвили М.Р., Савичева А.А., Нестеров А.П., Гиляров М.Ю. Дифференциальный диагноз инфаркта миокарда и миоперикардита в период пандемии. Медицинский Совет. 2021;(12):18-24. https://doi.org/10.21518/2079-701X-2021-12-18-24
For citation:
Konstantinova E.V., Atabegashvili M.R., Savicheva A.A., Nesterov A.P., Gilyarov M.Yu. Differential diagnosis of myocardial infarction and myopericarditis during a pandemic. Meditsinskiy sovet = Medical Council. 2021;(12):18-24. (In Russ.) https://doi.org/10.21518/2079-701X-2021-12-18-24

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Дифференциальная диагностика инфаркта Миокарда:
1. Стенокардия. При инфаркте боли носят нарастающий характер, большей интенсивности, больные возбуждены, беспокойны, а при стенокардии – заторможены. При инфаркте нет эффекта от нитроглицерина, боли длительные, иногда часами; при стенокардии четкая иррадиация болей, при инфаркте – обширная. Наличие сердечно-сосудистой недостаточности более свойственно инфаркту миокарда. Окончательная диагностика – по ЭКГ.
2. Острая коронарная недостаточность. Это – затянувшийся приступ стенокардии с явлениями очаговой дистрофии миокарда., то есть промежуточная форма. Длительность болей от 15 мин до 1 часа, не более: эффекта от нитроглицерина тоже нет. Изменения ЭКГ характеризуются смещением сегмента ST ниже изолинии, появляется отрицательный зубец Т. В отличие от стенокардии, после окончания приступа изменения ЭКГ остаются, а в отличие от инфаркта миокарда изменения держатся только 1-3 дня и полностью обратимы. Нет повышения активности фермсентов, так как нет некроза.
3. Перикардит. Болевой синдром весьма сходен с таковым при инфаркте миокарда. Боль длительная, постоянная, пульсирующая, но нет нарастающего, волнообразного характера боли. Нет предвестников (нестабильной стенокардии). Боли четко связаны с дыханием и положением тела. Признаки воспаления: повышение температуры, лейкоцитоз. Появляются не после начала болей, а предшествуют, или появляются вместе с ними. Шум трения перикарда долго сохраняется. На ЭКГ смещение сегмента ST выше изолинии, как и при инфаркте миокарда, но нет дискордантности и патологического зубца Q – главного признака инфаркта миокарда; подъем сегмента ST происходит практически во всех отведениях, так как изменения в сердце носят диффузный характер, а не очаговый, как при инфаркте. При перикардите при возвращении сегмента ST на изолинию зубец Т остается положительным, при инфаркте – отрицательным.
4. Эмболия ствола легочной артерии (как самостоятельное заболевание, а не осложнение инфаркта миокарда). Возникает остро, резко ухудшается состояние больного. Острые загрудинные боли, охватывающие всю грудную клетку, на первый план выступает дыхательная недостаточность: приступ удушья, диффузный цианоз. Причиной эмболии бывают мерцательная аритмия, тромбофлебит, оперативные вмешательства на органах малого таза и др. Чаще наблюдается эмболия правой легочной артерии, поэтому боли больше отдают вправо, а не влево.
Признаки острой сердечной недостаточности по правожелудочковому типу: одышка, цианоз, увеличение печени. Акцент II тона на легочной артерии, иногда набухание шейных вен. ЭКГ напоминает инфаркт в правых I и II грудных отведениях, есть признаки перегрузки правого сердца, может быть блокада ножки пучка Гисса. Изменения исчезают через 2-3 дня.
Эмболия часто приводит к инфаркту легкого: хрипы, шум трения плевры, признаки воспаления, реже наблюдается кровохарканье. Рентгенологически изменения клиновидной формы, чаще справа внизу.
5. Расслаивающаяся аневризма аорты. Чаще всего возникает у больных с высокой артериальной гипертензией. Нет периода предвестников, боль сразу же носит острый характер, кинжальная. Характерен мигрирующий характер болей: по мере расслаивания боли распространяются вниз в поясничную область, в нижние конечности. В процесс начинают вовлекаться другие артерии – возникают симптомы окклюзии крупных артерий, отходящих от аорты. Отсутствует пульс на лучевой артерии, может наблюдаться слепрота. На ЭКГ нет признаков инфаркта. Боли атипичные, не снимаются наркотиками.
6. Печеночная колика. Необходимо дифференцировать с абдоминальной формой инфаркта миокарда. Чаще у женщин, есть четкая связь с приемом пищи, боли не носят нарастающего волнообразного характера, иррадиируют вправо вверх. Часто повторная рвота. Локальная болезненность, однако это бывает и при инфаркте миокарда вследствие увеличения печени. Помогает ЭКГ. Повышена активность ЛДГ 5, а при инфаркте – ЛДГ 1.
7. Острый панкреатит. Тесная связь с едой: прием жирной пищи, сладкого, алкоголя. Опоясывающие боли, повышена активность ЛДГ 5. Повторная, часто неукротимая рвота. Помогает определение активности ферментов (амилаза мочи), ЭКГ.
8. Прободная язва желудка. На рентгенограмме воздух в брюшной полости (серп над печенью).
9. Острый плеврит. Связь болей с дыханием, шум трения плевры.
1О. Острые корешковые боли (рак, туберкулез позвоночника, радикулит). Боли связаны с изменением положения тела.
11. Спонтанный пневмоторакс. Признаки дыхательной недостаточности, коробочный перкуторый звук, отсутствие дыхания при аускультации (не всегда).
12. Диафрагмальная грыжа. Сопутствует пептический эзофагит. Боли связаны с положением тела, больше в горизонтальном положении тела, срыгивание, чувство жжения, усиленная саливация. Боли появляются после приема пищи. Тошнота, рвота.
13. Крупозная пневмония. В случае захвата в патологический процесс медиастенальной плевры боли могут быть за грудиной. Высокая лихорадка, данные со стороны лкгких.
Формулировка диагноза
2. Атеросклероз коронарных артерий.
3. Инфаркт миокарда с указанием даты (от . ) и локализация патологического процесса (какой стенки).
Лечение инфаркта Миокарда
1. Профилактика осложнений.
2. Ограничение зоны инфаркта.
Необходимо, чтобы лечебная практика соответствовала периоду заболевания.
1. Предынфарктный период. Главная цель лечения в этот период – предупредить возникновение инфаркта миокарда:
– постельный режим (до тех пор, пока есть признаки нарастания коронарной недостаточности);
– гепарин, можно вводить в/в, но чаще применяют п/к по 5-1О тыс. ЕД через каждые 4-6 часов.
– антиаритмические средства: поляризующая смесь. Если
– глюкоза 5% 2ОО-5ОО мл у больного сахарный диа-
– хлорид калия 1О% – 3О,О бет, то глюкозу заменить
– сульфат магния 25% – 2О,О физраствором.
– кокарбоксилаза 1ОО мг
– бета-адреноблокаторы /Anaprillini О,О4;
– нитраты пролонгированного действия (Sustak-forte).
иногда проводят экстренную реваскуляризацию миокарда.
2. Острейший период. Основная цель лечения – ограничить зону повреждения миокарда. Снятие болевого синдрома: начинать правильнее с нейролептанальгезии, а не с наркотиков, т.к. при этом меньше осложнений; фентанил 1-2 мл в/в на глюкозе /О,ОО5% 2 мл; дроперидол 2,О мл О,25% 2 мл на 4О мл 5% р-ра глюкозы; таламонал (содержит в 1 мл О,О5 мг фентанила и 2,5 мг дроперидола) 2-4 мл в/в струйно. Аналгетический эффект наступает немедленно после в/в введения (у 6О% больных) и сохраняется 3О мин.
Фентанил, в отличие от опиатов, очень редко угнетает дыхательный центр. После нейролептанальгезии сознание быстро восстанавливается. Не нарушается кишечная перистальтика и мочеотделение. Нельзя сочетать с опиатами и барбирутатами, т.к. возможно потенцирование пробочных эффектов
При неполном эффекте повторно вводят через 6О мин. морфин 1% 1,5 п/к или в/в струйно; омнопон 2% – 1,О п/к или в/в; промедол 1% – 1,О п/к.
Побочные явления препаратов группы морфина:
а) угнетение дыхательного центра – налорфин 1-2 мл в/в.
б) снижение рН крови и индуцирование синдрома электрической нестабильности сердца;
в) способствует депонированию крови, снижению венозного возврата, приводя к относительной гиповолении;
г) мощное ваготропное действие – усугубляется брадикардия, может быть тошнота, рвота, угнетение перистальтики кишечника и парез мускулатуры мочевого пузыря.
В связи с возможностью указанных осложнений применение морфинов и его аналогов при инфаркте миокарда должно быть сведено к минимуму.
Закисно-кислородная аналгезия. Ее применение при инфаркте миокарда – приоритет советской медицины. Применяют по следующей схеме:
Дифференциальный диагноз одышки в клинической практике
*Пятилетний импакт фактор РИНЦ за 2020 г.


Читайте в новом номере
Одышка – субъективное ощущение нехватки воздуха, является одной из самых частых жалоб у пациентов на приеме у терапевта или врача общей практики [1, 2]. Спектр заболеваний и состояний, которые сопровождаются одышкой, достаточно широк, включая такие угрожающие жизни патологии, как инфаркт миокарда или ТЭЛА, с одной стороны, и достаточно «безобидные» с прогностической точки зрения расстройства, такие как гипервентиляционный синдром и детренированность, с другой. Таким образом, в клинической практике требуется своевременное распознавание причины одышки у каждого конкретного пациента. В нашей статье мы попытаемся представить возможные подходы к дифференциальному диагнозу одышки.
Механизмы возникновения одышки
Одышка является проявлением несоответствия между повышенными потребностями газообмена и нагрузкой, которую выполняет дыхательная мускулатура. Одышка может возникать и при нормальном газообмене, но также при наличии патологии дыхательной мускулатуры [3]. Одышка является субъективным ощущением, которое сложно измерить объективными методами. Вместе с тем, возможно определить косвенные признаки одышки: изменение частоты (тахипноэ), зависимость от положения (ортопноэ, платипноэ) и нарушение дыхательного цикла (патологические типы дыхания). Существуют также способы объективизировать ощущения пациента – различные шкалы и вопросники, которые предоставляются пациенту для оценки выраженности одышки. Однако такие инструменты используются скорее в научных исследованиях, чем в клинической практике.
Система регуляции дыхания состоит из эфферентного (направляющего импульсы к дыхательной мускулатуре), афферентного (направляющего импульсы от рецепторов к мозгу) звена и собственно центра дыхания, перерабатывающего информацию. Нарушение в каждом из этих звеньев может привести к возникновению одышки. Так, при нарушении внешнего дыхания увеличивается работа дыхательных мышц, а при патологии дыхательной мускулатуры необходимы большие их усилия. Считается, что импульсы моторных эфферентных нейронов, параллельно с дыхательной мускулатурой, направляются в чувствительную кору, что приводит к возникновению ощущения одышки. Сенсорная афферентная импульсация усиливается под влиянием активации хеморецепторов гипоксией, гиперкапнией и ацидозом. В результате также возникает чувство одышки. Этот же механизм активируется в ответ на бронхоспазм, повышение давления в легочной артерии и даже гиперинфляцию. Наконец, при выраженном тревожном расстройстве одышка является следствием неверной интерпретации сигналов от афферентного звена, а также учащения дыхания, превышающего физиологические потребности [4–6].
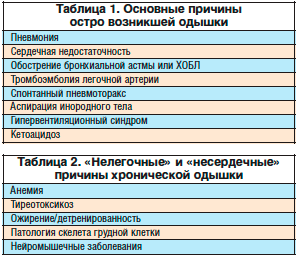
Патофизиологические причины одышки принято разделять на легочные и внелегочные. К первым относится возникновение одышки при обструктивных заболеваниях (бронхообструкция, стеноз верхних дыхательных путей), рестриктивной патологии легких (инфильтративные процессы, легочный фиброз, после резекции доли легкого) и сосудистых заболеваниях легких (ТЭЛА, легочная гипертензия, внутрилегочные шунты). К внелегочным механизмам относится внелегочная рестрикция (морбидное ожирение, паралич диафрагмы, нейромышечные заболевания, тяжелый кифосколиоз), сердечно-сосудистые заболевания (систолическая и диастолическая дисфункция миокарда, клапанные пороки) и другие причины, в числе которых анемия, выраженный ацидоз любого генеза, третий триместр беременности и нарушения регуляции дыхания (паническая атака с гипервентиляционным синдромом, альвеолярная гипервентиляция) (табл. 1, 2).
Одышка при болезнях легких
В клинической практике одышка наиболее часто встречается при заболеваниях с развитием обструктивных нарушений функции внешнего дыхания, т. е. при повышении сопротивления потоку вдоха или выдоха. При рестриктивных нарушениях внешнего дыхания из-за инфильтрации, фиброза или отека уменьшается податливость легких. Выявление выраженного бронхообструктивного синдрома обычно не вызывает значительных сложностей за счет типичного анамнеза и характерной аускультативной картины (сухие хрипы, в т. ч. при форсированном выдохе). В то же время, при сочетании обструктивного и рестриктивного поражения легких, аускультативная картина может быть достаточно скудной. То же самое характерно и для нетяжелой персистирующей бронхиальной астмы у тренированных лиц. Ключевым моментом для выявления бронхообструкции как причины одышки у таких больных является проведение исследования функции внешнего дыхания (обязательно с использованием бронходилататора) и бодиплетизмографии в неясных случаях.
Для одышки в связи с хронической легочной патологией характерно усиление при нагрузках, а также отсутствие связи между одышкой и положением тела. Исключением является ортопноэ у больных с тяжелым обострением бронхиальной астмы или хронической обструктивной болезни легких (ХОБЛ), платипноэ (усиление одышки в вертикальном положении из-за развития гипоксемии) у пациентов с наличием внутрилегочных шунтов со сбросом крови справа налево (при сосудистых мальформациях, портопульмональной гипертензии), а также после пульмонэктомии. Считается, что развитие платипноэ может быть связано с открытием овального окна после пульмонэктомии. В положении стоя увеличивается сброс крови справа налево, что и приводит к возникновению одышки [7].
Одышка при болезнях сердца
Одышка является одним из основных проявлений левожелудочковой недостаточности, как систолической, так и диастолической. Одышка связана с повышением давления в камерах сердца и, как следствие, с легочной венозной гипертензией. Значительную роль в повышении давления в камерах играет гиперволемия – еще одно проявление сердечной недостаточности. Одышка при сердечной недостаточности усиливается при нагрузке, а в случае декомпенсации – и в покое. В последнем случае одышка усиливается в положении на спине (ортопноэ), в т. ч. после засыпания (сердечная астма). Для декомпенсированной левосторонней сердечной недостаточности характерны признаки гиперволемии (влажные хрипы в легких, плевральные выпоты, выбухание наружной яремной вены, отеки). В ряде случаев при декомпенсации за счет отека стенки бронхов возможно развитие бронхообструкции с характерными проявлениями (свистящие сухие хрипы, изменения показателей исследования функции внешнего дыхания). Наличие признаков перегрузки жидкостью и известная патология сердца (инфаркт миокарда в анамнезе, клапанные пороки, длительный анамнез артериальной гипертензии, фибрилляция предсердий) позволяют диагностировать сердечную недостаточность как причину одышки без особого труда. Намного сложнее выявить сердечную недостаточность как причину одышки в отсутствие признаков перегрузки объемом, что особенно характерно для диастолической сердечной недостаточности. В этой ситуации полезным может оказаться определение уровня натрийуретического пептида «мозгового» типа (МНУП).
Концентрация МНУП повышается параллельно увеличению перегрузки миокарда желудочков (правого или левого) объемом или давлением, т. е. давление заполнения камер. Значения МНУП (BNP) более 400 пг/мл, а его н-терминального предшественника (NT-proBNP) – более 1600 мг/дл – указывают на сердечную причину одышки. Значения BNP менее 100 пг/мл, а NT-proBNP – менее 300 пг/мл с большой вероятностью ее исключают. С другой стороны, МНУП отображает повышение давления и в правых камерах, таким образом, его содержание в крови может повышаться при легочной гипертензии, ТЭЛА и легочном сердце. У больных с морбидным ожирением, особенно у женщин, уровни МНУП могут быть, наоборот, значительно сниженными даже при наличии сердечной недостаточности [8].
Сложной клинической задачей является дифференциальный диагноз между одышкой при сердечной недостаточности с сохраненной фракцией выброса, еще без признаков выраженной перегрузки жидкостью, и одышкой как эквивалентом стенокардии. Складывается впечатление о гипердиагностике последнего в отечественной клинической практике. Ключом к дифференциальному диагнозу в этом случае являются характеристики одышки (более длительная при сердечной недостаточности), результаты нагрузочных проб и ответ на терапию петлевыми диуретиками. Необходимо отметить, что нитраты уменьшают одышку в обоих случаях. Следовательно, у этих больных положительный ответ на прием нитроглицерина не может рассматриваться как дифференциально-диагностический признак.
Еще одной причиной возникновения коротких приступов одышки могут быть нарушения сердечного ритма, например частая желудочковая экстрасистолия, особенно по типу бигеминии или тригеминии, при исходно редком пульсе и короткие пароксизмы фибрилляции предсердий. Нарушения ритма не всегда выявляются при регистрации стандартной 12-канальной ЭКГ. Может потребоваться суточное мониторирование ЭКГ по Холтеру для уточнения характера нарушений ритма и их соответствия по времени симптомам.
Другой причиной недолговременных эпизодов одышки может быть легочная артериальная гипертензия (первичная, в рамках системных заболеваний соединительной ткани), для которой характерны «кризы» – повышения давления в легочных сосудах, сопровождаемые одышкой.
Несмотря на это в большинстве случаев дифференциальный диагноз «сердечной» и «легочной» одышки не вызывает больших сложностей. Исключение составляют больные с сопутствующими заболеваниями сердца и легких, у которых необходимо выделить превалирующий механизм.
Другие причины одышки
Одышка при умеренных нагрузках достаточно часто встречается при анемии и тиреотоксикозе, состояниях с высоким сердечным выбросом. При этом выраженность одышки зависит от исходного состояния сердечно-сосудистой системы.
Одышка и тахипноэ, даже в покое, сопровождают метаболический ацидоз любого генеза. В клинической практике чаще всего это диабетический кетоацидоз, ацидоз при почечной недостаточности (в т. ч. почечный канальцевый ацидоз с гиперкалиемией у больных с диабетической нефропатией и умеренным снижением фильтрации при терапии спиронолактоном), а также ацидоз при отравлениях салицилатами и антифризом. Повышение концентрации прогестеронов, характерное для третьего триместра беременности, также способствует развитию одышки при небольших нагрузках.
К возникновению одышки при нагрузках также приводят заболевания, вызывающие внелегочные рестриктивные нарушения, в т. ч. выраженный кифосколиоз, плевральный выпот, значительное утолщение плевры и патологию диафрагмы.
Наконец, одышка в рамках гипервентиляционного синдрома – частое проявление тревожных расстройств и целого ряда неврозов и неврозоподобных состояний, при которых клинические проявления могут быть выражены достаточно сильно.
Клинический подход к больному с жалобами на одышку
При анализе жалоб и анамнеза особое внимание необходимо уделить описанию ощущения одышки самим пациентом, скорости ее развития и влиянию на выраженность одышки изменения положения тела, присоединения инфекций и изменения внешних факторов, например температуры и влажности. Спектр заболеваний, приводящих к резкому возникновению одышки и постепенному ее развитию, различается. Более того, резкое усиление длительно существующей одышки может говорить как о прогрессировании основного процесса, так и о присоединении второго заболевания. Среди заболеваний, приводящих к резкому развитию выраженной одышки, в клинической практике чаще всего встречаются пневмонии, декомпенсированная или острая сердечная недостаточность (в т. ч. при развитии безболевого инфаркта миокарда по типу status asthmaticus), ТЭЛА, бронхообструктивный синдром (обострение бронхиальной астмы или ХОБЛ), пневмоторакс (в т. ч. спонтанный), аспирация инородного тела, гипервентиляционный синдром и метаболический ацидоз (наиболее часто – кетоацидоз) [9]. Большинство из этих заболеваний при типичной клинической картине не вызывают значительных сложностей для диагностики, за исключением ТЭЛА, при которой чаще всего единственными симптомами являются одышка, тахикардия, боль в грудной клетке и снижение сатурации кислорода в покое. Необходимо отметить, что цианоз и кровохарканье встречаются у меньшинства больных с ТЭЛА [10]. То же касается и классического изменения на ЭКГ Q1S3T3 (наиболее частым изменением на ЭКГ при ТЭЛА являются неспецифические изменения ST–T по передней стенке левого желудочка) [11]. Большинство заболеваний, приводящих к развитию резкой одышки, требуют госпитализации и стационарного лечения.
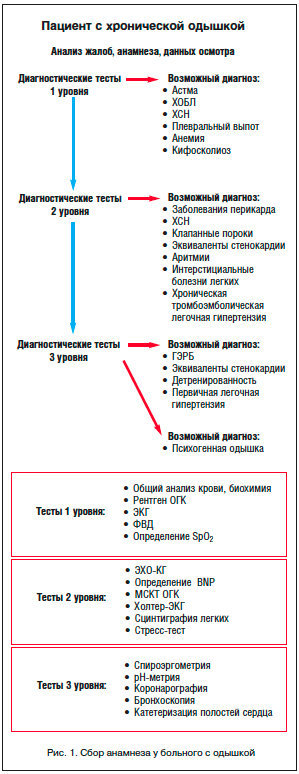
В амбулаторной практике чаще приходится сталкиваться со случаями хронической одышки, когда дифференциальный диагноз проводится между сердечными, легочными, сердечно-легочными и «несердечными и нелегочными» причинами одышки. Возникновение одышки в горизонтальном положении наиболее характерно для сердечной недостаточности, но также встречается при бронхиальной астме, ассоциированной с гастроэзофагеальным рефлюксом и морбидным ожирением. Ночные приступы одышки и удушья позволяют предположить наличие сердечной недостаточности или бронхиальной астмы. При сборе анамнеза необходимо обратить особое внимание на факторы сердечно-сосудистого риска и профессиональный путь больного (рис. 1).
Одышка при разговоре указывает на значительное снижение жизненной емкости легких (при отеке легких, поздних стадиях интерстициальных заболеваний) или гиперстимуляции дыхательного центра (паническая атака, ацидоз). Участие вспомогательной мускулатуры при дыхании указывает на выраженную бронхообструкцию и/или значительное снижение эластичности легких. При тщательном осмотре можно выявить признаки определенных заболеваний, ассоциированных с одышкой. Так, набухание шейных вен в положении сидя указывает на повышение давления в правом предсердии, т. е. на наличие правожелудочковой сердечной недостаточности. Утолщение ногтевых фаланг по типу пальцев Гиппократа может говорить о наличии интерстициальных болезней легких как причины одышки, синдром Рейно ассоциирован с легочной гипертензией при системной склеродермии и других системных заболеваниях соединительной ткани. Парадоксальное движение брюшной стенки (движение «вовнутрь» на вдохе в положении лежа) указывает на поражение диафрагмы, обычно двустороннее.
Во многих случаях для постановки диагноза достаточно тщательного анализа жалоб, анамнеза и осмотра больного. Если причина одышки не ясна, следующим шагом является рентгенография органов грудной клетки (ОГК), позволяющая выявить кардиомегалию как частое проявление сердечной недостаточности, а также инфильтративные изменения легких, гиперинфляцию как проявление бронхообструктивных заболеваний и плевральный выпот. Большинству больных также необходимо выполнить электрокардиографию и исследование функции внешнего дыхания при подозрении на вентиляционные нарушения. Во многих случаях значительную помощь оказывает определение МНУП, о чем сказано выше. Среди других причин хронической одышки в клинической практике наиболее часто встречаются анемия, тиреотоксикоз, ожирение или натренированность, патология грудной клетки и нейромышечные заболевания [9]. Следовательно, проведение клинического анализа крови, а также ТТГ может дать информацию, необходимую для постановки диагноза.
При отсутствии четкой клинической картины, а также наличии сопутствующих заболеваний сердца и легких необходимо проведение нагрузочной пробы с газовым анализом, спироэргометрии. Эта методика позволяет определить показатели легочного газообмена при нагрузке: потребление кислорода, продукцию углекислого газа, а также минутную легочную вентиляцию. Т. к. при заболеваниях легких толерантность к нагрузке лимитируют нарушения дыхательной механики (обструктивные или рестриктивные), одышка возникает в результате достижения максимальной произвольной вентиляции (MVV). Разница между МVV и измеренной на пике нагрузки VEmax называется дыхательным резервом и составляет в норме 50–80% MVV. У пациентов с хроническими заболеваниями легких VEmax при нагрузке приближается к MVV в значительно большей степени. Это означает, что толерантность к нагрузке у таких пациентов имеет «легочные границы», дыхательный резерв 50%). Существуют и другие респираторные параметры для дифференцирования одышки, каждый из которых обладает в большей или меньшей степени хорошей чувствительностью и специфичностью. Посредством комплексного анализа этих параметров спироэргометрия позволяет делать заключения о факторах, лимитирующих физическую работоспособность [12, 13].
Одышка является частой жалобой, заставляющей обратиться за медицинской помощью. Использование ступенчатого подхода, основанного на анализе жалоб, клинической картины и использовании дополнительных методов в отдельных случаях, позволяет идентифицировать причину одышки у большинства пациентов на амбулаторном уровне.
- Elliott M.W., Adams L., Cockcroft A. et al. The language of breathlessness. Use of verbal descriptors by patients with cardiopulmonary disease // Am. Rev. Respirat. Disease. 1991. Vol. 144. P. 826–832.
- Чучалин А.Г. Одышка: патофизиологические и клинические аспекты // Пульмонология: научно-практический журнал. 2004. № 5. С. 6–16.
- Tobin M.J. Dyspnea. Pathophysiologic basis, clinical presentation, and management // Arch. Intern. Med. 1990. Vol. 150. P. 1604–1613.
- Banzett R.B., Pedersen S.H., Schwartzstein R.M., Lansing R.W. The affective dimension of laboratory dyspnea: air hunger is more unpleasant than work/effort // Am. J. Respir. Crit. Care Med. 2008. Vol. 177(12). P. 1384–1390.
- American thoracic society consensus. Dyspnea. Mechanisms, assessment, and management: a consensus statement. American Thoracic Society // Am. J. Respir. Crit. Care Med. 1999. Vol. 159(1). P. 321–340.
- Mahler D.A., Harver A., Lentine T. et al. Descriptors of breathlessness in cardiorespiratory diseases // Am. J. Respir. Crit. Care Med. 1996. Vol. 154(5). P. 1357–1363.
- Amao E., Val E., Michel F. Platypnea-orthodeoxia syndrome // Rev. Clin. Esp. 2013. Vol. 213(2). P. 120–121.
- Morrison L.K., Harrison A., Krishnaswamy P. et al. Utility of a rapid B-natriuretic peptide assay in differentiating congestive heart failure from lung disease in patients presenting with dyspnea // J. Am. Coll. Cardiol. 2002. Vol. 39(2). P. 202–209.
- Ponka D., Kirlew M. Top 10 differential diagnoses in family medicine: Dyspnea // Can. Fam. Physician. 2007. Vol. 53(8). P.1333.
- Worsley D.F., Alavi A. Comprehensive analysis of the results of the PIOPED Study. Prospective Investigation of Pulmonary Embolism Diagnosis Study // J. Nucl. Med. 1995. Vol. 36(12). P. 2380–2387.
- Rodger M., Makropoulos D., Turek M. et al. Diagnostic value of the electrocardiogram in suspected pulmonary embolism // Am. J. Cardiol. 2000. Vol. 86(7). P. 807–9. A10
- Toma N., Bicescu G., Dragoi R. et al. Cardiopulmonary exercise testing in differential diagnosis of dyspnea // Maedica (Buchar). 2010. Vol. 5(3). P. 214–218.
- Arena R., Sietsema K.E. Cardiopulmonary Exercise Testing in the Clinical Evaluation of Patients With Heart and Lung Disease // Circulation. 2011. Vol.123. P. 668–680.
Только для зарегистрированных пользователей
5.4. Диагностика тромбоэмболии легочных артерий
Наиболее часто наблюдаются следующие симптомы и признаки:
боль в грудной клетке по типу плеврита — 52%
боль за грудиной — 12%
тахипноэ l20 в минуту — 70%
тахикардия l100 в минуту — 26%
признаки тромбоза глубоких вен — 15%
лихорадка l38,5°C — 7%
При оценке клинической вероятности ТЭЛА следует учитывать не только состояние пациента, но и наличие факторов, предрасполагающих к развитию венозных тромбоэмболических осложнений:
Факторы, имеющие высокое прогностическое значение (ОР > 10):
перелом бедра или голени;
протезирование бедренного или коленного сустава;
большая хирургическая операция;
повреждение спинного мозга.
Факторы, имеющие умеренное прогностическое значение (ОР 2—9):
артроскопическая операция на коленном суставе;
катетеризация центральной вены;
хроническая сердечная или дыхательная недостаточность;
заместительная гормональная терапия;
прием оральных контрацептивов;
беременность и ранний (до 6 недель) послеродовый период;
венозные тромбоэмболические осложнения в анамнезе;
Факторы, имеющие низкое прогностическое значение (ОР 3 суток;
длительное сидячее положение (например, авиаперелет);

Согласно нашим собственным наблюдениям, средний возраст пациентов с прижизненно диагностированной ТЭЛА составлял 57 ± 16 лет; в подавляющем большинстве случаев (94%) больные имели тот или иной фактор риска или их сочетание. Наиболее часто выявлялись хроническая сердечная недостаточность (36%), тромбоз глубоких вен и/или венозные тромбоэмболические осложнения в анамнезе (26%), ожирение (25%), онкологические заболевания (22%), варикозное расширение вен (21%), постельный режим (17%). Доля травм, оперативных вмешательств и неврологических заболеваний в спектре причин ТЭЛА оказалась существенно ниже — в частности, большая травма была ответственна за 7%, большая хирургическая операция — за 6%, а парез или плегия — за 9% тромбоэмболических осложнений, однако лишь при условии адекватной профилактики тромбообразования.
У больных с подозрением на ТЭЛА ее клиническую вероятность можно оценить с помощью шкал риска (табл. 5.2 и 5.3).









Несмотря на то, что этот метод признан «золотым стандартом» в диагностике ТЭЛА, риск, связанный с процедурой, и трудность интерпретации результатов правой вентрикулографии привели к постепенному вытеснению ангиопульмонографии другими методами — мультидетекторной КТ, эхокардиографией и лабораторному определению маркеров тромбообразования.
В подавляющем большинстве случаев для установления диагноза достаточно неинвазивного обследования.









Для аккуратной стратификации риска и выбора тактики ведения у пациентов с доказанной ТЭЛА следует оценить функцию правого желудочка и степень повреждения миокарда, в связи с чем алгоритм обследования должен включать эхокардиографию и определение уровня сердечных тропонинов.
При наличии тромбоэмболических осложнений в отсутствие факторов риска желательно дообследование на предмет заболеваний, характеризующихся патологией свертывания крови — в первую очередь, тромбофилий и злокачественных новообразований.
Инфаркт миокарда
Определение
Сердце человека – орган, который работает непрерывно от первого вздоха до последнего, без выходных и отпусков. Мышца сердца, миокард, обеспечивает насосную функцию, сокращается каждую секунду и нуждается в активном кровообращении. Венечные (или коронарные) артерии обеспечивают питанием и кислородом самую трудолюбивую мышцу нашего тела.
Если в одной или нескольких коронарных артериях возникает затруднение тока крови из-за атеросклеротических наложений, сужения сосуда – снижается кровоснабжение миокарда, возникает боль. Такая боль называется ишемической и болезнь – ишемической болезнью сердца.
Ишемия, в переводе с греческого – местное малокровие, обескровливание, что объясняет основную природу заболевания.
Инфаркт миокарда (ИМ) – сердечно-сосудистая катастрофа, сердечный приступ: это гибель участка миокарда из-за затянувшегося эпизода ишемии.
Причины инфаркта
В подавляющем числе случаев причиной инфаркта является атеросклероз – образование атеросклеротической бляшки на стенке сосуда, сужающей ее просвет.
Этот процесс хронический и бляшка «растет» постепенно. Как правило, такая постепенность дает организму возможность подготовиться – развиваются коллатеральные, обходные, пути кровотока и даже тотальное перекрытие магистральной артерии не ведет к полному обескровливанию и развитию инфаркта.
Но, если по какой-то причине, бляшка стала нестабильной, нарушилась целостность ее «покрышки» – запускается неудержимый каскад тромбоза. И тогда даже небольшая по размеру бляшка может стать причиной инфаркта миокарда. Клетки крови макрофаги, тромбоциты стремятся закрыть дефект, активируется свертывающая система крови, образуется фибриновый сгусток и тромб, полностью перекрывающий просвет артерии. Сердечная мышца очень чувствительна к гипоксии. Через 30 минут начинается гибель клеток, а через 90-100 минут участок миокарда, лишенный кровотока, необратимо погибает полностью.
Иногда кровоток восстанавливается самостоятельно – собственная противосвертывающая система справляется с тромбом и инфаркт не случается. От 4-х до 27% сердечных приступов заканчиваются подобным образом.
Тромбоз является причиной инфаркта в 9 из 10 случаев. Другие причины – эмболия (перекрытие просвета коронарной артерии не тромбом, а фрагментом той же кальцинированной бляшки или измененного сердечного клапана), спазм, кровоизлияние в бляшку, отслойка внутренней стенки артерии. Они встречаются гораздо реже.
Факторы риска
Факторами риска атеросклероза и инфаркта миокарда являются:
Дислипидемия: повышение уровня общего холестерина и липопротеидов низкой плотности крови – основа формирования атеросклеротической бляшки
Табакокурение: повреждение эндотелия сосудов, хроническая гипоксия из-за воздействия угарного газа, прямое сосудосуживающее действие никотина – не полный перечень влияния курения на сосуды и сердце
Сахарный диабет: нарушена микроциркуляция, поддерживается состояние хронического воспаления
Артериальная гипертония: повышает нагрузку на сердечную мышцу.
Абдоминальное ожирение: способствует нарушениям обмена липидов и глюкозы, повышению АД, увеличению потребности в кровоснабжении.
Низкая физическая активность: снижение тренированности, уменьшение массы мускулатуры, возможностей адаптации организма к изменениям.
Нездоровое питание, злоупотребление алкоголем
Психоэмоциональные причины: стресс, депрессия.
Симптомы, клиника
Типичным симптомом ишемического поражения миокарда является боль в груди. Чаще она сжимающего, давящего характера, локализуется за грудиной. Характерна иррадиация (распространение) в левую руку, плечо, под лопатку. Боль длительная, может быть волнообразной.
Характерны также холодный «липкий» пот, бледность кожи, одышка.
Тревожность, чувство страха, беспокойство, резкая усталость – часто сопровождают инфаркт.
Такая классическая картина сопровождает инфаркт далеко не всегда.
Описаны нетипичные варианты клиники ИМ. Часто они встречаются среди женщин, пожилых людей, при повторных инфарктах, сахарном диабете.
Астматический – ведущий симптом одышка, вплоть до удушья. Обычно при обширном поражении сердца и развитии недостаточности левого желудочка у пожилых пациентов и при повторном инфаркте;
Аритмический – болевой синдром выражен незначительно, беспокоят сердцебиение, «провалы» в биении сердца, слабость;
Абдоминальный – боль в животе, тошнота и рвота, часто при нижней локализации инфаркта миокарда;
Церебральный – с преобладанием признаков поражения мозга, головокружения. Снижение сократительной способности, замедление ритма могут привести к снижению мозгового кровообращения, особенно у пациентов с исходными нарушениями церебрального кровотока;
Бессимптомный или малосимптомный – нет типичных признаков, боль не интенсивная или совсем отсутствует. Заболевание диагностируется postfaсtum по изменениям ЭКГ. Такой вариант течения заболевания характерен для пациентов сахарным диабетом, пожилых и женщин;
С нетипичной локализацией боли – в правой руке, нижних конечностях, спине.
Диагностика
Диагноз ИМ устанавливается на основании совокупности клинической картины (симптомы) и данных ЭКГ (запись электрической активности сердечной мышцы). Для принятия решения о неотложности лечения часто этого достаточно.
В дальнейшем, для подтверждения диагноза, определения прогноза необходимы лабораторные тесты и более сложные инструментальные исследования.
Изменения ЭКГ при инфаркте миокарда зависят от локализации очага поражения, его объема и глубины. Эти изменения динамичны, проходят определенные стадии.
В типичном случае в острейшем периоде ИМ регистрируется подъем сегмента ST (как минимум, в 2-х смежных отведениях), затем формируется зубец Q(или QS) и характерная динамика з. Т в подострой стадии.
Трудно оценить инфарктную динамику ЭКГ при наличии кардиостимулятора, нарушений проводимости по типу полной блокады ножек пучка Гиса, синдрома Вольфа-Перкинсона-Уайта и здесь необходимы лабораторные тесты повреждения миокарда.
К ним относятся определение сердечных тропонинов (T и I, высокочувствительный), креатинфосфокиназы. Первые маркеры (тропонины) появляются уже через 2-3 часа от начала гибели кардиомиоцитов и позволяют поставить точный диагноз и начать лечение, спасающее жизнь. Экспресс-анализ на тропонин возможно выполнить уже бригадой скорой помощи.
Как и ЭКГ, уровень лабораторных показателей меняется в динамике, достигая максимальных значений к концу вторых суток и приходя к норме через 10-14 дней. Кроме тропонинов и КФК в общем анализе крови может быть умеренный лейкоцитоз (максимально до 15х109/л) в течение первой недели заболевания, а затем ускорение СОЭ, сохраняющееся до нескольких недель. Эти изменения часто сопровождают умеренную лихорадку (до 380С) из-за системного воспаления в ответ на попадание в кровоток продуктов некроза миокарда.
Классификация, стадии инфаркта миокарда
1. Острейший – первые 2 часа после начала болевого синдрома;
2. Острый – до 10 дней от начала заболевания;
3. Подострый – от 2-х недель до 1,5 месяцев;
4. Стадия рубцевания – от 1,5 до 6 месяцев;
5. Стадия исходов, постинфарктный кардиосклероз – через 6 месяцев от момента инфаркта;
В зависимости от размера очага некроза: крупноочаговый, мелкоочаговый.
В зависимости от глубины распространения некроза: субэпикардиальный, субэндокардиальный,интрамуральный, трансмуральный
Наличие осложнений: осложненный, неосложненный.
В зависимости от локализации очага: передней, боковой, задней, нижней стенки левого желудочка, межжелудочковой перегородки, верхушки сердца, правого желудочка, предсердий или комбинированные варианты.
По наличию в прошлом ИМ: первый, повторный (после 28 суток от предыдущего инфаркта), рецидив (в течение 28 суток от инфаркта).
Первая помощь, лечение
Ухудшение самочувствия при инфаркте миокарда, как правило, внезапное и выраженное, сопровождается тревогой, страхом, беспокойством.
Первое, что нужно сделать – прекратить выполняемую нагрузку, по возможности сесть или прилечь. Обеспечить доступ свежего воздуха – открыть окно, расстегнуть верхние пуговицы рубашки, ослабить ремень, галстук.
Если у человека ранее были проблемы с сердцем, он может иметь при себе соответствующее лекарство – нитроглицерин. При появлении боли нужно принять до 3-х таблеток нитроглицерина с интервалом 5 минут (если в ответ на первую таблетку избыточно не снизилось АД, не появилось сильное головокружение).
Также рекомендовано принять ½ таблетки аспирина (250мг). Неэффективность нитроглицерина и прекращения нагрузки характерна для ИМ, в отличие от стенокардии напряжения. Поэтому очень важно как можно скорее вызвать скорую медицинскую помощь и четко объяснить диспетчеру 03, что ситуация неотложная и вероятен инфаркт миокарда.
От своевременности оказания помощи напрямую зависит не только объем поражения сердца, риск развития осложнений, но и возможность пережить инфаркт миокарда. Если в течение 60 минут пациент будет доставлен в стационар для проведения лечения, его шансы выжить и не стать инвалидом значительно возрастают.
Смертность от инфаркта миокарда достигает 20% и 80-90%смертей происходит из-за позднего начала лечения.
Врачи бригады скорой помощи регистрируют ЭКГ, которая в большинстве случаев определяет диагноз и дальнейшую тактику. Если есть данные за инфаркт миокарда – лечение начинается незамедлительно.
При сохраняющемся болевом синдроме проводится обезболивание, чаще используется морфин.
По показаниям вводятся антиаритмические, седативные средства.
Следующий важный вопрос – восстановление кровотока в коронарной артерии, реперфузионная терапия. Она позволяет либо предотвратить гибель кардиомиоцитов, либо уменьшить объем поражения, возобновив кровообращение.
Такой восстановление проводится либо внутривенным введением медикаментов тромболитического действия (непосредственное «растворение» тромба внутри артерии) или механическим расширением сосуда – чрезкожное вмешательство (ЧКВ) или ангиопластика с возможным последующим стентированием (установкой стента-пружины для сохранения проходимости пораженной артерии).
Преимущества ангиопластики перед тромболизисом доказаны, если она проведена в течение не более 2-х часов от начала болевого приступа. Это вмешательство несет значительно меньший риск кровотечений, в том числе геморрагического инсульта.
Поэтому так важна оперативность доставки пациента с инфарктом в больницу.
Но, введение препаратов тромболитического действия может быть начато уже в машине скорой помощи, если шансов доставить пациента в специализированное отделение в течение 60 минут от начала приступа нет. Проведение тромболизиса в течение часа от начала заболевания позволяет «остановить» развитие каждого третьего инфаркта. Чем больше времени проходит от начала заболевания, тем меньше эффективность такой терапии и через 12 часов она практически равна нулю.
После проведенной тромболитической терапии в течение суток проводится плановое ЧКВ: рентгенконтрастное исследование коронарных артерий – коронарография. Это важно для контроля состояния коронарного русла и, при необходимости, проведения ангиопластики и стентирования.
Надо понимать, что есть очень четкий алгоритм действия врачей по оказанию помощи при остром коронарном синдроме (состояние, когда еще непонятно во что выльется сердечный приступ – стенокардию или инфаркт). Он разработан на основе многих исследований, наблюдений и помогает спасать пациентов.
Осложнения инфаркта миокарда
Они разделяются на ранние и поздние.
К ранним осложнениям относятся:
1. Острая левожелудочковая недостаточность – резкое снижение сократительной способности миокарда, проявляется одышкой, кашлем, учащением пульса. Может сопровождать острую аневризму сердца – выбухание участка желудочка по месту обширной инфарктной зоны;
2. Нарушения ритма и проводимости сердца – различные нарушения регистрируются у 90% пациентов. Некоторые из таких нарушений – смертельно опасны (как фибрилляция предсердий, полная атриовентрикулярная блокада), лечение их возможно только в условиях отделения интенсивной терапии – дефибрилляция или установка кардиостимулятора;
3. Кардиогенный шок – невозможность адекватного кровоснабжения, резкое снижение АД при поражении большого участка миокарда;
4. Ранняя постинфарктная стенокардия – возникает в первые 24 часа острого инфаркта, может быть проявлением незавершившегося некроза сердечной мышцы;
5. Перикардит – воспаление сердечной сумки в первые 1-3 суток, осложняет течение заболевания, увеличивает риск неблагоприятного исхода;
6. «Несердечные» осложнения: желудочно-кишечные кровотечения, острый психоз или депрессия, тромбоэмболические осложнений в другие сосуды.
1. Синдром Дресслера – через 2-6 недель появляются полисерозиты – воспаление плевры, перикарда, суставов. Имеют аутоиммунный характер;
2. Тромбоэндокардит – возникновение и воспаление пристеночного тромба в полости сердца, на клапанах, опасен эмболическими осложнениями;
3. Формирование хронической аневризмы сердца – в области обширного рубца, способствует прогрессированию сердечной недостаточности, образованию внутрисердечного тромба;
4. Хроническая сердечная недостаточность – недостаточная насосная функция сердца ведет к снижению физической работоспособности, появлению одышки, отеков;
Как жить после инфаркта
Целями восстановления являются физическая, психологическая адаптация, восстановление работоспособности, предупреждение развития осложнений и повторного инфаркта.
Физическая реабилитация начинается с палаты интенсивной терапии. До 28 дней – в кардиологическом отделении или реабилитационном центре, санатории. Постепенное увеличение физической активности позволяет снизить риск осложнений, вернуться к обычной жизни.
Часто необходимо участие психолога, чтобы помочь пациенту продолжить жить с новой болезнью.
Медикаментозная терапия – также является частью реабилитационного плана. Она включает в себя различные группы препаратов, которые назначаются индивидуально. Чаще всего назначаются препараты для урежения частоты пульса, снижение уровня холестерина, нормализации артериального давления и предотвращения повышенной свертываемости крови.
Важно выполнять рекомендации врача по приему препаратов и соблюдению режима физической активности.
Огромную роль играют изменения в образе жизни, касающиеся не только физических упражнений. Коррекция массы тела при ее избытке (или недостатке!), изменения в составе рациона питания (по типу антиатерогенного), отказ от курения (если человек еще этого не сделал) – без этой работы пациент имеет мало шансов «жить долго и счастливо».
Современная диагностика и оценка острого коронарного синдрома: значение определения тропонинов
Сердечно-сосудистые заболевания (ССЗ) являются главной причиной летальности в индустриально развитых странах и в России. Эффективность лечебных процедур при ведении больных с острым инфарктом миокарда (ИМ) и нестабильной стенокардией
Сердечно-сосудистые заболевания (ССЗ) являются главной причиной летальности в индустриально развитых странах и в России.
Эффективность лечебных процедур при ведении больных с острым инфарктом миокарда (ИМ) и нестабильной стенокардией (НС), как основных форм острого коронарного синдрома (ОКС), во многом зависит от ранней и точной диагностики заболевания. Кроме того, ключевыми проблемами ведения пациентов с ОКС являются: сортировка больных на ранних этапах госпитализации, стратификация риска и прогноза заболевания.
В течение многих лет диагноз ИМ, согласно рекомендациям ВОЗ (1979 г.), основывался на трех базисных постулатах:
- оценке клинической картины;
- данных ЭКГ-исследований;
- выявлении гиперферментемии.
Диагноз ИМ считался достоверным только в том случае, если два из вышеозначенных критериев являлись бесспорными и однозначно трактуемыми.
Однако почти у половины больных с ИМ наблюдается безболевое начало заболевания или нетипичное проявление болевого синдрома и более чем у 40% пациентов отсутствуют четкие, однозначно интерпретируемые изменения ЭКГ. Третий диагностический признак ИМ — гиперферментемия таких традиционно определяемых сывороточных энзимов, как аспартатаминотрансфераза (АСТ), лактатдегидрогеназа (ЛДГ) и креатинкиназа (КК) — высокочувствителен, но неспецифичен. Более диагностически специфичный тест — определение изофермента КК МВ. Но вследствие того, что КК МВ содержится не только в миокардиальных клетках, но и в скелетных мышцах, хотя и в относительно небольших количествах (3–5% от общей КК), тест не может рассматриваться как идеально специфичный маркер миокардиального повреждения. Поэтому до последнего времени существовали серьезные проблемы в диагностике ИМ, особенно у больных ОКС без подъема сегмента ST. Они были во многом решены после того, как в миокардиальных клетках были идентифицированы абсолютно специфичные для этой ткани миокардиальные изоформы тропонина Т и тропонина I. После разработки в начале 1990-х гг. коммерческих тест-систем для определения уровня тропонинов (Тн) были проведены многочисленные исследования их диагностической значимости.
Роль тропонинов в точной и дифференциальной диагностике ИМ и НС
Результатом этих исследований стала публикация в 2000 г. ведущими кардиологическими сообществами Европы и США совместных документов, посвященных пересмотру диагностических критериев ИМ: «Пересмотр дефиниции инфаркта миокарда» и «Руководство по ведению больных с нестабильной стенокардией и инфарктом миокарда без элевации сегмента ST».
Согласно этим документам, главным диагностическим критерием ИМ является типичный подъем и последующее постепенное снижение концентрации одного из сывороточных тропонинов (Тн) в сочетании, по меньшей мере, с одним из следующих признаков: ишемические симптомы и (или) изменения ЭКГ, свидетельствующие об ишемии.
Современная диагностическая классификация основных форм ОКС, основывающаяся на определении уровня Тн и данных ЭКГ, представлена на рисунке. Классификация предусматривает разделение всех больных ОКС на две основные группы: а) со стойкой элевацией сегмента ST и б) без подъема сегмента ST. Выявление повышенного уровня одного из Тн у больных первой группы с несомненностью подтверждает ЭКГ-диагноз ИМ. Вторая группа пациентов ОКС без подъема сегмента ST подразделяется на две категории: Тн-позитивных (со значениями концентрации Тн выше верхней границы «патологических» значений — «сut off») с диагнозом ИМ и Тн-негативных (со значением концентрации Тн ниже границы «патологических» значений — «сut off»), диагностируемых как НС.
Предлагаемый алгоритм может рассматриваться как основополагающий в современной диагностике ИМ и дифференциальной диагностике ИМ и НС.
Кроме того, в рамках вышеприведенных «консенсусных» документов целесообразно рассмотреть следующие положения «тропониновой» диагностики ИМ:
- Высокая чувствительность Тн позволяет выявить микроскопические зоны некроза (менее 1 г), обозначаемые как минимальные миокардиальные повреждения.
- Повышение концентрации Тн в крови с большей вероятностью отражает необратимое, чем обратимое, повреждение хотя до сих пор нельзя считать эту проблему окончательно решенной.
- У больных ИМ увеличение концентрации Тн в крови проявляется приблизительно в тот же самый период, что и повышение концентрации других ферментов (КК, КК МВ, АСТ, ЛДГ), т. е. в пределах 4–7 ч от начала заболевания, достигая максимальных значений к 12–24 ч заболевания. Но, в отличие от «традиционных» ферментов, диапазон диагностической значимости Тн («диагностическое окно») более длителен и может быть пролонгирован до 7–14 дней начального периода. Вот почему тропонины не только высокоспецифичные, но и «поздние» диагностические маркеры, позволяющие выявить «пропущенный» ИМ, что особенно важно в тех случаях, когда ИМ протекает без явных клинических и ЭКГ-признаков заболевания.
- С целью «ранней» диагностики ИМ рекомендуется использовать определение миоглобина (Мг) — белка скелетных и сердечных мышц с низким молекулярным весом (18,5 кДа). Концентрация Мг в крови больных ИМ начинает возрастать в первые 1–3 ч от начала ангинозного приступа, достигая пика к 6–8 ч заболевания. Поэтому оптимальной на сегодняшний день считается «двухмаркерная» лабораторная диагностика ИМ: определение высокочувствительного, но неспецифического для миокарда «раннего» показателя некроза — Мг и высокоспецифичного «позднего» маркера — тропонина.
- Повышенным считается значение концентрации Тн, превышающее 99 перцентилей для контрольной популяции здоровых людей. Однако, согласно «консенсусному» документу, этот уровень Тн может быть принят только при условии, если аналитическая точность (коэффициент воспроизводимости) не превышает 10%. Следует отметить, что этому условию на уровне «верхней границы нормы» не соответствует ни одна из существующих коммерческих тест-систем. Поэтому используется так называемое значение «cut off» — уровень концентрации Тн, ниже которого результаты не представляют клинического значения, а выше — соответствуют с высокой степенью достоверности инфаркту миокарда. Многие крупные компании — разработчики тест-систем выработали для своих методов четкое значение уровня патологических значений с учетом аналитических и клинических характеристик. Так, для ТнТ (компания «Roche») он равен 0,1 мкг/л, а для ТнI (компания «Beckman Coulter») — 0,5 мкг/л.
- Для определения тропонинов используются иммунохимические методы определения (часто неправильно именуемые как иммунологические). Их детектирование осуществляется в основном на высокопроизводительных, так называемых многопрофильных (т. е. позволяющих определять целый спектр показателей — гормонов, онкомаркеров и т. д.), иммунохимических анализаторах.
В последние годы появилась возможность измерения уровня тропонинов с помощью небольших специализированных приборов или же тест-полосок. В то же время применение последних в кардиологической практике целесообразно ограничить только сортировкой больных на догоспитальном этапе или при поступлении больного. При постановке точного диагноза или же дифференциального диагноза между ИМ и НС, проведении стратификации риска могут быть использованы только строго количественные методы, реализуемые на «больших» иммунохимических или специализированных анализаторах.
Значение Тн в первичном отборе больных с синдромом загрудинных болей
Среди больных, поступающих в отделение неотложной помощи больниц и госпиталей с болевым синдромом в области груди, только у 15–25% при последующем обследовании обнаруживается ОКС. Поэтому одна из центральных задач этих отделений — отбор больных с ОКС среди остальных пациентов с заболеваниями не кардиологического характера. Как показывает опыт ряда клиник Европы и США, вследствие неточного первичного диагноза часть этих пациентов без ОКС подвергается интенсивному и достаточно дорогостоящему лечению. Поэтому измерение концентрации Тн у этих больных на ранних этапах госпитализации позволяет оптимизировать процедуру отбора больных с ОКС.
Стратификация риска и прогноз у больных с ОКС: роль тропонинов
Больные с ОКС, поступающие в отделения неотложной кардиологии, представляют собой весьма неоднородную группу как по клинической картине и различным функциональным показателям, так и по степени увеличения концентрации Тн в сыворотке крови. Было установлено, что определяемый в течение 3–18 ч после ангинозного приступа уровень Тн связан с прогнозом развития тяжелых кардиальных осложнений в ближайший и отдаленный периоды заболевания. В соответствии со степенью возрастания концентрации Тн можно выделить две основные группы: высокого коронарного риска и низкого коронарного риска.
Особый интерес представляет установление уровня Тн у больных ОКС без элевации сегмента ST. Еще в ранних работах было показано, что среди этой категории пациентов выявляется группа риска с приблизительно такой же частотой тяжелых кардиальных осложнений (внезапная смерть, повторный ИМ), как и у больных с типичным ИМ (с подъемом сегмента ST). В последующих исследованиях, относящихся к «тропониновой эре», повышенный уровень этих миокардиальных маркеров был обнаружен более чем у половины пациентов с ОКС без подъема сегмента ST. Причем у 1/3 больных Тн был единственным кардиальным маркером, уровень которого превышал границу «нормальных значений». Таким образом, исследования Тн показали, что у части больных ОКС без элевации сегмента ST имеет место развитие некротических повреждений сердечной мышцы ишемического генеза, т. е. истинный ИМ. Также было достоверно установлено, что у этой категории Тн-позитивных больных риск развития тяжелых кардиальных осложнений значительно выше, чем у Тн-негативных пациентов, а внутри группы Тн-позитивных пациентов он зависит от уровня концентрации Тн.
После введения новых «Рекомендаций» (2000) можно было постулировать возрастание частоты ИМ в различных популяциях населения и, одновременно, снижение показателей летальности от этого заболевания. Такие статистические данные в последнее время были представлены Британским кардиологическим обществом и рядом других медицинских организаций Европы и США (2001–2004).
Таким образом, можно констатировать, что использование информативных, специфичных и строго количественных показателей, каковыми являются такие миокардиальные маркеры, как Тн, значительно уменьшило элемент субъективизма в постановке диагноза ОКС и тем самым позволило рационализировать ведение пациентов в остром и отдаленном периодах заболевания. Представляется, что это особо актуально для отечественной кардиологии, в которой до сих пор традиционно сохраняется примат электрокардиографических исследований в диагностике ОКС, ИМ и НС.
Литература
- Myocardial Infarction Redefined — A Consensus Document of The Joint European Society of Cardiology/American College of Cardiology Committee for the Redefinition of Myocardial Infarction (The Joint European Society of Cardiology/American College of Cardiology Committee) — J/ of Am/ College of Cardiology. 2000; v. 36, № 3.
- Management of acute coronary syndromes: acute coronary syndromes without persistent ST segment elevation. Recommendations of the Task Force on the European Society of Cardiology. — Eur. Heart J. 2000; 21 : 1406–1432.
- ACC/AHA Guidelines for the Management of Patients with Unstable Angina and non-ST-Segment Elevation Myocardial Infarction. A Report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines (Committee on the Management of Patients With Unstable Angina). JACC. 2000; 36 : 970–1062.
Д. Б. Сапрыгин, доктор медицинских наук, профессор
РМАПО, Российская Ассоциация медицинской лабораторной диагностики, Москва