Аппарат искусственного кровообращения
![]()
- В последние годы в Кыргызстане параллельно с ростом впервые выявляемых болезней и врожденных пороков системы кровообращения значительно увеличивается количество хирургических вмешательств, выполняемых в условиях искусственного кровообращения. Доктор БОСТИ подготовил статью об аппарате искусственного кровообращения, более подробно затронув его основной элемент – оксигенатор.
Товар добавлен в избранное
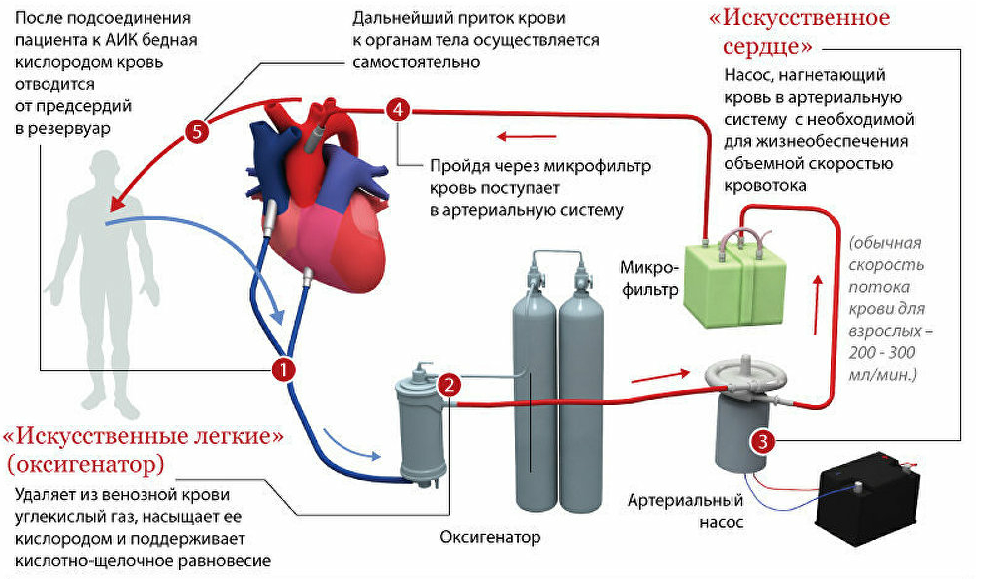
Схема принципа работы искусственного кровообращения
Аппарат искусственного кровообращения (АИК), или аппарат «искусственное сердце — лёгкие» — специальное медицинское оборудование, обеспечивающее жизнедеятельность человека при частичной или полной невозможности выполнения функций сердца и/или лёгких.
Принцип работы
Аппарат искусственного кровообращения временно замещает функцию сердца и легких. Поэтому он состоит из нескольких блоков, а именно:
1) Оксигенатор. Кровь попадает туда из катетеризированных вен правого предсердия самотеком. В оксигенаторе она насыщается кислородом и освобождается от углекислого газа. В некоторых оксигенаторах кровь соприкасается с газом (пузырьковые, пленочные), в других она насыщается кислородом через газопроницаемую мембрану.
2) Артериальный насос. По своей конструкции он может быть мембранный, камерный, роликовый, пальчиковый. Основная функция его состоит в нагнетании оксигенированной крови в артерию.
3) Коронарный отсос. Его задача отсасывать излившуюся кровь из раны и возвращать в циркуляторный контур аппарата искусственного кровообращения.
4) Теплообменник. Согревает или охлаждает кровь до определенной требуемой температуры. Так, чтобы избежать травматизации клеток крови во время перфузии, а это возможно при длительных оперативных вмешательствах, когда она проходит через циркуляторный контур многократно, используют гипотермию. Теплообменник может быть трубчатым или щелевым.
5) Фильтр-ловушка. Кровь, попадая в аппарат искусственного кровообращения, может образовать сгустки, содержать пузырьки газа, поэтому перед обратным поступлением в кровеносное русло больного ее фильтруют.
Где используется
В основном аппарат искусственного кровообращения (АИК) применяется в кардиохирургии, при операциях на открытом сердце. Во время оперативного вмешательства сердце не может выполнять свою функцию насоса и ее заменяют механическим перекачиванием оксигенированной крови. Есть и другое применение аппарата искусственного кровообращения – это регионарная перфузия.

Осложнения при искусственном кровообращении
Основные осложнения, которые могут возникнуть при использовании аппарата искусственного кровообращения это:
- Эмболия сосудов газами или тромбами;
- Гипоксия, нарушения микроциркуляции органов;
- Гематологические осложнения, нарушение свертываемости, фибринолиз.
Кардиоплегия
Большое значение в предупреждении воздушной эмболии имеет искусственная остановка сердца (кардиоплегия). Кардиоплегию применяют не только для предупреждения воздушной эмболии, а в основном для предупреждения гипоксических изменений в миокарде в период, когда прекращено коронарное кровообращение, и для создания удобств оперирующему на открытых полостях сердца хирургу. Кроме того, вследствие кардиоплегии удается уменьшить кровопотерю из операционной раны сердца, если во внутрисердечном периоде операции не включено коронарное кровообращение.
Экстракорпоральная мембранная оксигенация (ЭКМО, ЭМО) — инвазивный экстракорпоральный метод насыщения крови кислородом (оксигенации) при развитии тяжёлой острой дыхательной недостаточности. Используется в кардиологии при острой сердечной недостаточности и для поддержания жизнедеятельности при проведении операции на открытом сердце совместно с аппаратом искусственного кровообращения.
История
Впервые метод экстракорпоральной оксигенации был применён в 1952 году в Великобритании у больного с дыхательной недостаточностью. В 1953 году впервые успешно проведена операция на открытом сердце с искусственной перфузией и оксигенацией крови. В 1965 году пузырьковый оксигенатор впервые использован у новорождённого, умирающего от дыхательной недостаточности. В 1969 году группой врачей под руководством T.G.Baffes впервые использован мембранный оксигенатор для искусственного кровообращения у детей. В 1970 году компания Avecor создала мембранный оксигенатор, ставший прообразом всех современных аппаратов ЭКМО.
Механизм
Для проведения ЭКМО к больному подсоединяют мембранный оксигенатор. Существует два способа подключения — вено-артериальная канюляция (ВАК) и вено-венозная канюляция (ВВК). При ВАК кровь забирается из венозного русла, очищается, насыщается кислородом и подаётся в артериальное русло. ВАК рекомендуется к применению у новорождённых, а также у взрослых с компенсированным инфарктом миокарда. При ВВК кровь забирается и возвращается в венозное русло. ВВК может применяться у взрослых с изолированным поражением лёгких. Для соблюдения физиологических механизмов забор и вливание крови осуществляется максимально близко к сердцу. ВАК предпочтительнее, так как при этом способе не происходит смешивание артериальной и венозной крови. ВВК требует вдвое большую поверхность мембран оксигенатора, поэтому на практике данный способ применяется реже.
При проведении процедуры новорождённым для компенсации объёма крови, циркулирующего в аппарате, используется донорская кровь.
ЭКМО является симптоматической терапией, не устраняющей фактор развития заболевания.
Возможные осложнения и недостатки
Использование донорской крови может вызвать аллергическую реакцию и привести к развитию шока. Кроме того, для исключения свёртывания крови в аппарате на протяжении всего времени использования ЭКМО пациенту вводят антикоагулянты, что может спровоцировать тромбоцитопению, кровоизлияния в головной мозг и в полости в месте канюляции, усиленный гемолиз. Недостаточность или неэффективность антикоагулянтов может привести к тромбообразованию и закупорке механизмов аппарата ЭКМО. Неисправность аппарата может вызвать воздушную эмболию сосудов, отказ аппарата фатален для пациента.
Главными недостатками метода являются необходимость наличия дорогостоящего оборудования, высококвалифицированного персонала и высокая стоимость процедуры.
Доктор БОСТИ рекомендует высококачественные оксигенаторы от Medos HiLite® .
![]()
Надежность. Превосходная работа и практическая функциональность.
Постоянный и равномерный уровень обмена газов крови является залогом максимальной безопасности наших пациентов. Немецкое качество. Модели оксигенаторов производятся со стандартными микропорами или с инновационными плазменными тонкими волокнами, используемых в оксигенаторах длительного использования. Все модели оксигенаторов MEDOS имеют следующие преимущества:
– Исключительный трансфер газа.
– Низкий обьем заполнения.
– Оптимизированный поток крови, газа и жидкости.
– Компактная, простая в сборке конструкция.
Купить оксигенатор Medos производства Германии Вы можете обратившись к менеджеру-консультанту Акжолу Марасулову (+996 555 710 885).
Искусственное сердце: классика и инновации
Поделиться:
22 августа 2018 года исполняется 98 лет со дня рождения Дентона Кули, человека, впервые пересадившего пациенту искусственное сердце, и 49 лет со дня самой операции. Что изменилось в кардиотрансплантологии за последние полвека?
Что такое «искусственное сердце»
Искусственным сердцем сегодня называют два довольно разных типа аппаратов. Оба они, разумеется, выполняют насосную функцию, «качая» кровь по человеческому телу. Однако аппараты первого типа — так называемые АИКи (аппарат искусственного кровообращения) — это большие машины, используемые во время операций на сердце. Фактически они представляют собой комплекс «сердце-легкие», так как состоят из собственно насоса, качающего кровь, и оксигенатора, снабжающего эту кровь кислородом.
Второй тип — это кардиопротез, т. е. такое устройство, которое может выполнять функции сердца после имплантации в организм человека. Именно такой аппарат был впервые пересажен больному в 1969 году Дентоном Кули — как временная мера, пока пациент дожидается подходящего донорского сердца. Тогда пациент прожил после операции 65 часов — и это уже был успех.
Главные проблемы
Сложностей в таком деле, как конструирование искусственного органа, конечно, немало. Но среди них можно выделить две основных проблемы. Первая — это источники энергии: сердце-то внутри, а батарейки должны быть снаружи, чтобы их можно было менять без привлечения хирургической бригады.
Провод, соединяющий батарею и механизм, служит отличной «дорогой» для патогенных микроорганизмов, вызывающих разного рода инфекции. Кроме того, сами батарейки очень крупные — целый рюкзак на спине больного, с которым приходится быть неразлучным.
Вторая — это тромбообразование. Даже пациентам, у которых всего один синтетический клапан в родном биологическом сердце, приходится пожизненно принимать лекарства, снижающие свертываемость (варфарин, ривароксабан). Когда же всё сердце синтетическое, вероятность тромботических осложнений возрастает в десятки раз.
Полностью эта проблема сейчас не решена, но существует компромиссное решение: искусственные сердца выбрасывают кровь не толчками, как «природные», а сплошным непрерывным потоком. В таком потоке отсутствуют турбулентные завихрения, и тромбы образуются заметно реже.
Сам себе батарейка

От проводов, идущих снаружи внутрь, пока избавиться не удается, хотя идеи на этот счет имеются очень интересные. Например, была попытка организации подзарядки непосредственно через кожу пациента. Однако разность потенциалов приводит к развитию сильных дерматитов. Для решения этой проблемы сейчас разрабатывают специальные защитные гели (которые одновременно могут улучшать проводниковые свойства кожи).
А вот для того, чтобы избавиться от тяжелого рюкзака с аккумуляторами, изобретатели предложили весьма изящное решение. Пациент надевает на ногу специальный экзопротез (внешне он похож на ортезы, которые носят люди с травмированным коленом), в который вмонтирован генератор.
Во время ходьбы механическая энергия трансформируется в электричество, которое и обеспечивает работу механического сердца. Можно сказать, что Жванецкий в своей старой миниатюре предсказал появление этого устройства — когда предлагал прицепить к балерине динамо-машину для выработки электричества.
Из материала заказчика

Не отстают и биотехнологии — в частности, выращивание органов из стволовых клеток пациента. У сердца есть одно преимущество перед многими другими органами: в нем не так много различных типов клеток. Но, с другой стороны, сложность в том, что основная масса клеток сердца — сократительные кардиомиоциты — должна быть расположена в одном направлении. Ведь, синхронно сокращаясь, они должны вызывать одно мощное движение, а не картину «лебедь, рак и щука».
Читайте также:
Органы, выращенные в чашке Петри
Ученые Университета Торонто заняты созданием каркаса такой формы, которая позволит верно «сориентировать» кардиомиоциты еще в процессе роста. Одна из последних разработок — каркас в виде сот. Изобретателям удалось вырастить в «сотах» три соединенных вместе слоя сердечных мышечных клеток, которые под воздействием электрического импульса начали синхронно биться — как настоящее сердце. Предполагается, что сам каркас будет биодеградируемым — т. е. через некоторое время после пересадки распадется внутри организма на естественные для него метаболиты.
Пока еще искусственные сердца пересаживают людям только в качестве временной меры — в ожидании подходящего донорского. Но, судя по развитию технологий, в будущем нас ожидает возможность вырастить каждому человеку «запасное» сердце по индивидуальному проекту.
Товары по теме : [product strict=” Варфарин”]( Варфарин), [product strict=” Ксарелто”]( Ривароксабан)
Аортокоронарное шунтирование (АКШ)
Страница посвящена хирургическому лечению ишемической болезни сердца. Операция называется “аортокоронарное шунтирование”.
Эта операция является самым эффективным методом лечения ИБС и позволяет пациентам вернуться к нормальной активной жизни.
Пациенты часто чувствует себя намного лучше после перенесенной операции на коронарных артериях, так как их больше не беспокоят симптомы ишемической болезни сердца. Пациенты испытывают постепенное улучшение самочувствия после операции, так наиболее значимые изменения в их состоянии происходят после нескольких недель или месяцев.
Что необходимо знать каждому пациенту об операции АКШ
 Коронарные артерии сердца.
Коронарные артерии сердца.- Заболевания коронарных артерий (ИБС).
- Сигнальные симптомы.
- Диагностика заболеваний коронарных артерий.
- Как лечится ИБС.
- Аортокоронарное шунтирование (АКШ).
- Артерии и вены применяемые для шунтирования.
- Разновидности коронарного шунтирования.
- АКШ c искусственным кровообращением.
- АКШ без искусственного кровообращения.
- Этапы кардиохирургического лечения.
- До хирургического вмешательства.
- Операция.
- Послеоперационный период.
- Реабилитация.
Болезнь коронарных артерий (одно из проявлений клиники общего атеросклероза), приводит к недостаточному снабжению кровью сердечной мышцы и, как следствие, к ее повреждению. В настоящее время число больных, страдающих от ИБС, постоянно увеличивается – миллионы людей в мире болеют ею.
Десятилетиями терапевты и кардиологи пытались улучшить снабжение сердца кровью при помощи лекарственных препаратов, расширяющих коронарные артерии.
Аортокоронарное шунтирование (АКШ) – это общепринятый хирургический способ лечения заболевания. Данный метод уже давно подтвердил свою безопасность и эффективность. За десятилетия накоплен большой опыт и достигнуты значительные успехи в выполнении этих операций. АКШ является сегодня широко распространенной и достаточно простой операцией.
Постоянное совершенствование хирургической техники и применение последних достижений медицины, позволяет хирургам выполнять операции с меньшей травмой для пациента. Все это способствует уменьшению длительности пребывания пациента на больничной койке и ускоряет его выздоровление.
Как лечится ИБС
Каждый год растет число пациентов с ИБС, которым необходимо лечение, направленное на увеличение кровотока к сердечной мышце. Это лечение может включать медикаментозную терапию, ангиопластику или хирургическое вмешательство.
Лекарственные препараты способствуют дилятации (расширению) коронарных артерий, увеличивая, таким образом, доставку кислорода (через кровь) к окружающим тканям сердца. Ангиопластика – это процедура, при которой используется катетер, который раздавливает бляшку в артерии. Также в артерию после ангиопластики можно установить маленькое устройство, которое называется стент. Этот коронарный стент дает уверенностью в том, что артерия останется открытой.
Коронарное шунтирование (АКШ) – это хирургическая процедура, направленная на восстановление кровоснабжения миокарда. Суть ее будет изложена ниже.
Аортокоронарное шунтирование (АКШ)
АКШ – это хирургическое вмешательство, в результате которого восстанавливается кровоток сердца ниже места сужения сосуда. При этой хирургической манипуляции вокруг места сужения создают другой путь для кровотока к той части сердца, которая не снабжалась кровью.
Разрез, обеспечивающий доступ к сердцу, будет выполнен по середине грудной клетки, он пройдёт по средней линии грудины. Второй разрез или разрезы, обычно выполняют на ногах. Именно там хирурги возьмут отрезок вены, которая будет использована для шунтирования.
Вены с ног берутся не во всех случаях, но очень часто. Дело в том, что вены ног обычно бывают относительно “чистыми”, не пораженными атеросклерозом.
Кроме того, эти вены длиннее и крупнее чем иные доступные для взятия вены организма. Наконец, после взятия отрезка вены с ноги обычно не возникает каких либо проблем в дальнейшем. Кровообращение не нарушается.
В первые недели после операции у больного может немного побаливать нога, особенно при ходьбе или длительном стоянии. Со временем это неудобство проходит, и больной чувствует себя совершенно нормально.
Наиболее частым и предпочтительным для шунтирования используется внутренняя грудная и лучевая артерии. Это обеспечивает более полноценное функционирование шунта (его функциональность и долговечность).
Одной из таких артерий является лучевая артерия руки, она располагается на внутренней поверхности предплечья ближе к большому пальцу.
В случае, если Вам предложат использовать данную артерию, Ваш доктор проведет дополнительные исследования, исключающие возникновение каких-либо осложнений, связанных с забором данной артерии. Поэтому один из разрезов может располагаться на руке обычно на левой.
Внутренняя грудная артерия берется из под грудины, обычно левая, но в некоторых случаях используются правая и левая ВГА. Достаточный ее диаметр и отсутствие атеросклеротического поражения определяется при проведении коронарографии.
Разновидности коронарного шунтирования
- С применением искусственного кровообращения.
- Без искусственного кровообращения, с применением “стабилизатора” для шунтирования.
- Применение минимальных хирургических разрезов, в том числе и эндоскопические операции.
Выбор оперативного вмешательства определяется после проведения коронарографии и экспертной оценки степени поражения коронарных артерий сердца.
При мультифокальном поражении коронарных артерий сердца, в том числе, в случаях сочетанной патологии сердца (наличие постинфарктной аневризмы левого желудочка, врожденного или приобретенного порока сердца, требующего хирургической коррекции), операции проводятся исключительно с применением искусственного кровообращения.
Преимущества выполнения АКШ через меньший разрез
- Лучшая возможность для пациента откашливаться и глубже дышать после операции.
- Меньше кровопотеря.
- Пациент испытывает меньшие болевые ощущения и дискомфорт после операции.
- Снижается вероятность инфицирования.
- Более быстрое возвращение к нормальной активности.
АКШ с искусственным кровообращением
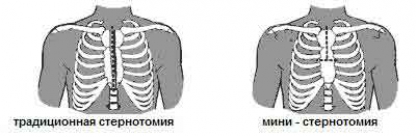
Традиционное АКШ выполняется путем срединной стернотомии (разрез на середине груди). Во время выполнения операции сердце может быть остановлено.
Для осуществления искусственного кровообращения (остановка сердечной деятельности) к сердцу присоединяются канюли, которые соединяются с контуром аппарата искусственного кровообращения.
На период основного этапа операции вместо сердца будет работать аппарат сердце-легкие (аппарат искусственного кровообращения), который обеспечивает кровообращение во всем организме. Кровь пациента поступает в аппарат искусственного кровообращения, где происходит газообмен, кровь насыщается кислородом, и далее по трубкам доставляется пациенту.
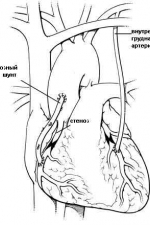 Кроме того, кровь при этом фильтруется, охлаждается или согревается для поддержания требуемой температуры пациента. В период искусственного кровообращения хирург создает анастамоз между веной и коронарной артерией ниже её стеноза. Затем восстанавливается сердечная деятельность и противоположный конец вены пришивается к аорте.
Кроме того, кровь при этом фильтруется, охлаждается или согревается для поддержания требуемой температуры пациента. В период искусственного кровообращения хирург создает анастамоз между веной и коронарной артерией ниже её стеноза. Затем восстанавливается сердечная деятельность и противоположный конец вены пришивается к аорте.
После шунтирования всех коронарных артерий постепенно прекращают искусственное кровообращение. Операция шунтирования коронарных артерии обычно продолжается от 3 до 6 часов.
Продолжительность операции зависит от её сложности и индивидуальных особенностей пациента. Поэтому невозможно заранее точно сказать, сколько времени продлится та или иная операция. Закономерно, чем больше артерий необходимо шунтировать, тем дольше будет длиться операция.
Без искусственного кровообращения
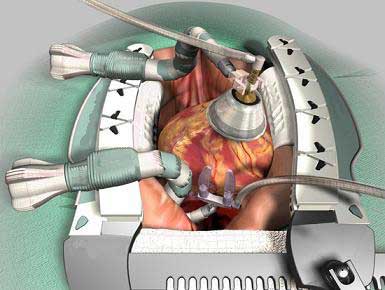 Хорошая хирургическая техника и медицинское оборудование позволяют хирургу выполнять АКШ на работающем сердце. При этом можно обойтись без применения искусственного кровообращения при традиционной хирургии на коронарных артериях.
Хорошая хирургическая техника и медицинское оборудование позволяют хирургу выполнять АКШ на работающем сердце. При этом можно обойтись без применения искусственного кровообращения при традиционной хирургии на коронарных артериях.
Для выполнения такой операции применяется специальное оборудование, позволяющее уменьшить колебания сердца при шунтировании коронарных артерий.
Для анастамозов применяется вена, либо внутренняя грудная артерия.
В этом случае искусственное кровообращение не используется. В последние годы наиболее часто применяются минимальные хирургические разрезы (различной локализации).
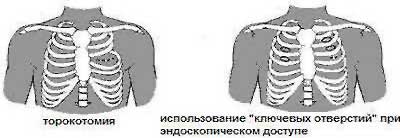
Преимущества операций АКШ без искусственного кровообращения
- Меньшая травма крови.
- Снижение риска развития вредных эффектов ИК.
- Более быстрое возвращение к нормальной активности.
Этапы кардиохирургического лечения
Кардиолог в стационаре помогает пациенту понять суть операции и объясняет пациенту, какие этапы лечения необходимо будет пройти.
Однако в различных стационарах существуют разные протоколы индивидуальной работы с пациентом. Поэтому пациент должен сам, не стесняясь любых вопросов, просить сестру или врача помочь ему разобраться в сложных вопросах операции и обсудить с ними те проблемы, которые его больше всего волнуют.
Стоимость шунтирования сердца
Операция аортокоронарного шунтирования относится к разряду дорогостоящей высокотехнологичной медицинской помощи, соответственно и стоимость шунтирования при проведении этой операции в кардиоклинике может варьироваться в зависимости от сложности самой операции для конкретного пациента и от комфорта, который предоставляется пациенту после операции АКШ. Шунтирование сердца, стоимость которого колеблется в диапазоне от 130 до 400 тысяч рублей, может проводиться как в специализированных коммерческих клиниках, так и на отделениях больниц кардиологического профиля.
Многие пациенты, проживающие в Санкт-Петербурге, нуждаются в плановом или экстренном проведении аортокоронарного шунтирования, и, как правило, один из вопросов, которые они задают врачам: «Сколько стоит шунтирование сердца?».
В городской больнице №40 Курортного района Санкт-Петербурга операция АКШ может быть проведена пациентам в экстренном или плановом порядке за счет средств регионального или федерального бюджетов. Единственное ограничение для пациентов – дорогостоящая (высокотехнологичная) медицинская помощь, к которой относится аортокоронарное шунтирование, осуществляется при наличии строгих медицинских показаний и на основании полученной пациентом квоты.
Стоимость консультаций специалистов вы можете уточнить в отделе платных услуг по телефонам:
- для физических лиц: (812) 437-11-00 и +7 911 766-97-70;
- для юридических лиц: (812) 437-35-22 и +7 921 413-58-87
Клиника Ихилов в Израиле
(495) 506 61 01
Клиника Ихилов в Израиле ¦ Кардиохирургия в клинике Ихилов ¦ Операции на сердце без применения аппарата искусственного кровообращения
Операции на сердце без применения аппарата искусственного кровообращения
Аппарат искусственного кровообращения (аппарат «искусственное сердце — легкие») — специальное медицинское оборудование, обеспечивающее жизнедеятельность человека при частичной или полной невозможности выполнения функций сердца и/или лёгких.
Данное устройство призвано обеспечивать кровообращение во всём организме в то время как сердце полностью выключается из кровотока, для того, чтобы хирургу было легче осуществить на нём все необходимые манипуляции.
Искусственное кровообращение не лишено своих недостатков, и способно отрицательно влиять на некоторые ткани и органы человека.
К числу побочных эффектов аппарата искусственного кровообращения относят нарушения мозговой деятельности, свёртывающей системы крови, почечную недостаточность, воспалительные процесс, тенденцию к снижению когнитивного восприятия в постоперационный период.
В клинике Ихилов (Сураски) в Израиле, благодаря совершенствованию хирургической и анестезиологической техники и модернизации медицинского оборудования, стало возможным выполнять операцию аортокоронарного шунтирования на работающем сердце, обходясь без применения аппарата искусственного кровообращения.
Во время проведения хирургических вмешательств по шунтированию на бьющемся сердце деятельность его не нарушается. Врач накладывает эластичный шов впереди и позади зоны шунтирования и, таким образом, освобождает от крови область операции, чтобы достичь максимальной точности выполнения процедуры. В ряде случаев может потребоваться наложение коронарного шунта, чтобы перевести кровообращение в дистальную часть венечной артерии.
У таких операций на работающем сердце обнаружились существенные преимущества в связи со снижением среднего возраста кандидатов на шунтирование и повышенным числом сопутствующих соматических заболеваний. Сейчас специалисты всего мира пришли к выводу, что данная тактика наиболее оптимальна для пациентов с диагностируемым атеросклерозом аорты и для лиц старше семидесяти пяти лет.
При наличии новоустановленной закупорки коронарных сосудов, при патологии деятельности сердца и почек эта тактика тоже считается более рациональной, так как от подключения к аппарату искусственного кровообращения здесь лучше воздержаться.
Относительно недавно было доказано, что коронарное шунтирование на бьющемся сердце снижает риск постоперационных осложнений у больных сахарным диабетом.
(495) 506-61-01 – срочная организация лечения в Израиле
| Диагностика сердечных заболеваний – клиника Ихилов |
| Заболевания сердечно-сосудистой системы – причины |
| Болезни сердечно сосудистой системы – симптомы |
| Профилактика заболеваний сердца |
| Лечение сердца – методы лечения сердца в Израиле |
| Миниинвазивные операции на сердце – клиника Ихилов |
| Рентгеноэндоваскулярная хирургия – клиника Ихилов |
| Радиочастотная абляция – клиника Ихилов |
| Искусственный водитель ритма – клиника Ихилов |
| Коронарная ангиопластика – клиника Ихилов |
| Баллонная ангиопластика – клиника Ихилов |
| Эксимерная лазерная ангиопластика – клиника Ихилов |
| Чрескожные коронарные вмешательства – клиника Ихилов |
| Стентирование коронарных артерий – клиника Ихилов |
| Аортокоронарное шунтирование – клиника Ихилов |
| Миниинвазивное аортокоронарное шунтирование – клиника Ихилов |
| Операции на сердце без применения аппарата искусственного кровообращения |
| Операции на клапанах сердца – клиника Ихилов |
| Пороки сердца – лечение в Израиле |
| Аппарат искусственного кровообращения – лечение в Израиле |
| Искусственные клапаны сердца – лечение в Израиле |
| Кава-фильтр – лечение в Израиле |
| Протезирование аортального клапана – клиника Ихилов |
| Операция Росса – хирургия клапанов сердца в Израиле |
| Стеноз аортального клапана – малоинвазивное лечение в Израиле |
| Транскатетерная имплантация аортального клапана в Израиле |
| Эндоваскулярное протезирование аортального клапана в Израиле |
| Протезирование митрального клапана – клиника Ихилов |
| Митральная комиссуротомия – клиника Ихилов |
| Операции на трёхстворчатом клапане – клиника Ихилов |
| Инфекционный эндокардит – лечение в Израиле |
| После операции на клапанах сердца – клиника Ихилов |
| Аневризма грудной аорты – лечение в Израиле |
| Гипертрофическая кардиомиопатия – лечение в Израиле |
| Стволовые клетки в лечении болезней сердечно-сосудистой системы |
| Атеросклероз – лечение стволовыми клетками в Израиле |
| Артериальная гипертензия – лечение стволовыми клетками в Израиле |
| Мерцательная аритмия – лечение стволовыми клетками в Израиле |
| Стенокардия – лечение стволовыми клетками в Израиле |
| Миокардиодистрофия – лечение стволовыми клетками в Израиле |
| Миокардит – лечение стволовыми клетками в Израиле |
| Миокардиосклероз – лечение стволовыми клетками в Израиле |
| Сердечная недостаточность – лечение стволовыми клетками в Израиле |
| Ишемия сердца – лечение стволовыми клетками в Израиле |
| Инфаркт мозга – лечение стволовыми клетками в Израиле |
| Геморрагический инсульт – лечение стволовыми клетками в Израиле |
| Инфаркт миокарда – лечение стволовыми клетками в Израиле |
| Врождённый порок сердца – лечение стволовыми клетками в Израиле |
.jpg)
Кардиохирургия в клинике Ихилов
В центре кардиохирургии госпиталя Сураски (Ихилов) проводятся все виды кардиохирургического лечения как у детей. так и у взрослых. Подробнее
.jpg)
Онкологический центр Ихилов
Онкологический центр при Тель-Авивском медцентре им. Сураски (Ихилов) функционирует с 2005-го года и является в настоящее ведущим среди подобных учреждений во всем Израиле. Команда опытнейших, высококвалифицированных специалистов, имеющих за плечами не менее, чем 20-летний стаж работы, под руководством всемирно известного профессора онкологии Моше Инбара добивается хороших результатов в лечении даже самой сложной, тяжелой онкопатологии. Подробнее
.jpg)
Департамент нейрохирургии медицинского центра Ихилов
Основано это отделение было еще в 1964-м году для оказания специализированной нейрохирургической помощи как израильтянам, так и иностранным пациентам. Ежегодно здесь проводится более 2,5 тысяч нейрохирургических операций у детей и взрослых. Руководит отделением нейрохирург с мировым именем – проф. Цви Рам. Подробнее
Лечение в Москве и за рубежом
-
- Детская больница в Москве
- Лечение в Германии
- Клиники Германии
- Ортопедическая клиника КАССЕЛЬ
- Лечение в Израиле
- Медицина Израиля – МЦ IMedical
- Клиники Израиля
- Лечение в Швейцарии
- Стоматологи Израиля
- Университетская клиника Цюриха
- Лечение в Австрии
- Малоинвазивная хирургия позвоночника
- Университетская клиника Тюбинген
- Гастроэнтерология в клинике Ихилов
- Урология в клинике Ихилов
- Эндокринология в клинике Ихилов
- Гематология в клинике Ихилов
- Дерматология в клинике Ихилов
- Кардиохирургия в клинике Ихилов
- Диагностика сердечных заболеваний – клиника Ихилов
- Заболевания сердечно-сосудистой системы – причины
- Болезни сердечно сосудистой системы – симптомы
- Профилактика заболеваний сердца
- Лечение сердца – методы лечения сердца в Израиле
- Миниинвазивные операции на сердце – клиника Ихилов
- Рентгеноэндоваскулярная хирургия – клиника Ихилов
- Радиочастотная абляция – клиника Ихилов
- Искусственный водитель ритма – клиника Ихилов
- Коронарная ангиопластика – клиника Ихилов
- Баллонная ангиопластика – клиника Ихилов
- Эксимерная лазерная ангиопластика – клиника Ихилов
- Чрескожные коронарные вмешательства – клиника Ихилов
- Стентирование коронарных артерий – клиника Ихилов
- Аортокоронарное шунтирование – клиника Ихилов
- Миниинвазивное аортокоронарное шунтирование – клиника Ихилов
- Операции на сердце без применения аппарата искусственного кровообращения
- Операции на клапанах сердца – клиника Ихилов
- Пороки сердца – лечение в Израиле
- Аппарат искусственного кровообращения – лечение в Израиле
- Искусственные клапаны сердца – лечение в Израиле
- Кава-фильтр – лечение в Израиле
- Протезирование аортального клапана – клиника Ихилов
- Операция Росса – хирургия клапанов сердца в Израиле
- Стеноз аортального клапана – малоинвазивное лечение в Израиле
- Транскатетерная имплантация аортального клапана в Израиле
- Эндоваскулярное протезирование аортального клапана в Израиле
- Протезирование митрального клапана – клиника Ихилов
- Митральная комиссуротомия – клиника Ихилов
- Операции на трёхстворчатом клапане – клиника Ихилов
- Инфекционный эндокардит – лечение в Израиле
- После операции на клапанах сердца – клиника Ихилов
- Аневризма грудной аорты – лечение в Израиле
- Гипертрофическая кардиомиопатия – лечение в Израиле
- Стволовые клетки в лечении болезней сердечно-сосудистой системы
- Атеросклероз – лечение стволовыми клетками в Израиле
- Артериальная гипертензия – лечение стволовыми клетками в Израиле
- Мерцательная аритмия – лечение стволовыми клетками в Израиле
- Стенокардия – лечение стволовыми клетками в Израиле
- Миокардиодистрофия – лечение стволовыми клетками в Израиле
- Миокардит – лечение стволовыми клетками в Израиле
- Миокардиосклероз – лечение стволовыми клетками в Израиле
- Сердечная недостаточность – лечение стволовыми клетками в Израиле
- Ишемия сердца – лечение стволовыми клетками в Израиле
- Инфаркт мозга – лечение стволовыми клетками в Израиле
- Геморрагический инсульт – лечение стволовыми клетками в Израиле
- Инфаркт миокарда – лечение стволовыми клетками в Израиле
- Врождённый порок сердца – лечение стволовыми клетками в Израиле
- Бесплодие – лечение в клинике Ихилов
- Нефрология в клинике Ихилов
- Ортопедия в клинике Ихилов
- Патология и цитология в клинике Ихилов
- Ревматология в клинике Ихилов
- Трансплантация органов в клинике Ихилов
- Челюстно-лицевая хирургия в клинике Ихилов
- Пульмонология в клинике Ихилов
- Флебология в клинике Ихилов
- Сосудистая хирургия в клинике Ихилов
- Общая хирургия в клинике Ихилов
- Интенсивная терапия в клинике Ихилов
- Лечение наркомании в клинике Ихилов
- Цитогенетика в клинике Ихилов
- Отоларингология в клинике Ихилов
- Онкология в клинике Ихилов
- Нейрохирургия в клинике Ихилов
- Педиатрия в клинике Ихилов
- Пластическая хирургия в клинике Ихилов
- Стоматология и имплантология в клинике Ихилов
- Родильный дом в клинике Ихилов
Оформить заявку на лечение
Данный интернет-сайт носит исключительно информационный характер и ни при каких условиях не является публичной офертой, определяемой положениями Статьи 437 (2) Гражданского кодекса Российской Федерации
Эндоваскулярное протезирование аортального клапана (TAVI)
Транскатетерное эндоваскулярное (внутрисосудистое) протезирование аортального клапана (также — транскатетерная имплантация аортального клапана или TAVI) — это процедура замены аортального клапана при его критическом стенозе (сужении) доступом через бедренную артерию под местной анестезией.
При нормально функционировании, обогащённая кислородом и питательными веществами кровь из сердца поступает в аорту, откуда по ветвям аорты (артериям) кислород доставляется всем органам и тканям. Аортальный клапан находится на выходе из сердца и обеспечивает кровоток только в одном направлении — от сердца к аорте. Сужение, или стеноз аортального клапана приводит к значительному затруднению работы сердца. Известные на сегодняшний день статистические данные говорят о том, что без проведения операции средняя ежегодная летальность больных с симптомами аортального порока составляет около 10%.
операция, пребывание в стационаре, послеоперационное наблюдение лечащим врачом, медикаменты и питание
- декомпенсированный стеноз аортального клапана, требующий хирургического лечения.
- острые инфекционные заболевания;
- выраженные нарушения свертывающей системы крови;
- невозможность применения кровьразжижающих препаратов.
Причины аортального порока
Существует множество патологических состояний, которые со временем могут приводить к дегенеративным изменениям, отложению кальция на створках аортального клапана, изменению его функции.
Сердце человека способно некоторое время компенсировать нарушение кровообращения. Рано или поздно возникают клинические проявления: головокружение, одышка, обмороки, сердцебиение, синдром стенокардии. Консервативно (с помощью медикаментов) можно частично компенсировать состояние пациента, но не изменить его кардинально и не улучшит качество жизни..
Как выполняется протезирование аортального клапана в клинике ЦЭЛТ?
Эффективный метод лечения аортального порока — замена клапана искусственным биологическим протезом. Существует два способа такой операции – традиционный хирургический и эндоваскулярный (без разрезов грудной клетки).
Традиционно операция по замене аортального клапана уже многие годы выполняется открытым способом — то есть через вскрытие грудной полости. Операция проводится с исключением сердца пациента из системы кровообращения и использованием аппарата искусственного кровообращения (АИК). Однако технологии в медицине не стоят на месте. Несколько лет назад появилась новейшая малоинвазивная методика — транскатетерная имплантация аортального клапана (TAVI). В ряде случаев пациенту возможно выполнить протезирование аортального клапана именно таким способом.
Принцип операции эндоваскулярного протезирования аортального клапана похож на операции по стентированию и состоит в том, что доступом через бедренную артерию к месту поврежденного аортального клапана подводится специальный катетер с размещенным на его конце искусственным клапаном (биопротезом) в сложенном виде. Перед установкой этого искусственного клапана производят расширение просвета собственного аортального клапана с помощью специального баллона. Биопротез для TAVI представляет собой специально обработанный трехстворчатый клапан из бычьего перикарда, закрепленный в стенте (металлическом каркасе). Операция для пациента безболезненна, так как выполняется под наркозом. Существует два вида клапанов: баллон расправляющийся и саморасправляющийся.
Обычно TAVI выбирается в качестве метода лечения пациентов старше 75 лет с тяжелым аортальным стенозом, имеющих противопоказания к проведению открытой хирургической операции, но на сегодняшний день показания расширены и для пациентов с низким и средним хирургическим риском.
Каковы преимущества транскатетерной имплантации аортального клапана перед открытой операцией?
При внутрисосудистом протезировании аортального клапана отсутствуют большие разрезы, что значительно сокращает длительность послеоперационной реабилитации, уменьшает болевой синдром и исключает развитие осложнений, связанных с воспалением (нагноением) послеоперационных швов. К другим важным преимуществам TAVI можно отнести:
- Возможность выполнять операцию пациентам с высоким хирургическим риском, пожилым пациентам и пациентам с тяжелыми сопутствующими заболеваниями
- Небольшая продолжительность операции, уменьшенные операционные травмы.
- Операция проводится под местной анестезией (в некоторых случаях под наркозом)
- Отсутствие необходимости подключения к аппарату искусственного кровообращения и “выключения” сердца пациента
- Сокращение сроков нахождения в стационаре
- Низкий процент послеоперационных осложнений и быстрая адаптации после выписки из стационара
ПРОВЕДЕНИЕ ИСКУССТВЕННОГО КРОВООБРАЩЕНИЯ
Сборка аппарата искусственного кровообращения, как правило, занимает не более 15 мин, и экстракорпоральный контур может сохранять стерильность в течение недели. После заполнения контура растворами стерильность сохраняется только в течение 8 ч.
Таблица 32-2. Меры безопасности при проведении искусственного кровообращения Меры безопасности Частота использования, % Сигнал тревоги с датчика уровня 60-100 Сигнал тревоги с датчика уровня с остановкой насоса 34-80 Сигнал тревоги с датчика давления 84-94 Сигнал тревоги с датчика давления с остановкой насоса 35-75 Сигнал тревоги с датчика пузырьков 42-88 Сигнал тревоги с датчика пузырьков с остановкой насоса 62-63 Установка артериального фильтра 44-99 Использование предбайпассного фильтра 75-81 Установка фильтра на кислородной линии 81-95 Измерение насыщения кислородом венозной крови 75-76 Измерение насыщения кислородом артериальной крови 12-13 Анализатор потока кислорода в оксигенатор 43-53 Одноходовой клапан на дренажной линии 18-73 Батарейное электрообеспечение АИК 29-85 Альтернативное силовое обеспечение 36 Электрический генератор 28 Запасной артериальный насос 80 Запасное терморегулирующее устройство 97 Запасная подача кислорода 88-91 Экстренное освещение 62-91 Определение времени активированного свертывания (ВАС) до ИК 74-99 Определение ВСА во время ИК 83 Проверочный протокол до ИК 74-95 Прописанные протоколы 49-75 Регистрация особенностей перфузии 46 Регистрация неполадок аппаратуры 52
препятствует поступлению жидкости в ткани.
Как для заправки аппарата ИК, так и во время перфузии применяют антикоагу-лянты (гепарин натрия обязательно вводят больному перед подключением к аппарату ИК), ощелачивающие растворы (натрия бикарбонат), антифибринолитики [апротинин (трасилол*), аминокапроновую кислоту], корригирующие растворы электролитов (преимущественно калия хлорид). Для заправки аппарата ИК руководствуются данными табл. 32-3, в которой указан состав перфузата в зависимости от гематокрита, массы тела больного и заправочного объема аппарата ИК.
Цельную донорскую кровь для ИК в настоящее время не используют. Это не относится к заготовленной заранее аутокрови больного. При показаниях (низком исходном гематокрите) вводят в аппарат ИК эритроцитарную массу или отмытые эритроциты. Большинство перфузий в настоящее время проводят без использования препаратов красной крови.
Так называемая искусственная (голубая) кровь (соединения перфторанов) пока не нашла широкого применения в перфузиологии.
Минимально допустимый во время ИК гематокрит, отражающий степень гемо- дилюции, в разных клиниках оценивается по-разному. При обычных операциях (аортокоронарном шунтировании, операциях на клапанах сердца, коррекции сеп- тальных дефектов и др.) следует стремиться не уменьшать показатель гематокрита ниже 25-20%.
Корригирующие растворы (калия хлорид, натрия бикарбонат) занимают объем, не превышающий 100 мл. Если предполагаемый гематокрит будет ниже 25%, то в заправочный объем вводят эритроцитарную массу.
Перед подключением аппарата к пациенту выполняется ответственный этап — заполнение всех элементов экстракорпорального контура с удалением воздуха через артериальный фильтр в кардиотомический резервуар. Рекомендуют запол- Таблица 32-3. Заправка аппарата искусственного кровообращения Заправочный объем, мл Гематокритное число больного. % Примерный состав пе рфуэата.
7% КСІ, 3% гепарин Масса больного, кг 1200 22—44 45-64 65-85 86-106
107-120 12-23 24-40 41-56 57-70
>70 10-17 18-29 30-41 42-53 >53 10-19 20-29 30-38 >38 10-13 14-22 23-30 >30 10-16 17-23
>23 10-14 15-20 >20 1000 750 500 250 0 200 450 450 150 400 450 450
400 300 50 50 50 45 45 10 15 15 15 15 1,2 1,2 1,2 1,2 1,2 1400 21-41 42-62 63-83 84-103 104-120 10-23 24-38 39-53 54-68 9-82 >82 10-14
15-26 27-38 39-50 51-62 >62 10-16 17-26 27-35 36-44 >44 35 10-13 14-20 21-27
>22 1250 1000 750 500 250 0 150 300 450 450 450 100 200 300 400 400 400 250 400 60 60 55 55 50 50 10 10 15 15 15 20 1,4 1,4 1,4 1,4 1,4 1,4 1600 19-38 39-59 60-80 81-110 111-120 10-20 21-35 36-50 51-65 66-79 80-94 >94 10-12 13-23 24-38 39-47 48-59 60-70 >70 10-14 15-23 24-32 33-42 43-51 >51 10-16 17-24 25-32 33-40 >40 10-17 18-24 25-31
>31 10-13 14-19 20-25 >25 1500 1250 1000 750 500 250 0 50 275 350 450 450 450 450 180 320 500
650 750 85 170 320 70 70 65 65 60 60 50 6 8 11
19 22 1,6 1,6 1,6 1,6 1,6 1,6 1.6 1800 16-35 36-56 57-77 78-97 98-120 10-18
109-120 10-20 21-32 33-44 45-56 57-68 69-77 >79 10-11 12-20 21-29 30-39 40-49 50-57 >57 10-13 14-21 22-29 30-37 38-45 >45 10-14 15-21 22-28 29-35
>35 10-16 17-22 23-28 >28 1750 1500 1250 1000 750 500 250 0 150 250 360 450 450 450 450 65 215 355 400 600 700 815 115 160 315 415 75 75 75 70 70 70 65 65 5 9 11 14 16 19 22 24 1,8 1,8 1.8 1.8 1,8 1,8 1,8 1,8 2000 34-53 54-74 75-95 96-120 16-29 30-44 45-59 60-74 75-89 90-103 104-120 10-18 19-29 30-41 42-53 54-65 66-77 78-88 >88 10-17 18-27 28-36 37-45 46-55 56-64 >64 10-18 19-26 27-34 35-42 43-50 >50 10-11 12-18 19-25 26-32
33-39 >39 10-13 14-19 20-25 26-31
>31 1750 1500 1250 1000 750 500 250 0 155 400 450 450 450 450 450 450 250 400 550 700
950 150 250 350 500 85 85 85 80
70 8 11 14 16 19 22 25 27 2.0 2,0 20 2 0 2.0 2.0 2,0 2,0
ЇЕ ?9?Ш нять насосный сегмент трубки и оксигенатор, позволяя жидкости вытекать из венозного резервуара под действием силы тяжести и только потом, вставив трубку в роликовый насос, с его помощью заполнять весь экстракорпоральный контур.
Очень важным подготовительным моментом считается регулирование окклю-зии роликового насоса по перфузионному давлению — при рабочем давлении 200-250 мм рт.ст. создают его медленное падение (
ДЕФИБРИЛЛЯЦИЯ
ДЕФИБРИЛЛЯЦИЯ (лат. приставка de- извлечение, уничтожение + позднелат. fibrillatio быстрые сокращения мышечных волокон) — прекращение фибриллярных сокращений желудочков сердца или предсердий. Дефибрилляция желудочков — один из важнейших приемов реанимации. Его задача — восстановление эффективной сократительной деятельности желудочков. Дефибрилляция предсердий — терапевтическое мероприятие, целью которого является восстановление синусового ритма сокращений сердца.
Методы Дефибрилляции заключаются в воздействии на сердце сильным электрическим током (электрическая дефибрилляция, контршок, электроимпульсная дефибрилляция, электрическая деполяризация сердца), лекарственными препаратами и в их сочетанном применении.
Электрическая дефибрилляция — часть более общего понятия электроимпульсная терапия (см.), к-рая применяется для прекращения и других нарушений ритма сердца (пароксизмальной тахикардии, а также трепетания предсердий и желудочков).
Принципиально иной подход к решению проблемы предложил Н. Л. Гурвич (с 1939 по 1975 г.). В основе созданной им теории дефибрилляции сердца лежит представление о возбуждающем действии тока в соответствии с законом «сила—время». Это создало предпосылки для максимального ограничения силы и продолжительности электрического воздействия. Одиночный импульс тока, получаемый при разряде емкости через индуктивность, оказался весьма эффективным. В отличие от переменного тока, он не вызывал (даже при многократном применении) серьезных повреждений сердца и нарушений его сократительной функции (Л. Д. Крымский с соавт., 1957; А. Л. Сыркин и др., 1970). Дефибрилляторы системы Н. Л. Гурвича получили широкое распространение как в нашей стране, так и за рубежом. В клинике для устранения мерцания предсердий одиночный импульс тока был впервые применен А. А. Вишневским с соавт, в 1959 г., а для прекращения приступа пароксизмальной тахикардии В. Н. Семеновым в 1963 г. Метод электроимпульсной терапии широко используется не только в стационарах, но и в условиях скорой помощи.
Для лечения фибрилляции желудочков сердца применяют электрическую Д. При рецидивирующей фибрилляции электрическое воздействие комбинируют с массажем сердца (см.) и искусственной вентиляцией легких (см. Реанимация), введением в полость сердца или внутривенно (при эффективном массаже сердца) новокаинамида, аймалина или индерала. Одни лишь противоаритмические препараты при фибрилляции желудочков малоэффективны.
Электролечение наиболее эффективно и в отношении фибрилляции предсердий, однако при этом нарушении ритма используют и лекарственную терапию (см. Мерцательная аритмия). Большей частью противоаритмические препараты применяют не в ударных дозах для прекращения фибрилляции предсердий, а лишь для стабилизации синусового ритма, восстанавливаемого электроимпульсной терапией.
Возникновение фибрилляции желудочков является жизненным показанием к немедленному выполнению электрической Д. (исключение составляют хирургические операции с искусственным кровообращением, при которых фибрилляцию желудочков иногда вызывают намеренно). При промедлении более 2 мин. быстро нарастающая гипоксия приводит к падению тонуса сердца, фибрилляция становится «вялой» и для успешного восстановления сократительной способности миокарда перед воздействием разрядом необходим массаж сердца и другие реанимационные мероприятия. Если возникновению фибрилляции предшествовала артериальная гипотензия, восстановление эффективной сердечной деятельности после Д. становится затруднительным.
Показания к Д. предсердий устанавливают с учетом нарушений гемодинамики, вызванных мерцательной аритмией, резистентностью аритмии к сердечным гликозидам и противоаритмическим препаратам, наличием тромбоэмболий в анамнезе больного и его субъективными ощущениями.
При необходимости непосредственной Д. во время хирургической операции (допустимо любое положение больного на операционном столе) «сердечный» электрод дефибриллятора прижимают к обнаженному сердцу, другой, «наружный» — подкладывают под грудную клетку больного. Можно применять два сердечных электрода, сжимая ими сердце с противоположных сторон. При наружном (трансторакальном) воздействии больной должен лежать на спине. Один из наружных электродов прижимают к грудной клетке в правой подключичной области, другой — либо к области верхушки сердца, либо подкладывают под спину в области угла левой лопатки. Электроды должны быть обернуты несколькими слоями марли, смоченной физиологическим раствором, наружные электроды можно смазывать специальной электродной пастой.
Дозировку воздействий током подбирают индивидуально (см. таблицу).
При отсутствии эффекта после 1-го разряда его повторяют, увеличивая напряжение на 0,5—1 кв. При Д. желудочков анестезию не применяют, при лечении хрон, нарушении ритма проводят общую анестезию (чаще всего производными барбитуровой к-ты), применяют кратковременный электронаркоз.
При дефибрилляции желудочков возможны осложнения, связанные с воздействием тока: ожоги кожи или сердца непосредственно под электродами, асистолия желудочков различной этиологии. Ожоги возникают при неправильной подготовке и применении электродов. Вероятность остановки сердца тем больше, чем глубже гипоксия сердца, поэтому перед Д. гипоксию необходимо по возможности уменьшить. При электрической Д. предсердий возможны также постконверсионные нарушения ритма (экстрасистолия, узловой ритм, пароксизмальная тахикардия), иногда возникает фибрилляция желудочков и артериальная тромбоэмболия. При медикаментозных методах Д. предсердий (в особенности при применении хинидина) указанные осложнения наблюдаются чаще.
Для определения успешности Д. выполняют контрольную электрокардиограмму. Об эффективности Д. желудочков судят также по данным аускультации сердца и появлению пульса на периферических артериях.
Противопоказания к электроимпульсному лечению фибрилляции желудочков отсутствуют. Электроимпульсная Д. предсердий противопоказана лишь при наличии интоксикации наперстянкой, а также у больных, у которых само восстановление синусового ритма нежелательно.
Дефибрилляторы
Дефибрилляторы — аппараты, представляющие собой генераторы мощных высоковольтных электрических импульсов, предназначаемые для лечения тяжелых нарушений ритма сердца. Выходной импульс современных отечественных дефибрилляторов является биполярным, близким по форме к синусоиде; амплитуда первой полуволны импульса на 15—30% больше второй. В комплект аппарата входят электроды для непосредственного и трансторакального воздействия током на сердце.
Дефибриллятор включает: накопитель энергии (конденсатор), устройство заряда конденсатора, разрядную цепь со схемой формирования импульса. Некоторые модели дефибрилляторов дополнительно снабжены устройством для кардиосинхронизации (напр., отечественный — ДКИ-01), исключающим возможность нанесения разряда во время уязвимого периода сердечного цикла. Органы управления дефибриллятором обеспечивают возможность регулирования напряжения заряда конденсатора или энергии, получаемой пациентом при разряде. Специальная кнопка предназначена для включения разрядного тока через пациента. Сброс неиспользованного или остаточного заряда конденсатора в большинстве современных дефибрилляторов производится автоматически.
Питание дефибрилляторов осуществляют от осветительной сети переменного тока. В некоторых моделях (напр., в отечественном ДИ-03) предусмотрена возможность питания от автономных источников тока, а также от бортовой сети машины скорой медицинской помощи.
При работе с дефибриллятором следует соблюдать правила техники безопасности, разработанные применительно к эксплуатации высоковольтных установок.

 Читайте также:
Читайте также: 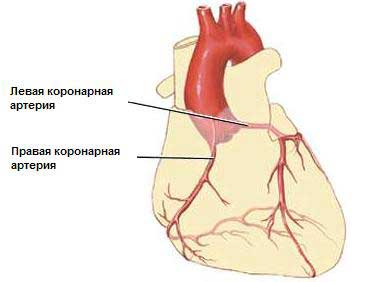 Коронарные артерии сердца.
Коронарные артерии сердца.
