КАРДИОПЛЕГИЯ
Кардиоплегия (греч. kardia сердце + plege удар; син. искусственная остановка сердца) — временное выключение сердца из кровообращения в целях создания обескровленного («сухого») операционного поля при операциях на открытых полостях сердца в условиях искусственного кровообращения.
Идея Кардиоплегии принадлежит советскому хирургу Н. Н. Теребинскому, который в 1940 г. в эксперименте для получения «сухого» операционного поля и остановки сердца сдавливал его рукой, пережимал аорту и правое предсердие, производил тампонаду нагнетанием воздуха в перикард.
Лишь в 1955 г. появились сообщения Мелроуза (D. G. Melrose) с соавт., Лэма (С. R. Lam) с соавт, о применении различных хим. препаратов для достижения К., Детерлинга (К. A. Deterling) — о методике ишемической остановки сердца, Шамуэя (N. E. Shumway) с соавт.— о коронарной перфузии охлажденной гепаринизированной кровью в клинике при операциях на открытом сердце. В 1956 г. Лиллехей (С. Lillehei) с соавт, сообщили о разработанной ими методике ретроградной перфузии венечных артерий оксигенированной кровью с различными хим. препаратами в целях К. В 1959 г. Шамуэй с соавт, разработал и применил в клинике методику Кардиоплегии орошением эпикарда холодным 5% р-ром глюкозы или 1% р-ром хлорида натрия. Первым из советских хирургов Кардиоплегию при операциях на открытом сердце применил А. А. Вишневский (1957).
Различают ишемическую, химическую и холодовую Кардиоплегию.
Ишемическая Кардиоплегия
Ишемическая Кардиоплегия достигается прекращением коронарного кровотока путем перекрытия аорты сразу же после отхождения венечных артерий. Это приводит к исчезновению АТФ и изменению потенциала межклеточных мембран. В результате ишемии гликолитический путь обмена становится единственным способом поддержания ресинтеза АТФ, к-рая идет прежде всего на активные процессы, происходящие в плазматической мембране и мембранных клеточных органоидах. Калий покидает клетку, натрий и хлор устремляются внутрь клетки, кальций выходит из саркоплазматического ретикулума; лизосомальных ферменты, оказавшиеся в цитоплазме, начинают аутолиз. Катаболические процессы преобладают над анаболическими. Это ведет к увеличению внутриклеточной осмолярности, внутриклеточному отеку.
Эти изменения развиваются в различные сроки ишемического периода, однако опасность их появления в постишемическом периоде наступает после 30 мин. ишемической К.
Ишемическая К. показана, когда требуется выключить сердце из кровообращения на короткий период (10—15 мин.).
Химическая Кардиоплегия
Химическая Кардиоплегия достигается введением р-ра различных хим. препаратов, вызывающих остановку сердца, непосредственно в венечные артерии. После окончания хим. К. применяемый препарат вымывается током крови.
Механизм хим. К. основан на блокировании потребления миокардом кислорода. Это позволяет удлинять срок ишемии сердца до 40—60 мин.
В качестве хим. препаратов для К. предложены: цитрат калия, хлорид калия, ацетилхолин, сульфат магния в сочетании с цитратом калия, цитратная кровь, мехолил с добавлением атропина, неостигмин, цитрат лития, цитрат натрия и др.
Использование хим. К. в клинике показало, что остановка сердца с помощью хим. препаратов в дозах, необходимых для длительной операции, вызывает тяжелое угнетение сократительной функции миокарда, что проявляется неустойчивой гемодинамикой в процессе восстановления сердечной деятельности. В послеоперационном периоде нарушение тонуса миокарда может вести к возникновению фибрилляции. Последнее удалось преодолеть коронарной перфузией р-ром, предложенным Брет-шнайдером в 1964 г. Он содержит 12 мэкв/л натрия, 7 мэкв/л калия, 2 мэкв/л магния, 28 мэкв/л хлора, 7 мэкв/л новокаина, 263 мэкв/л маннита. Однако и эта методика не удовлетворяла требованиям клиники, т. к. при повышении гидростатического давления в системе венечных сосудов (выше 40 мм рт. ст.) перфузия сердца приводит к отеку миокарда.
Разрабатывая метод хим. К., Кирш в 1972 г. предложил для непрерывной коронарной перфузии р-р, содержащий ионы магния, прокаин, ионы натрия, калия, кальция и др. в дозах, близких к минимально действенным концентрациям. Этим р-ром с кислородом и питательной средой достигается селективное прерывание сократительной способности миокарда без воздействия на другие процессы, необходимые для сохранения обмена веществ в покое.
Хим. К. по Бретшнайдеру и Киршу показана при операциях, требующих остановки сердца до 1,5— 2 час.
Холодовая Кардиоплегия
Своими классическими опытами А. А. Кулябко (1902) показал, что сердце хорошо сохраняет свои функц, свойства при содержании его в холоде до 2—3 сут. Как вспомогательное средство в кардиохирургии гипотермия была предложена Бигелоу (W. Bigelow) в 1950 г.


Холодовая К. представляет собой вариант ишемической, но отличается от нее тем, что гипотермия повышает толерантность тканей к гипоксии (см. Гипотермия искусственная). При гипотермии электрическая (рис. 1) и механическая активность сердца прекращается, резко понижается потребление миокардом кислорода (рис. 2). В результате уменьшается повреждающее действие аноксии на миокард остановленного сердца.
Холодовая К. достигается орошением выключенного из кровообращения сердца охлажденным до t° +4 — —5° физиол, р-ром. Это позволяет снижать и поддерживать температуру миокарда на уровне 17— 20°. Охлаждающий р-р с поверхности сердца удаляют электроотсосом.
Наружная холодовая Кардиоплегия показана при длительном (до 60 мин.) выключении сердца из кровообращения.
Метод коронарной перфузии оксигенированной кровью достигается путем прямой канюляции венечных артерий после аортотомии. Существуют многочисленные модели коронарных канюль. Разработаны специальные схемы изолированной коронарной перфузии с различными температурными режимами — нормотермическим и гипотермическим.
Адекватная энергетическим потребностям миокарда коронарная перфузия является наиболее физиологичным методом для поддержания жизнеспособности сердца. Она обеспечивает большие возможности для проведения сложных и длительных операций на открытом сердце и является методом выбора в большинстве кардиохирургических клиник.
Библиография: Бураковский В. И. и др. Опыт кардиоплегии при операциях с искусственным кровообращением, Грудн. хир., № 2, с. 26, 1963; Вишневский А. А. и др. Изолированная глубокая гипотермия сердца как метод искусственной кардиоплегии, Эксперим, хир. и анестезиол., № 3, с. 3, 1961; Пе т-ровский Б. В., Соловьев Г. М. и Бунятян А. А. Гипотермическая перфузия в хирургии открытого сердца, Ереван, 1967, библиогр.; Портной В. Ф. Защита миокарда в кардиохирургии и трансплантологии, Сб. науч. трудов Ин-та хир. им. Вишневского, с. 229, М., 1976; Теребинский H. Н. Материалы по изучению открытого доступа к атрио-вентрикулярным клапанам сердца, М.—Л., 1940, библиогр.; Аrnulf G. Resistance and tolerance of myocardium in ischemia, J. cardiovasc. Surg. (Torino), v. 16, p. 218, 1975; Bigelow W. GM Callaghan J. C. a. Hopps J. A. General hypothermia for experimental intracardiac surgery, Ann. Surg., v. 132, p. 531, 1950; Bjork V, O., Henze A. a. Szamosi A. Coronary ostial stenosis, Scand. J. thorac. cardiovasc. Surg., v. 10, p. 1, 1976; GonnJ. H. a. Colling J. Local cardiac hypothermia for myocardial protection, Ann. thorac. Surg., v. 17, p. 135, 1974; Kalmar P. a. o. Induced ischemic cardiac arrest, J. cardiovasc. Surg. (Torino), v. 16, p. 470, 1975; Lillehei C. W. a. o. The direct vision correction of calcific aortic stenosis by means of a pump-oxygenator and retrograde coronary sinus perfusion, Dis. Chest, v. 30, p. 123, 1956.
В. И. Бураковский, A. А. Краковский.
Способ осуществления кардиоплегии
Владельцы патента RU 2434589:
Изобретение относится к медицине, а именно к кардиохирургии, и может быть использовано при оперативных вмешательствах на открытом сердце с использованием кровяной кардиоплегии. Для этого перед проведением каждого сеанса кардиоплегии определяют концентрацию калия в плазме крови пациента. Скорость инфузии раствора калия определенной концентрации вычисляют по формуле СКИ=((((Кплегии-Кпациент)/10)·(СККП/100))/(0.134·К%))·60, где СКИ – скорость инфузомата с раствором калия в мл/ч; Кплегии – необходимая концентрация калия в растворе плегии, ммоль/л; Кпациент – плазменная концентрация калия пациента, ммоль/л; СККП – скорость кардиоплегии в мл/мин; К% – концентрация используемого калия в %; 0.134 – коэффициент перевода мг в моль. Способ позволяет повысить качество защиты миокарда на основном этапе операции, соблюдая при этом принцип низкокалиевой кардиоплегии, что предотвращает повреждающее действие высоких концентраций калия на миокард.
Способ относится к кардиологии, а именно к обеспечению длительных оперативных вмешательств на открытом сердце.
Наблюдаемый прогресс в кардиохирургии – операции реваскуляризации миокарда при множественном поражении коронарного русла, хирургическое лечение острого инфаркта миокарда, лечение пациентов с поражением клапанов сердца, неразрывно связаны с совершенствованием методов защиты миокарда во время основного этапа операции. Для обеспечения защиты используют кардиоплегию – любой способ обратимой остановки сердца. Это повышает устойчивость миокарда к ишемии и делает возможным работу на «бескровном» и неподвижном операционном поле. Разработано несколько способов осуществления кардиоплегии: ищемическая, холодовая и химическая. Для осуществления ишемической кардиоплегии прекращают коронарный кровоток [1]. Холодовая кардиоплегия – это когда в дополнение к ишемической кардиоплегии сердце орошают охлажденным физиологическим раствором для уменьшения повреждающего эффекта гипоксии [2]. Однако эти способы не обеспечивают достаточной защиты миокарда при длительных операциях [3].
В настоящее время операции на сердце в большинстве кардиохирургических центров проводятся в условиях искусственного кровообращения на фоне химической кардиоплегии (введение в венечные артерии сердца фармакологических средств: препаратов калия, ацетилхолина и др.). Такой способ остановки сердца обеспечивает достаточный уровень защиты миокарда от ишемического повреждения на длительный срок. Первая химическая кардиоплегия была проведена более 50-ти лет назад путем введения 10% (1300 ммоль/л) раствора цитрата калия, однократно болюсно в корень аорты во время ее пережатия и искусственного кровообращения. При этом кардиоплегический раствор попадал естественным путем, то есть антеградно, через коронарные артерии в миокард [4]. Это довольно простой и эффективный способ кардиоплегии, однако имеющий свои недостатки, связанные с повреждающим действием высоких (более 26 ммоль/л) концентраций калия на миокард и развития очаговых некрозов, а также развития синдрома малого выброса в раннем послеоперационном периоде у 25-30% пациентов [5].
Поэтому были разработаны принципы низкокалиевой кардиоплегии [6] и многокомпонентные кардиоплегические растворы, один из которых – St. Thomas solution – используется во многих центрах и по сей день. Было экспериментально доказано, что применение низкокалиевых кардиоплегических растворов более безопасно, чем высококалиевые растворы, что обеспечивало более высокий уровень защиты миокарда.
К 80 годам наиболее эффективной считалась фармакохолодовая кардиоплегия, при которой каждые 25-30 мин в коронарное русло струйно за 2-3 мин вводили 600-1500 мл охлажденного раствора разнообразных по составу прописей. Этот способ достаточно простой по выполнению, дешевый способ обеспечения защиты миокарда. Однако повторные сеансы кардиоплегии вызывают значимую гемодилюцию, повышение уровня калия плазмы к концу основного этапа, развитие опасных нарушений ритма в раннем послеоперационном периоде у 10-15% пациентов [7].
Для уменьшения количества осложнений и улучшения результатов защиты была разработана методика с использованием аутокрови больного в качестве кардиоплегической среды. Концепция применения крови в качестве носителя заключалась в следующем – идеальный буфер, снижение гемодилюции, превосходный переносчик кислорода, обладает лучшими осмотическими свойствами, физиологическими рН и электролитным составом, содержит ряд эндогенных антиоксидантов и поглотителей свободных радикалов, и, напоследок, кардиоплегический раствор на базе крови может быть достаточно просто приготовлен. Применение же низких доз калия не вызывает значимой гиперкалиемии в конце основного этапа операции, не выражено токсическое действие на миокард и эндотелий сосудов сердца.
Известен способ осуществления кардиоплегии, выбранный нами в качестве прототипа [8]. В нем в качестве плегической среды использовалась кровь больного, которая смешивалась с раствором калия в определенной пропорции и подавалась при помощи роликового насоса антеградно – естественным путем или ретроградно, то есть через коронарный синус при помощи специальной канюли. Первый сеанс (индукция) кардиоплегии длительностью 2-2.5 мин проводился после пережатия аорты и декомпрессии сердца (удаление крови из его полостей) из расчета 10 мл/кг веса пациента. Введение 10% раствора калия в кровь для кардиоплегии осуществлялось шприцевым инфузоматом с постоянной для данного сеанса скоростью в магистраль после роликового насоса. Затем через каждые 15 мин сеансы плегии повторялись. Объем повторных кардиоплегий составлял 750 мл, длительность 2.5 мин. Скорость шприцевого инфузомата с раствором калия снижалась перфузиологом от сеанса к сеансу от 300 до 100 мл/час [9].
Однако количество послеоперационных осложнений оставалось достаточно высоким. Это связано с тем, что невозможно управлять концентрацией калия в растворе плегии. Недостаточная концентрация калия в подаваемом растворе не вызовет остановки сердца, что повлечет за собой снижение качества защиты и некомфортные условия работы хирургов. Избыточная концентрация калия вызывает спазм коронарных сосудов, неравномерность реперфузии, прямое токсическое повреждение за счет перегрузки кардиомиоцитов кальцием. Повышенное (избыточное) содержание калия в кардиоплегии вызывает подъем плазменного калия выше физиологических величин, что вызывает отсроченное восстановление сердечной деятельности, нарушение ритма и проводимости, снижение контрактильности в раннем восстановительном периоде. В ряде случаев развивалась ятрогенная гиперкалиемия, что снижало качество защиты миокарда, и выражалось в необходимости назначения инотропной поддержки у 58% пациентов на 6 и более часов, увеличивало время нахождения на искусственной вентиляции легких (ИВЛ), удлинялось время пребывания пациентов в палате реанимации, составлявшее в среднем 37 часов.
Целью нашего изобретения является повышение качества защиты миокарда на основном этапе операции.
Это достигается тем, что перед проведением каждого сеанса плегии определяют концентрацию калия в плазме крови пациента, а требуемую скорость инфузии раствора калия определенной концентрации для достижения необходимого уровня калия крови кардиоплегического раствора вычисляют по формуле:
где СКИ – скорость инфузомата с раствором калия в мл/ч;
Кплегии – необходимая концентрация калия в растворе плегии, ммоль/л;
Кпациент – плазменная концентрация калия пациента, ммоль/л;
СККП – скорость кардиоплегии в мл/мин;
К% – концентрация используемого калия в %;
0.134 – коэффициент перевода мг в моль.
Считается, что для индукции необходима концентрация калия в кардиоплегическом растворе 16 ммоль/л, а для поддержания кардиоплегии 8-11 ммоль/л [6].
Это способствует более быстрому восстановлению насосной функции сердца, улучшению качества защиты миокарда во время основного этапа операции. Более гладко протекает ранний послеоперационный период. Это в свою очередь влечет за собой снижение потребности пациентов в инотропной поддержке, сокращает время пребывания пациента в отделении реанимации и стационаре.
Способ осуществляется следующим образом. Экстракорпоральное кровообращение проводится с помощью аппарата искусственного кровообращения (АИК) Shtokert S3 с использованием одноразовых мембранных оксигенаторов Quadrox (Medtronics). Подключение пациента к АИКу производится по стандартной схеме: кровь пациента через венозную канюлю или канюли дренируется в кардиотомный резервуар. Из кардиотомного резервуара роликовым насосом венозная кровь нагнетается в оксигенатор, где происходит обмен газами, кровь становится артериальной и через аортальную канюлю поступает в аорту. Корень аорты канюлируется канюлей с отводом (Jostra Root Cannula 9Fr), коронарный синус канюлируется ретроградной канюлей (Jostra Cardioplegia Cannula retrograde 14 Fr). Через них проводится антеградная и ретроградная плегии соответственно. На выходе из оксигенатора имеется порт, по которому через роликовый насос с определенной скоростью забирается артериальная кровь для проведения кардиоплегии. После кардиоплегического насоса в магистраль включены линии для мониторирования давления и подачи раствора калия. Концентрацию калия в артериальной крови пациента определяли на ионоанализаторе (Radiometer ABL800 FLEX). Для анализа отбирались пробы артериальной крови и на этапах отработки способа – парные пробы трансмиокардиальной крови для контроля уровня калия, подаваемого в коронарное русло. Исходя из плазменной концентрации калия, шприцевым инфузоматом Perfusor compact S (B.Braun Melsungen) (10) в кардиоплегическую магистраль с рассчитанной по формуле скоростью подается раствор, состоящий из 45 мл 10% хлорида калия и 5 мл 25% сульфата магния. Смешанная с этим раствором кровь попадает через кардиоплегические канюли в коронарное русло сердца. Подача плегии осуществляется интермиттирующим способом, то есть по 2-3 минуты через каждые 15 минут.
Пример осуществления кардиоплегии.
У пациента исходный калий плазмы крови перед проведением сеанса кардиоплегии составляет 4,1 ммоль/л. Для достижения асистолии и обеспечения защиты необходимо подавать кровь в коронарное русло со скоростью 300 мл/мин и концентрацией калия в этой крови 16 ммоль/л. Подставив эти значения, получим скорость подачи раствора калия 178.9 мл/час. Для обеспечения повторных сеансов плегии необходима концентрация калия в растворе плегии 8-11 ммоль/л. Скорость подачи в среднем колеблется от 250 до 350 мл/мин. Концентрация калия в крови пациента, как правило, повышается в течение искусственного кровообращения. Если концентрация калия крови пациента составляет 5.2 ммоль/л, необходимый уровень калия в растворе кардиоплегии составляет 10 ммоль/л, скорость подачи кардиоплегии составляет 270 мл/мин, то скорость подачи раствора калия составит 65 мл/час.
Апробация способа проводилась на базе кардиохирургического отделения ФГУ «ФЦСКЭ им. В.А.Алмазова Росмедтехнологий» у 100 пациентов, оперированных по поводу ишемической болезни сердца, изолированной клапанной патологии, сочетанной патологии.
В результате применения данной методики за время наблюдения не было ни одного летального исхода. 12% пациентов потребовали назначения инотропной поддержки в раннем послеоперационном периоде. Среднее время нахождения на ИВЛ составило 5.5 часов с момента выезда из операционной. Среднее время пребывания пациентов в отделении реанимации составило 17 часов. По сравнению со способом-прототипом число пациентов, требующих инотропной поддержки, снизилось на 25%, среднее время нахождения на ИВЛ уменьшилось на 9%, среднее время пребывания в отделении реанимации уменьшилось на 11%.
Таким образом, предлагаемый способ проведения кардиоплегии позволяет улучшить качество защиты миокарда, снизить расходы на обеспечение послеоперационного периода.
Список использованной литературы:
1. Antunes M.J., Bernardo J.E., Oliveira J.M. et al. Coronary artery bypass surgery with intermittent aortic cross-clamping // Eur. J. Cardiothorac. Surg. – 1992. – Vol.6, №4. – P.189-193; discussion – P.193-194.
2. Shumway N., Lower L., Stofer R. Selective hypothermia of the heart in anoxic cardiac arrest // Surg. Gynec. Obstet. – 1959. – Vol.1096, №10. – P.750-754.
3. Малашенков А.И. Сравнительная оценка методов защиты миокарда при операциях с искусственным кровообращением: Автореф. дис. докт. – М., 1982.
4. Melrose DG, Dreyer В, Bentall HH, et al: Elective cardiac arrest. Lance 1955; 2:21.
5. Colapinto ND, Silver MD: Prosthetic heart valve replacement: Causes of early postoperative death. J Thorac Cardiovasc Surg 1971; 61:938.
6. Bretschneider HJ, Hübner G, Knoll D, et al: Myocardial resistance and tolerance to ischemia: Physiological and biochemical basis. J Cardiovasc Surg 1975; 16:241.
7. Левицкий С., Файнберг Г. Клиническое состояние проблемы защиты миокарда с использованием гипотермической калиевой кардиоплегии // Вестн. АМН СССР. – 1981. – №10. – С.3-9.
8. Худоногова С.В., Рубинчик В.Е., Наймушин А.В. и др. Результаты использования кровяной кардиоплегии у больных ишемической болезнью сердца со сниженной сократительной способностью миокарда. // Материалы 3 Всероссийского съезда по экстракорпоральным технологиям. – Суздаль. – 2001. – С.19.
9. Barner H.B., Jelliner M. Blood cardioplegia: an introduction // A textbook of clinical cardioplegia – N.Y., 1982. – P.227-235.
Способ осуществления кардиоплегии путем введения в коронарное русло обогащенной калием крови, отличающийся тем, что перед проведением каждого сеанса кардиоплегии определяют концентрацию калия в плазме крови пациента, а требуемую скорость инфузии раствора калия определенной концентрации вычисляют по формуле:
СКИ=((((Кплегии-Кпациент)/10)·(СККП/100))/(0,134·К%))·60,
где СКИ – скорость инфузомата с раствором калия, мл/ч;
Кплегии – необходимая концентрация калия в растворе плегии, ммоль/л;
Кпациент – плазменная концентрация калия пациента, ммоль/л;
СККП – скорость кардиоплегии, мл/мин;
К% – концентрация используемого калия, %;
0,134 – коэффициент перевода мг в ммоль.
Способы выполнения кардиоплегии, история создания растворов для остановки сердца

Понятие кардиоплегии появилось в 50-х годах прошлого века в ходе исследований по остановке сердечных сокращений для проведения операций на открытом сердце.
С методами остановки сердца для проведения сложных операций кардиохирурги начали экспериментировать задолго до появления термина. Так, асистола может наступить при механическом сдавливании сердца рукой и заполнения перикарда воздухом. Но при использовании такого метода уже через 20 минут в миокарде появлялись необратимые некротические изменения. Такая кардиоплегия называется ишемической, и истинной не считается.
В современном толковании термин кардиоплегия обозначает искусственную остановку сердца с консервированием миокарда для защиты и продления периода резистентности его клеток к ишемии, препятствования наступлению необратимых изменений. К истинной кардтоплагии относят фармакологическую, холодовую, кровяную и смешанную (фармакохолодовую) кардиоплегию.
Растворы для остановки сердца
О методе остановки сердца при помощи введения кардиоплегических растворов с высокой концентрацией ионов калия впервые сообщили кардиохирурги из Англии. Но применение первых кардиоплегических составов приводили к серьезным осложнениям после аноксии.
Немецкие ученые в 1972 г. создали кустодиол. В нем в качестве буфера используют гидрокарбонат натрия, в который добавлены в нужной концентрации ионы Ca, K, Na, прокаина. Кустодиол до сих пор успешно используют в кардиохирургии.
В 1976 г. в больнице Святого Томаса в Лондоне разработан оригинальный раствор для кардиоплегии, что и дало ему одноименное название.
Для каждого вида кардиоплегии используют специальный раствор.
После окончания периода введения кардиоплегического препарата и восстановления кровотока его остатки вымываются кровью.
Методы защиты сердечной мышцы и способы введения
Самым распространенным методом защиты миокарда является снижение его активности и потребности в кислороде во время асистолии при помощи глубокого охлаждения. До настоящего времени фармакохолодовая кардиоплегия является наиболее изученной и эффективной.
При помощи специальной системы вводят охлажденный до 4°C раствор. Способы ввода раствора бывают разные:
- В корень восходящей аорты.
- Непосредственно в магистрали коронарных артерий.
- В правое предсердие (atrium dextrum).
- В коронарный (венечный) синус.
В период асистолии выполняется общее охлаждение пациента и локальное охлаждение сердца при помощи обкладывания ледяной кашицей (орошение льдом).
После подключения к аппарату искусственного кровообращения, подготовки крепления канюли кардиоплегической системы пережимается аорта. Сразу вводится 1000 мл раствора. После остановки сердца проводят постоянный мониторинг температуры миокарда (она должна быть в пределах 12-16 градусов).
 Операция на сердце
Операция на сердце
В последнее время интенсивно развивается и исследуется метод кровяной кардиоплегии. Поскольку чистые растворы негативно влияют на клеточные мембраны, предложен метод использования в качестве буферной среды кардиоплегического раствора цельной крови пациента. При этом сердце лучше оксигенизируется, улучшается капиллярная перфузия, естественные антиоксиданты улучшают защиту и резистентность миокарда в условиях аноксии. Современные комбинированные методы позволяют говорить о защите миокарда на период 2-х часовой окклюзии.
В зависимости от ситуации, кардиоплегический раствор может вводиться антеградно и ретроградно. Антеградное введение выполняется через аорту и распространяется по артериям.
Ретроградная кардиоплегия выполняется через коронарный синус или через правое предсердие. Раствор проходит по венам. Используется при операциях на клапане аорты.
Кардиоплегия предотвращает развитие сердечной недостаточности после прекращения окклюзии. В любой такой операции критическим моментом является период восстановления естественной перфузии сердечной мышцы.
Основы фармакохолодовой кардиоплегии
В основе фармакохолодовой кардиоплегии лежит инактивация электрофизиологических механизмов и сократительной системы сердца в фазу диастолы. ФХКП включает три основных принципа:
1) быстрая полная электромеханическая остановка сердца;
2) глубокая гипотермия;
3) использование дополнительных протекторных агентов, буферирование межклеточной жидкости и предотвращение клеточного отека.
Электрофизиологическая инактивация миокарда может быть осуществлена несколькими способами [3]:
1 – повышением внеклеточного уровня ионов калия, что ведет к инактивации быстрых и медленных Na+ и №+,Са2±каналов, а значит и блокированию электрической и механической активности миокарда;
2 – повышением внеклеточного уровня ионов магния, в результате чего вытесняются ионы кальция из мест их связывания на клеточной мембране и в сократительном аппарате и таким образом прекращается механическая активность миокарда с его расслаблением;
3 – снижением внеклеточного уровня ионов натрия до его уровня в цитоплазме с одновременным снижением до минимума внеклеточного уровня ионов кальция, с тем чтобы полностью не только инактивировать электрическую активность, но и подавить механическую активность миокардиальных клеток.
Обычно используют первый метод либо его сочетание со вторым или второй метод либо его сочетание с третьим.
В зависимости от концентрации ионов, кристаллоидные кардиоплегические растворы могут быть условно разделены на два типа: внутриклеточные и внеклеточные [36].
Внеклеточные растворы
Состав этих растворов выбран на основании концентрации ионов во внеклеточной жидкости и ее физико-химических свойств. Ионы натрия и кальция присутствуют в нормальных или слегка сниженных концентрациях. Остановку сердца вызывают умеренно повышенной концентрацией калия (15-30 мМ) или калия в сочетании с магнием (К + – 15-16 мМ, Mg 2+ – 16 мМ).
Главное преимущество внеклеточных растворов состоит в той легкости, с которой они устанавливают равновесие с миокардиальнои тканью. Это обстоятельство обусловливает прямую связь между продолжительностью действия, объёмом инфузии и защитным эффектом. После действия этих растворов достаточно легко осуществить запуск сердца. В то же время эффективность внеклеточных растворов может быть снижена наличием некоронарного коллатерального кровотока (НКК) (объем этого потока при некоторых пороках достигает 25% от системного) [22, 24]. Наличие НКК ведет к преждевременному согреванию миокарда и вымыванию кардиоплегического раствора. Наличие НКК является препятствием для повышения защитных свойств кардиоплегического раствора при прерывистом режиме введения.
В отделе приобретенных пороков НЦССХ им. А. II. Бакулева различные варианты кристаллоидной калиевой кардиоплегии применяются с 1980 г. (табл. 2). Сначала использовали раствор с концентрацией калия 30 мМ. Недостатком этой методики была высокая частота нарушений ритма, и с 1981 г. перешли к методике, когда индукция кардиоплегии проводилась раствором №1, а реинфузии осуществлялись раствором, где концентрация К+ составляла 5 мМ. Дальнейшие экспериментальные исследования влияния концентрации калия на эффективность защиты миокарда выявили возможность достижения быстрой остановки сердца с использованием раствора с концентрацией К+-15 мМ и Mg2+-16 мМ. Наши исследования подтвердили данные D. J. Hearse et al. (1978 г.), повышение концентрации магния до внутриклеточной концентрации улучшило защиту миокарда (рис. 2, 3). С 1987 г. до настоящего времени мы используем кардиоплегический раствор этого состава.
Таблица 2. Состав калиевых кардиоплегических растворов, используемых в НЦССХ им. А. Н. Бакулева РАМН в 1980-1998 гг.
| Компонент | №1 | №2 | №3 |
| Калий (мМ) | 30 | 5 | 15 |
| Натрий (мМ) | ПО | 110 | ПО |
| Магний (мМ) | 1.6 | 1,6 | 16 |
| Кальций (мМ) | 1.4 | 1,4 | 1,4 |
| Глюкоза (г/л) | 5 | 5 | 5 |
| Маннитол (г/л) | 7 | 12 | 19 |
| Осмолярность (мОсм/л) | 330 | 330 | 360 |
| рН | 7,6 | 7,6 | 7,6 |
| р С02 (мм рт.ст.) | 30-40 | 30-40 | 30-40 |
| р09 (мм рт.ст.) | 400-500 | 400-500 | 400-500 |


Внутриклеточные растворы
Внутриклеточные растворы отличаются от внеклеточных тем, что не содержат ионов кальция (или почти не содержат), а ионы натрия имеются в малых концентрациях либо вовсе отсутствуют. Растворы этого типа моделируют ионный состав внутриклеточной жидкости и вызывают остановку сердца благодаря истощению запасов натрия и кальция.
Преимуществами внутриклеточных растворов являются:
1) их низкая осмолярность, что дает возможность обогащать раствор без опасности чрезмерно повысить осмолярность;
2) возможность вызвать прямой кардиоплегический эффект благодаря ограничению вхоледения ионов натрия в клетки;
3) возможность снизить ишемический вход кальция в клетку из-за его низкой внеклеточной концентрации.
К недостаткам подобных растворов относят возможность развития ионного дисбаланса, что может привести к систолической, а не диастолическои остановке сердца, а также возможность провоцирования «кальциевого парадокса» при реперфузии [49].
Клинические исследования в Институте трансплантологии и искусственных органов показали высокую эффективность кустодиола при длительном выключении сердца из кровообращения, подчеркивая удобство методического выполнения – одна инфузия на 2-3 ч пережатия аорты.
Основными контролируемыми параметрами кардиоплегических растворов являются температура, осмолярность и рН [36].
Температура
Миокардиальная температура 10-20°С существенно снижает метаболизм и позволяет выполнить большинство процедур на открытом сердце. Такие же условия можно получить с помощью кардиоплегического раствора, охлажденного до 4°С. Как только температура миокарда достигает 10°С, защитное действие дальнейшего охлаждения снижается [83].
Местное охлаждение сердца позволяет нейтрализовать потоки тепла к сердцу, обусловленные светом операционных ламп, теплым воздухом операционной, термодиффузией через перикард.
Главной причиной согревания сердца при его остановке с помощью ФХКП является поступление теплой крови в камеры сердца. Следовательно, при остановке сердца важно следить за постоянной эвакуацией крови из левых отделов с помощью дренажа ЛЖ. Дренаж должен функционировать весь период пережатия аорты, а в реперфузионном периоде его удаляют только после восстановления эффективной сердечной деятельности. В ходе операции температуру миокарда целесообразно мониторировать и поддерживать в пределах 12-18°С[36].
Осмолярность
рН раствора
Во многих случаях кардиоплегические растворы делают умеренно щелочными (рН 7,4-7,6 при 25°С), чтобы скомпенсировать метаболический ацидоз, сопутствующий ишемии миокарда. Ацидоз является следствием анаэробного метаболизма, при котором в тканях повышается содержание молочной кислоты и углекислого газа. Поддержание рН в нормальном физиологическом диапазоне – важнейшее условие кардиоплегии, т.к. работа мембранных насосов клеток зависит от рН. Кроме того, ацидоз отрицательно сказывается на сократимости желудочков сердца. В отдельных работах показаны положительные эффекты перфузии щелочными растворами при гипотермической остановке сердца [20, 41].
В качестве буферов кристаллоидных кардиоплегических растворов можно применять трис(гидроксиметил)амииометан (ТРИС) или соду (бикарбонат натрия) [84].
Компоненты кардиоплегического раствора
Большое количество литературы посвящено изучению защитных свойств растворов (как кристаллоидных, так и для кровяной кардиоплегии) при добавлении к ним фармакологических агентов [2].
Условно эти препараты делятся на следующие классы:
1 – препараты с ионными эффектами (местные анестетики, р-блокаторы, антагонисты кальция).
2 – субстраты, гормоны, буферы.
3 – осмо- и онкотически активные вещества (маннитол, сорбитол, глюкоза или декстроза, альбумин, гидроксиэтилкрахмал).
4 – ингибиторы кислородных радикалов и их токсического действия.
5 – МЭФ и их составляющие.
6 – прочие препараты (хлорпромазин, карнитин, нитроглицерин и др.).
Исследования в данном направлении в основном носят экспериментальный характер. Отсутствие объективного метода контроля за функционально-биохимическим состоянием миокарда в клинических условиях значительно осложняет поиски в данном направлении, и чаще всего результаты клинических исследований не подтверждают данных эксперимента.
Одним из дополнительных протективных агентов при добавлении в кардиоплегический раствор является экзогенный фосфокреатин (неотон). Несмотря на отсутствие полного понимания механизма его действия, в экспериментальных и клинических исследованиях ряда авторов показано, что в концентрации 10 мМ неотон повышает толерантность миокарда к ишемии в нормотермических и гипотермических условиях в виде снижения частоты желудочковых нарушений ритма и снижения степени контрактуриого повреждения кардиомиоцитов по данным электронной микроскопии (Chambers D. J. et al., 1991 г.; Robinson L. A. et al., 1984 г.; Муратов Р. М. с соавт, 1992 г.).
Инфузия теплого (36°С) калий-магниевого кардиоплегического раствора с добавлением кальциевых блокаторов (верапамил, нифедипин) перед снятием зажима с аорты («hot-shot») снижает выход внутриклеточных ферментов в коронарный синус и улучшает функциональный статус миокарда в период реперфузии [7, 8, 10] (рис. 4, 5).


Каков же безопасный период выключения сердца из кровообращения в условиях ФХКП?
В отделе приобретенных пороков сердца НЦССХ были проанализированы непосредственные результаты 102 операций коррекции клапанной патологии с длительными (> 120 мин) сроками пережатия аорты [5, 9]. 90% операций выполнялись при многоклапанных пороках. Время пережатия аорты составило 120-223 мин (ср. 139,3 мин). Результаты этого исследования представлены в таблице 3. Видно, что кристаллоидная калиевая кардиоплегия позволяет выполнить практически любое вмешательство на клапанах сердца.
| Показатель | абс. | % |
| Госпитальная летальность | 1 1 | 10.7 |
| В том числе от ОСН | 4 | 3.9 |
| Частота ОСН | 7 | 6.8 |
| Тяжелые нарушения ритма | 21 | 20 |
| Новый зубец Q | 4 | 4 |
| «Некротический» уровень | 0 | 0 |
| КФК МБ |

Основы кровяной кардиоплегии
Использование крови как наполнителя для поставки кардиоплегического раствора имеет очевидные преимущества:
1) сохранение сердца, когда оно остановлено, в состоянии оксигенации;
2) повторная оксигенация при пополнении кардиоплегического раствора;
3) избежание реперфузионного повреждения;
4) сведение к минимуму гемодилюции;
5) повышение буферной емкости раствора и наличие естественных антиоксидаитов.
Гемокардиоплегия приводит к более низкой частоте послеоперационных изменений ЭКГ и инотроппой поддержке, хотя не исключает полностью повреждения миокарда [24].
Холодовая кровяная кардиоплегия чаще всего проводится при соотношении раствора к крови 1:4. Холодовую перемежающуюся кровяную кардиоплегию проводят антеградно и/или ретроградно с промежутками в 15-20 мин.
Тепловую кровяную кардиоплегию (ТКК) проводят, используя специальные системы, которые дают возможность подавать кровь из оксигенатора и бескровный кардиоплегический раствор в определенном соотношении (чаще 4:1). Кровяной кардиоплегический раствор подают в аорту, коронарные артерии или коронарный синус (ретроградная ТКК). Система для ТКК может иметь собственный теплообменник. Есть варианты, при которых кровь из оксигенатора смешивают с кардиоплегическим раствором в специальном сосуде еще до начала ТКК [39]. Возможна методика ТКК, когда при помощи перфузора в кардиоплегическую систему с кровью подают раствор калия с необходимой в данный момент скоростью [60].
Для добавления к крови чаще всего используют растворы, предложенные S. V. Lichtcnstein, S. E. Fremes, J. G. Abel с соавт. [61]: раствор № 1, содержащий 100 мэкв/л калия хлорида, и низкокалиевый (раствор № 2), в состав которого входит 30 мэкв/л калия хлорида. Оба раствора содержат магния сульфат (18 мэкв/л), трометамин (трис-буфер, 12 мэкв/л) и цитрат-фосфат-декстрозу (20 мл/л). Осмоляльность обоих растворов 425 мОсм/л, рН 7,95.
В литературе при сравнении эффективности защиты миокарда с помощью холодовой кристаллоиднои и кровяной кардиоплегии абсолютное большинство исследователей отдают предпочтение кровяной кардиоплегии; причем имеются данные об успешном её применении практически при всех типах операций: ВПС [19,26, 28,38], ППС [18, 74,82], АКШ [46, 51,85], повторные операции [74] и т.д. Кровяная кардиоплегия неплохо зарекомендовала себя при операциях у детей раннего возраста [37, 58, 91], а также у пожилых пациентов [19, 64].
В литературе также идет дискуссия и о преимуществах ТКК перед холодовой кровяной кардиоплегией. Большая часть исследователей при этом отдают предпочтение ТКК [62, 65, 79,85,93,103,106].
Способы подачи раствора в коронарное русло – ещё один предмет дискуссии. Определенная часть хирургов при этом склоняются к преимуществу антеградного способа над ретроградным [16, 80, 86, 96, 104], так как показано, что при ретроградной подаче кардиоплегического раствора недостаточно защищен миокард, ПЖ и МЖП [14, 94, 102], однако есть ситуации, когда ретроградный способ можно считать более предпочтительным, например, для больных с поражением коронарных артерий и недостаточным развитием коллатералей [30, 57, 72, 80, 88].
Большинство исследователей рекомендуют сочетание антеградного и ретроградного способов [15, 29, 43, 48, 57, 86, 105]. Индукция кардиоплегии производится в корень аорты. При значительном стенозе коронарных артерий или при трудности прямой каиюляции устьев коронарных артерий реинфузии производят ретроградно путем канюляции коронарного синуса или ПП. При выполнении последней необходимо убедиться, что нет ДМПП и есть возможность пережатия ствола ЛА (при повторных операциях). Вторым важным моментом процедуры является контроль давления при инфузии (не выше 40 мм рт. ст.).
Непрерывная или перемежающаяся кровяная кардиоплегия? Ряд авторов считают постоянную кардиоплегию более предпочтительным методом по сравнению с перемежающейся по качеству защиты миокарда [25, 56, 66].
Публикации в СМИ
Защита миокарда (кардиоплегия)
ЗАЩИТА МИОКАРДА (кардиоплегия)
Кардиоплегия — метод защиты миокарда от повреждения во время выполнения манипуляций на остановленном сердце.
• Патофизиологические этапы ишемии миокарда •• Латентный период (аэробный метаболизм за счёт запасов кислорода в виде оксигемоглобина в крови коронарных сосудов) продолжается в течение 1–15 с •• Период выживания (анаэробный гликолиз происходит при тканевом pО2 менее 5 мм рт.ст. и продолжается при +28 °С в течение 5–6 мин) •• Период обратимого повреждения (глубокие ультраструктурные изменения, после реперфузии наблюдают период оглушения от нескольких минут до нескольких часов) •• Некробиоз (при нормотермии развивается в течение 15 мин) •• Некроз (при нормотермии развивается в течение 20 мин).
• Факторы защиты миокарда •• Гипотермия (обычная температура кардиоплегического р-ра +4 °С) •• Высокая концентрация внеклеточных калия и магния (инактивация быстрых и медленных натриевых и кальциевых каналов) •• Применение -адреноблокаторов, местных анестетиков, антагонистов кальция (используют редко по причине трудной управляемости эффекта) •• Использование энергетических субстратов.
• Требования к кардиоплегии: •• Молниеносная остановка сердца •• Предупреждение повреждения коронарных артерий и миокарда самим кардиоплегическим р-ром •• Предупреждение реперфузионного синдрома •• Создание физиологических условий в период восстановления сердечной деятельности.
• Методики проведения кардиоплегии: кровяная непрерывная, кровяная прерывистая, кристаллоидная непрерывная, кристаллоидная прерывистая.
• Техника введения кардиоплегического р-ра •• Антеградное введение в корень аорты •• Антеградное введение в устья коронарных артерий (применяют во время операций на левых камерах сердца, митральном и аортальном клапанах, а также на восходящей части аорты) •• Ретроградное введение в коронарный синус (наиболее универсальная и адекватная, хотя и сложная техника) •• Введение кардиоплегического р-ра и локальная гипотермия следуют тотчас после наложения зажима на аорту.
• Восстановление сердечной деятельности обычно происходит через фибрилляцию желудочков, но иногда собственный ритм может восстанавливаться спонтанно. В любом случае этот факт не имеет прогностической значимости. Как правило, согревание занимает около 10 мин (следует ориентироваться на температуру в прямой кишке), после чего при стабильной гемодинамике снимают зажим с аорты.
Сокращения • ИК — искусственное кровообращение • ОСП — объёмная скорость перфузии
Код вставки на сайт
Защита миокарда (кардиоплегия)
ЗАЩИТА МИОКАРДА (кардиоплегия)
Кардиоплегия — метод защиты миокарда от повреждения во время выполнения манипуляций на остановленном сердце.
• Патофизиологические этапы ишемии миокарда •• Латентный период (аэробный метаболизм за счёт запасов кислорода в виде оксигемоглобина в крови коронарных сосудов) продолжается в течение 1–15 с •• Период выживания (анаэробный гликолиз происходит при тканевом pО2 менее 5 мм рт.ст. и продолжается при +28 °С в течение 5–6 мин) •• Период обратимого повреждения (глубокие ультраструктурные изменения, после реперфузии наблюдают период оглушения от нескольких минут до нескольких часов) •• Некробиоз (при нормотермии развивается в течение 15 мин) •• Некроз (при нормотермии развивается в течение 20 мин).
• Факторы защиты миокарда •• Гипотермия (обычная температура кардиоплегического р-ра +4 °С) •• Высокая концентрация внеклеточных калия и магния (инактивация быстрых и медленных натриевых и кальциевых каналов) •• Применение -адреноблокаторов, местных анестетиков, антагонистов кальция (используют редко по причине трудной управляемости эффекта) •• Использование энергетических субстратов.
• Требования к кардиоплегии: •• Молниеносная остановка сердца •• Предупреждение повреждения коронарных артерий и миокарда самим кардиоплегическим р-ром •• Предупреждение реперфузионного синдрома •• Создание физиологических условий в период восстановления сердечной деятельности.
• Методики проведения кардиоплегии: кровяная непрерывная, кровяная прерывистая, кристаллоидная непрерывная, кристаллоидная прерывистая.
• Техника введения кардиоплегического р-ра •• Антеградное введение в корень аорты •• Антеградное введение в устья коронарных артерий (применяют во время операций на левых камерах сердца, митральном и аортальном клапанах, а также на восходящей части аорты) •• Ретроградное введение в коронарный синус (наиболее универсальная и адекватная, хотя и сложная техника) •• Введение кардиоплегического р-ра и локальная гипотермия следуют тотчас после наложения зажима на аорту.
• Восстановление сердечной деятельности обычно происходит через фибрилляцию желудочков, но иногда собственный ритм может восстанавливаться спонтанно. В любом случае этот факт не имеет прогностической значимости. Как правило, согревание занимает около 10 мин (следует ориентироваться на температуру в прямой кишке), после чего при стабильной гемодинамике снимают зажим с аорты.
Сокращения • ИК — искусственное кровообращение • ОСП — объёмная скорость перфузии
Остановленное сердце
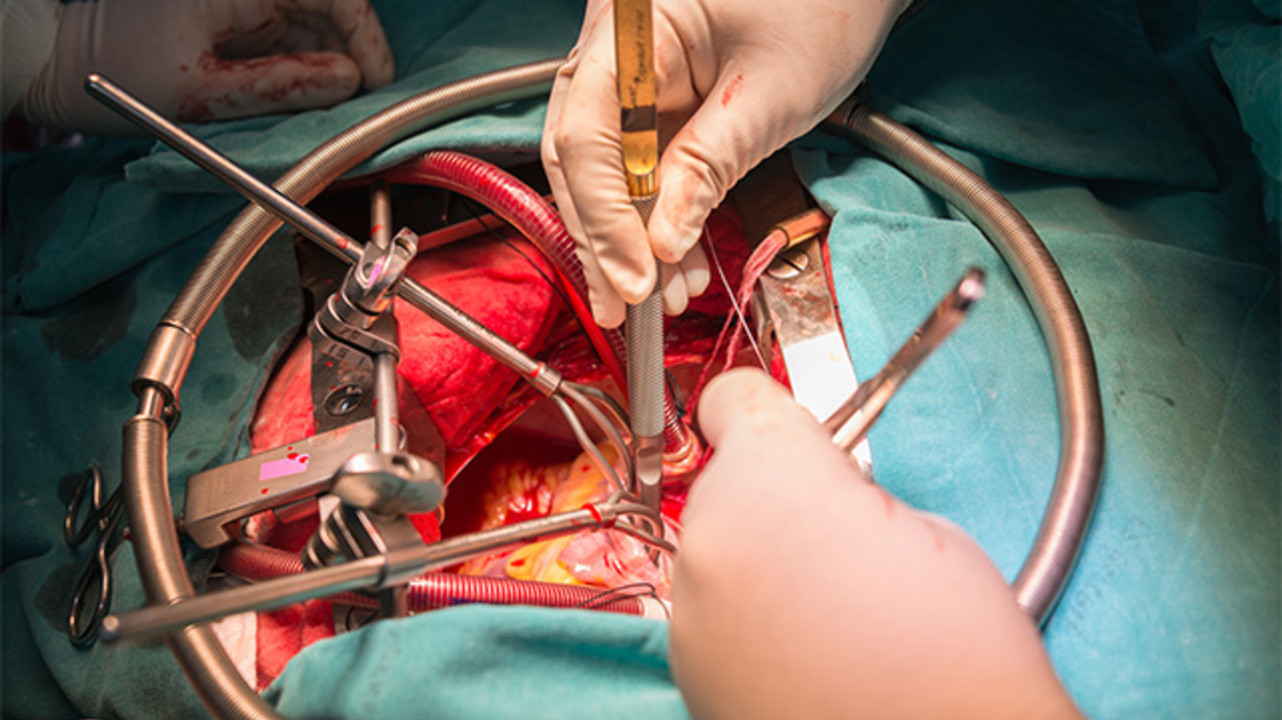
Для хирургического вмешательства сердце необходимо на время остановить: ведь бьющееся и выбрасывающее кровь в сосуды сердце оперировать невозможно.
Интерьер современной операционной сегодня невозможно представить без аппарата искусственного кровообращения – АИК. Появившись в конце 50-х годов, он прочно вошел в практику кардиохирургии. На те несколько часов, которые продолжается операция, сердце и легкие пациента отданы во власть этой умной машины.
Врожденные и приобретенные пороки сердца сегодня встречаются все чаще. Терапевтические методы лечения во многих случаях помочь бессильны, поэтому пальма первенства принадлежит хирургии.
Что такое порок сердца?
Что же такое порок сердца? Обобщая, можно ответить так: это нарушение строения сердца, которое приводит к изменению строгой схемы движения потоков крови внутри него. Обычно эта схема неукоснительно «выполняется» у здорового человека, и малейшие ее нарушения сказываются на всем организме. Как известно, сердце состоит из четырех сообщающихся между собой полостей: двух предсердий и двух желудочков. Между предсердиями, так же как и между желудочками сердца, существуют перегородки. В здоровом сердце они препятствуют перетеканию крови из левых предсердия и желудочка соответственно в правые. Но если есть дефекты в этих перегородках, часть крови начнет перетекать в правый желудочек. За счет этого уменьшается напор крови, который левый желудочек выбрасывает в аорту (оттуда она разносится по всему телу). В результате ухудшается кровоснабжение всего организма. В правом желудочке возрастает давление, что способствует увеличению его объема, утолщению мышечного слоя его стенок.
Чем опасен порок сердца?
Все это неотвратимо приводит к хронической сердечной недостаточности и сказывается на других органах. Изменяются и сосуды легких: постоянно сопротивляясь повышению давления, они становятся жесткими, теряют эластичность. Нарушается и насыщение крови кислородом. У человека появляется одышка, отеки ног или туловища, посинение кожи и слизистых оболочек (цианоз). Все это — следствие дефекта в перегородке сердца.
Этого можно избежать, если вовремя провести операцию, восстанавливающую сердечную перегородку. Но для хирургического вмешательства сердце необходимо на время остановить: ведь бьющееся и выбрасывающее кровь в сосуды сердце оперировать невозможно. Сначала пытались решить эту проблему с помощью искусственного охлаждения тела пациента до 30 градусов Цельсия. Это позволяет на очень короткое время выключить сердце из кровообращения, поскольку при уменьшении температуры тела до 30 градусов потребность организма в кислороде уменьшается почти наполовину, и поэтому он может перенести короткую — на 15-20 минут – остановку сердца. Этого времени вполне достаточно, когда нужно наложить несколько швов для устранения незначительного порока сердца.
Как врачи останавливают сердце во время операции?
Перед началом операции пациента, находящегося под наркозом, начинают охлаждать — его тело обкладывают мешками с ледяной крошкой. Температурные датчики и датчики давления следят за его состоянием, одновременно производится мониторинг основных физиологических параметров. Когда температура тела опускается до 32 градусов, лед убирают, но температура по инерции продолжает снижаться до 29 градусов. В течение 20 минут, пока не наступило кислородное голодание, можно проводить операцию на сердечной перегородке. В конце операции с помощью препаратов стимулируют сердце и согревают тело пациента потоком теплого воздуха.
Таким способом оперируют, например, в Новосибирском институте патологии кровообращения, которым долгие годы руководил академик Е.Н.Мешалкин. Хирурги сумели добиться значительного уменьшения потребности организма в кислороде, что позволило увеличить длительность операции до 60 минут! Однако несмотря на то, что метод этот относительно недорогой и позволяет добиться хороших результатов, у него есть серьезный недостаток — слишком ограниченные временные рамки, не позволяющие проводить сложные операции.
Что такое АИК?
Полностью решить эту проблему смогли с помощью искусственного кровообращения и создания АИК. В нашей стране развитие метода искусственного кровообращения связано в первую очередь с именами С.С.Брюхоненко и С.И.Чечулина. Они еще в 1924 году создали прообраз современного АИКа, названный ими «автожектор». Сегодняшний АИК значительно отличается от своих первых предшественников, ведь с тех пор медицина шагнула далеко вперед.
Как действует АИК?
Любой АИК состоит из двух блоков: физиологического и механического. К первому относятся все детали аппарата, соприкасающиеся с кровью. Основные его части — оксигенатор, выполняющий роль «искусственных «легких», и артериальный насос, берущий на себя задачу «искусственного сердца». Сегодня это — стерильное, одноразовое устройство, индивидуальное для каждого пациента. Механический блок представляет собой набор насосов, а также оборудование для электронного управления и постоянного контроля за параметрами искусственного кровообращения.
Чтобы отвести кровь в систему трубок АИК, нужно решить несколько задач. Во-первых, кровь не должна свернуться. Для этого больному вводят вещество, препятствующее свертыванию крови, — гепарин или его аналоги. Во-вторых, кровь необходимо насыщать кислородом. Для этого и служат искусственные легкие АИК. На первой стадии операции трубки физиологического блока АИК вставляются в сосуды пациента таким образом, что на какое-то время возникает параллельное кровообращение: одна часть крови проходит через АИК, а другая — через сердце. Затем тесемками сосуды плотно прижимают к трубкам, и с этого момента кровь идет уже только через АИК. Венозная кровь, бедная кислородом, из организма пациента поступает в оксигенатор, где она насыщается кислородом, освобождается от избытка углекислоты и далее артериальным насосом нагнетается в сосуды.
Перед тем, как вновь попасть в систему кровообращения оперируемого, кровь проходит через теплообменник – устройство для поддержания необходимой температуры крови, а также через артериальный фильтр-ловушку, препятствующий попаданию в кровь пузырьков воздуха, а также посторонних частиц.
Таким образом, кровообращение с помощью АИК осуществляется в обход сердца. Это дает возможность хирургу оперировать на «сухом» сердце, лишенном основного потока крови, столько времени, сколько это необходимо для коррекции порока. Сердце продолжает сокращаться во время операции. Оно не совсем обескровлено, поскольку часть крови проходит по сердечным сосудам и питает саму сердечную мышцу.
Что такое холодовая кардиоплегия?
В последние десятилетия появились методы, которые дополнительно защищают сердце от кислородной недостаточности во время работы АИК. Это так называемая холодовая кардиоплегия, при которой происходит своеобразная «консервация» сердца. Перед операцией больному вводят прямо в аорту кардиоплегический раствор: специально подобранный электролитный состав с повышенным содержанием калия, охлажденный до четырех градусов. Он вызывает быструю остановку сердца на 20–25 минут. Благодаря раствору сердце защищено от кислородной недостаточности, оно остается неподвижным, что создает условия для более быстрой и точной работы хирурга. Раствор надежно защищает и сохраняет энергетические запасы сердца даже при длительных и сложных операциях. Все это дало возможность исправлять хирургическим путем такие пороки сердца, которые раньше считались безнадежными.
Как видите, трудно переоценить значение метода искусственного кровообращения. С его помощью удалось вернуть здоровье миллионам пациентов по всему миру.
Восстановление после шунтирования
Восстановление после шунтирования
Восстановление после коронарного шунтирования должно проводиться под наблюдением специалиста. Это важно не только потому, что пациенту необходимо быстро нормализовать свое состояние, но и потому, что АКШ устраняет только следствие нарушений сердечной деятельности. Первопричина, например, атеросклеротические поражения сосудов, сохраняется. Аортокоронарное шунтирование серьезная травма для организма, оно приводит к возникновению множества ответных реакций, которые могут стать патологическими.
Цели восстановительного периода
Перед пациентом и специалистом стоит целый ряд задач, от успешности реализации которых зависит результативность проведенной операции.
К ним относятся:
- не допустить развития осложнений;
- возобновить работу сердца в полном объеме;
- стимуляция регенеративных процессов поврежденных участков;
- замедлить прогрессирование атеросклеротических и других патологических процессов в миокарде;
- адаптировать больного к психологическим и физическим нагрузкам;
- сформировать навыки, актуальные для новых условий жизнедеятельности: бытовые, социальные, трудовые.
Считается, что поставленные цели достигнуты, если пациент возвращается к образу жизни, актуальному для здорового человека.
Восстановление после операции шунтирование включает в себя следующие направления:
- уход за пациентом в первые дни;
- медикаментозная терапия;
- систематический мониторинг динамики состояния;
- настрой на здоровый образ жизни и отказ от вредных привычек;
- физическая реабилитация;
- дыхательные упражнения;
- психическая реабилитация;
- физиотерапевтические процедуры и санаторно-курортное лечение.
Восстановительные мероприятия в первые дни
После операции пациента переводят в отделение реанимации, где он находится под контролем приборов и медицинского персонала. В это время проводится ряд обследований:
- общий анализ крови;
- рентген;
- электрокардиография.
Восстановление после шунтирования в этот период подразумевает обязательное нахождение пациента в тепле, поэтому его укутывают в теплое одеяло. В первые сутки может подниматься температура – это является вариантом нормы и проявлением защитных функций организма. Также характерным для состояния восстановления является повышенное потоотделение.
В больнице пациент проводит 1-1,5 недели. Спустя неделю после АКШ снимаются швы с грудной клетки и ноги, если забор вены происходил оттуда. Для заживления грудины требуется около 6 недель. В этот период запрещены высокие физические нагрузки. Ускорить восстановление после шунтирования поможет использование специального бандажа. Назначаются антибактериальные препараты, обезболивающие и седативные средства.
Необходимо выполнять дыхательные упражнения – им обучит специалист еще до проведения операции. Наиболее простым вариантом разрабатывать легкие будет надувание воздушных шариков. Однако есть специальные методики, которые используются для восстановления после аортокоронарного шунтирования.
Для предупреждения застойных явлений проводится вибромассаж – над областью легких несильными простукивающими движениями.
Несмотря на постельный режим, необходимо двигаться – менять положение тела. После того как разрешит врач, можно поворачиваться на бок. Физическая активность наращивается постепенно: сначала разрешается сидеть на стуле, затем передвигаться по палате, по коридору. После этого пациент пробует ходить по лестнице. Перед выпиской гуляет на свежем воздухе.
Дальнейшая реабилитация
Ношение бандажа и компрессионных чулок позволит ускорить восстановление после шунтирования сосудов сердца. Купить их можно в ортопедическом магазине.
Водные процедуры не запрещаются, но мыться разрешается только под душем, и чтобы прямая струя воды не попадала на область раны. Купание и посещение бассейна допускается только после заживления грудины.
Медикаментозное лечение основывается на приеме таких препаратов как:
- антиагреганты;
- ингибиторы АПФ;
- бета-блокаторы;
- статины.
Антиагреганты нужны для разжижения крови. Это лекарства, которые пациенты с ИБС должны принимать пожизненно. Наиболее распространенным препаратом является аспирин.
Бета-блокаторы снижают нагрузку на сердце, приводят к норме ЧСС и артериальное давление. Их использование актуально при гипертонии, тахиаритмии, сердечной недостаточности.
Статины характеризуются противовоспалительным эффектом.
Физическое восстановление после шунтирования начинается практически сразу. Уже на следующий день пациент присаживается, а на второй – встает с постели. Необходимы гимнастика и массаж.
Рекомендованными видами спортивной нагрузки являются ходьба, прогулки на свежем воздухе, а впоследствии – плавание. Специалисты рекомендуют использовать занятия на кардиотренажерах, езду на велосипеде, ходьбу по лестнице.
Период восстановления после шунтирования не запрещает ведение сексуальной жизни. Однако следует выбирать позиции, в которых не будет оказываться давление на грудную клетку. А вот от вождения автомобиля придется отказаться на месяц. Врачи не советуют в течение первых нескольких месяцев отправляться в путешествия. Если есть необходимость уехать, то перед отъездом обязательно прохождение кардиологического обследования и консультация специалиста.
Психическое восстановление после шунтирования является неотъемлемой частью реабилитации. Психоэмоциональные расстройства часто являются следствием сложной операции. У пациентов наблюдается повышение тревожности, возникают сомнения в возможности улучшения самочувствия. Психосоматика работает таким образом, что эта неуверенность перетекает в ухудшение физического состояния: появляются головные боли и головокружения. Чтобы избежать таких ситуаций, необходима работа с психотерапевтом. Формируются новые установки, при необходимости используют медикаментозное лечение – седативные препараты. Также эффективны физиотерапия и массаж.
Образ жизни
Курение после АКШ запрещается категорически. Никотин приводит к повышению свертываемости крови, приводит к спазму сосудов, ухудшает транспортировку кислорода к тканям и проводимость импульсов в миокарде.
Восстановление после шунтирования сердца включает физиопроцедуры: электросон, магнитную терапию, лазер, электрофорез.
Крайне рекомендуется при наличии возможности пройти восстановление после шунтирования в специализированном санатории. Преимуществ в данном случае – масса: постоянное наблюдение в сочетании с грамотно составленным рационом и выполнением дозированных нагрузок под присмотром специалиста.
Возможные осложнения
Пациенту следует относиться с большим вниманием к изменению своего самочувствия. Обратиться к специалисту незамедлительно следует в следующих случаях:
- изменения, указывающие на развитие воспалительного процесса в области шва: это гиперемия, локальное повышение температуры, болезненность, выделения из раны;
- общая слабость;
- затруднение дыхания;
- нарастание массы тела, отечность;
- тахикардия;
- боли в грудной клетке.
Восстановление после операции на сердце шунтирование и в больнице, и в домашних условиях должно проходить под наблюдением врача, так как существует риск развития осложнений. К числу возможных последствий относятся:
- аритмии;
- кровотечения;
- инфаркт;
- инсульт;
- тромбоз;
- проникновение инфекции в рану;
- почечная недостаточность;
- хронические боли в области разреза.
Профилактика

Одним из ключевых факторов как первичной, так и вторичной профилактики патологий сердца является правильное питание. Восстановление после шунтирования подразумевает соблюдение строгой диеты.
Рассматривая опасность развития атеросклероза и ИБС со стороны пищевых факторов, необходимо выделить такие как:
- пища с высокой калорийностью, приводящая к ожирению;
- недостаток полиненасыщенных кислот, которые нужны для нормализации холестеринового обмена;
- продукты питания, насыщенные холестерином;
- дефицит клетчатки;
- чрезмерное употребление соли;
- избыток животных белков, которые нарушают проницаемость сосудов, негативно сказываются на липидном обмене и свертываемости крови;
- дефицит необходимых для организма веществ: магния, калия, цинка, йода, витаминов PP, А, аскорбиновой кислоты, В6.
В первую очередь необходимо снизить калорийность питания. Она должна составлять 2400-2600 ккал.
Рацион должен включать 70-90 гр белков, 80 гр жиров, 300-350 гр углеводов.
Рекомендовано 5-6 небольших приемов пищи в день. Еда должна быть нормальной температуры, не пересолена. Разрешенный объем жидкости – 1,2-1,5 л в сутки.
Специалисты советуют включать в меню следующие блюда:
- супы на основе овощного бульона с хорошо разваренной крупой;
- нежирные сорта мяса и птицы;
- морепродукты;
- молочную продукцию;
- цельные злаки;
- овощи и фрукты;
- свежевыжатые соки;
- миндаль и грецкие орехи.
Высока вероятность развития осложнений у пациентов с диабетом. Эти люди входят в группу риска, что требует особого внимания со стороны медицинского персонала. Важно обеспечивать организму полноценный отдых – спать не меньше 8 часов, не допускать эмоциональных потрясений.
Прогноз для пациентов после операции благоприятный – продолжительность жизни может быть увеличена на 10-15 лет.
После того как проведено шунтирование сердца, восстановление должно проходить в точном соответствии данным рекомендациям, нельзя надеяться только на проведенную операцию. Профессионализм врача также играет большую роль.


