Стандартная антикоагулянтная терапия
Отделение сосудистой и эндокринной хирургии




В основе лечения всех венозных тромбоэмболических осложнений, включающих острый венозный тромбоз и тромбоэмболию легочной артерии, лежит антикоагулянтная терапия. По срокам использования она может быть разделена на:
- Инициальную (7-10 суток)
- Длительную (до 3-х месяцев)
- Продленную (более 3-х месяцев)
Инициальная антикоагулянтная терапия
Основными задачами инициальной антикоагулянтной терапии является остановка прогрессирования тромботического процесса и профилактика возможных осложнений (легочная эмболия, посттромботический синдром, постэмболическая легочная гипертензия). Для этой цели могут быть использованы парентеральные антикоагулянты (нефркционированный и низкомолекулярные гепарины, фондапаринукс), которые вводятся подкожно или внутривенно. Золотым стандартом в лечении легочной эмболии с промежуточным или высоким риском летального исхода является назначение нефракционированного гепарина в виде постоянной внутривенной инфузии. В остальных случаях предпочтение отдается подкожному введению лечебных доз низкомолекулярных гепаринов или фондапаринукса.
Длительная антикоагулянтная терапия
Основной задачей длительной антикоагулянтной терапии является профилактика ранних рецидивов венозных тромбоэмболических осложнений, опасность развития которых наиболее высока в течение первых 3-х месяцев с момента возникновения первого эпизода.
На протяжении долгого периода времени стандартной схемой длительной антикоагулянтной терапии являлся переход с гепаринов на антагонисты витамина К (варфарин) с достижением целевого значения (2, 0-3, 0) лабораторного показателя МНО, отражающего степень разжижения крови.
Варфарин является непрямым антикоагулянтом, который тормозит синтез в печени витамин-К зависимых факторов свертывания крови (II, VII, IX, X), что нарушает процесс тромбообразования. Его окончательный эффект в виде значительного разжижения крови развивается через 3-5 дней. В то же время, препарат нарушает синтез естественных антикоагулянтов (протеин С), что наблюдается в более ранние сроки, поэтому в первые дни приема препарата может развиваться парадоксальная избыточная склонность к тромбообразованию и рецидивы венозного тромбоза. Именно поэтому стандартный переход с парентеральных гепаринов на варфарин подразумевает обязательное одновременное использование обоих антикоагулянтов на протяжении не менее 5 суток.
Обычно пациенту, получающему парентеральные гепарины, назначается стандартная доза варфарина (5 мг) и далее каждые 2-3 дня контролируется показатель МНО. Как только регистрируются два последовательных значения МНО в терапевтическом диапазоне (2, 0-3, 0), гепарины отменяются, и пациент продолжает применять варфарин в подобранной дозе. Именно этот период двойной антикоагулянтной терапии наиболее опасен в плане развития кровотечений.
К сожалению, варфарин обладает сложной фармакокинетикой и характеризуется множественными взаимодействиями с пищевыми продуктами и другими лекарственными препаратами. Его эффективность зависит от индивидуальной генетически детерминированной активности печеночного фермента витами-К-зависимой эпоксидредуктазы, а также ферментных системам группы цитохрома р450. Это определяет необходимость индивидуального подбора дозы препарата и ее регулярной коррекции.
Пациент, принимающий варфарин, должен постоянно контролировать показатель МНО и регулярно изменять дозу препарата, если показатель выходит за пределы терапевтического диапазона. Избыточное разжижение крови (МНО более 3, 0) опасно развитием кровотечений, в том числе угрожающих жизни (желудочно-кишечное кровотечение, геморрагический инсульт, забрюшинная гематома). В то же время недостаточное разжижение крови (МНО менее 2, 0), не защищает от развития повторного венозного тромбоза, но также значительно повышает риск кровотечений, что определяет опасность применения препарата.
Таким образом, постоянный прием варфарина накладывает на пациента ряд ограничений:
- Регулярные визиты в поликлинику и контроль МНО
- Ограничение в рационе питания
- Контроль за лекарственными взаимодействиями
- Частая коррекция дозы препарата
- Затраты времени, сил и средств для постоянного мониторинга индивидуальной эффективности терапии варфарином
В то же время, отказ от регулярного мониторинга за эффективностью приема варфарина чреват развитием жизнеугрожающих осложнений, как тромботических, так и геморрагических. Следует помнить, что варфарин, как и все антикоагулянты, относится к категории особо опасных препаратов, применение которых требует большой ответственности.
Продленная антикоагулянтная терапия
Задачей продленной антикоагулянтной терапии является профилактика отдаленных рецидивов венозных тромбоэмболических осложнений. Она показана, в первую очередь, пациентам с идиопатическим и рецидивирующим тромбозом. Ее продолжительность может составлять от 6 месяцев до пожизненного приема препарата. С целью пролонгированной терапии в рамках стандартной схемы лечения также используется варфарин в индивидуально подобранной под контролем МНО дозе. С одной стороны, продленная терапия снижает риск развития повторных эпизодов тромбоза и легочной эмболии, но с другой стороны, повышает опасность развития кровотечения. Поэтому вопрос о необходимости пролонгированной, в особенности, неопределенно долгой, терапии решается индивидуально для каждого пациента.
Общий срок необходимой антикоагулянтной терапии зависит от характера тромбоза и выявленных клинических факторов риска:
Клинические обстоятельства
Длительность использования антикоагулянтов
Первый эпизод, сопряженный с обратимым фактором риска (травма, операция, острое нехирургическое заболевание)
ТГВ: 3 месяца при дистальной локализации тромбоза (голень) ; при обширном проксимальном тромбозе желательно продлить до 6 месяцев
ТЭЛА: не менее 3 месяцев
Впервые возникший неспровоцированный эпизод
Не менее 3 месяцев; продление на неопределенно долгий срок при проксимальном ТГВ и/или ТЭЛА, низком риске кровотечения и возможности поддерживать стабильный уровень антикоагуляции
НМГ на 3-6 месяцев; в дальнейшем продление использования антикоагулянтов на неопределенно долгий срок или, по крайней мере, до излечения онкологического заболевания
Лечение выполняется в отделении:
Отделение сосудистой и эндокринной хирургии
Хирургическое лечение заболеваний сосудов, узловых образований щитовидной и паращитовидных желез, опухолей щитовидной железы и надпочечников, общехирургической патологии
Виды антикоагулянтной терапии, особенности воздействия, кому необходима и противопоказана, ее минусы, и особенности проведения после операции

Антикоагулянтная терапия применяется для лечения болезней, сопровождающихся повышенной свертываемостью крови. Она основана на приеме препаратов, препятствующих развитию тромбоза и тромбоэмболии. Подобная медикаментозная терапия является достаточно молодым способом лечения, но клинические результаты уже позволяют ее широко применять.
Медицинская справка
Для наглядного понимания принципа действия антикоагулянтных препаратов стоит рассмотреть процесс формирования тромбов. На первой стадии тромбообразования из протромбина, который формируется в печени, происходит синтез фермента тробмина. Этому способствует влияние тромбопластина, который содержится в мембранах клеток тканей, витамина К (викасола) и ионов кальция. Далее тромбин воздействует на фибриноген, в результате чего образуется фибрин, нити которого и составляют оболочку тромба.
 Схема образования тромба
Схема образования тромба
Таким образом, предотвратить развитие тромбоза и тромбоэмболии на микроуровне можно прямым и непрямым способом воздействия.
Препараты прямого действия
К прямым антикоагулянтам относятся препараты, содержащие гепарин в чистом виде либо его производные, а также герудин. Особенность их воздействия заключаются в непосредственном вмешательстве в процесс синтеза фибрина из фибриногена, угнетении влияния на него тромбина. Гепарин отличается тем, что действует не только внутри организма, но и в лабораторных условиях (в пробирке).
Антикоагулянты прямого действия вводятся парентеральным способом (инъекцией) под кожу либо внутривенно. Им свойственно быстро давать нужный результат. Так как гепарин (основное действующее вещество) получают из биологического сырья животных, он проходит низкомолекулярную обработку.
Подобное лечение обязательно должно контролироваться профильным врачом, с постоянным отслеживанием уровня гемоглобина и гематокрита, а также артериального давления с целью предотвращения кровотечений
Препараты непрямого действия
Антикоагулянты непрямого воздействия препятствуют синтезу тромбина из протромбина путем замещения собой викасола. Такое возможно из-за их структурного сходства. Действующее вещество препарата не обладает свойствами и функциональностью витамина К, а, механически замещая его в процессе синтеза, понижает концентрацию тромбина в крови и ведет к гипокоагуляции.
Антикоагулянты непрямого действия, в отличие от первой группы препаратов, способны менять свойства крови только в организме.
Препараты непрямого действия выпускаются в таблетированной или капсульной форме и предполагают длительное применение, так как имеют накопительный эффект (через 3-5 дней). В основном используется варфарин, аценокумарол, фениндион. Препараты на основе варфарина назначаются даже при установленных сердечных имплантатах (протезах клапанов) и острых тяжелых венозных тромбозах.
Важно! Развитие тромбозов вен наиболее характерно для нижних конечностей.
Резкое прекращение приема антикоагулянтных препаратов непрямого воздействия может дать обратный эффект и привести к тромбозу. Снижают дозу под контролем врача и постепенно, постоянно отслеживая изменения показателей крови.
 Препараты непрямого действия
Препараты непрямого действия
Показания к антикоагулянтной терапии
Антикоагулянтные препараты применяются в терапии тромбоэмболии и тромбоза и для профилактики этих явлений.
Основной перечень показаний:
- подготовка к хирургическому вмешательству на сердце или сосудах;
- тромбофлебит поверхностных вен нижних конечностей;
- прогрессирование левожелудочковой аневризмы;
- мерцательная аритмия;
 Мерцательная аритмия
Мерцательная аритмия
- тромбоэмболия легочной артерии;
- инфаркт миокарда;
- облитерирующий эндартериит либо тромбангиит.
Пациентов с этими заболеваниями лечат антикоагулянтами и прямого, и непрямого действия.
Противопоказания к лечению антикоагулянтами
Подобная терапия представляет опасность для пациентов с такими заболеваниями:
- болезни пищеварительной системы (язва желудка, эрозия либо язва кишечника и др.), по причине высокой угрозы кровотечения;
 Язва желудка
Язва желудка
- патологии почек с признаками гематурии и симптомами недостаточности;
- дисфункция желчевыделительных и/или протромбинобразовательных свойств печени (цирроз, гепатит в хронической форме и др.);
- беременность – из-за риска возникновения кровотечений после родов или тератогенного воздействия на плод;
- дефицит витаминов С и К;
- наличие в спинномозговой жидкости примесей крови;
- подострый септический эндокардит;
- заболевания крови, приведшие к гипопротромбинемии и дисфункции гемостатических механизмов;
- травмы головного мозга, вызывающие снижение реакции.
Особенности применения
Антикоагулянты непрямого воздействия начинают работать, когда их действующих компонент накопится в организме в достаточном количестве. Эти лекарства созданы только для перорального приема. Они основываются на:
- варфарине;
- фениндионе;
- аценокумароле.
Данные фармсредства рассчитаны для продолжительного приема. Медикаменты с варфарином можно принимать пациентам с установленными сердечными имплантами или острым венозным тромбозом.
Медикаменты с непрямым действием меняют свойства крови только в организме. Если они будут резко отменены, это может привести к прогрессированию тромбоза. Доза препарата должна снижаться постепенно и только под врачебным контролем. Во время лечения нужно систематически проверять состояние крови.
 Варфарин
Варфарин
Прием антикоагулянтов после операции
Многочисленные исследования показали, что после хирургического вмешательства антикоагулянтная терапия должна основываться на медикаментах с низкомолекулярным содержанием гепарина или варфарина. Тромбоэмболическое осложнение может возникнуть только в первые семь дней после оперативной процедуры.
Специалисты считают использование Фраксипарина на этом этапе самым безопасным медикаментозным методом.
Препарат нужно вводить внутренне, но не с помощью внутримышечных инъекций. При расчете дозы врач учитывает:
- степень риска;
- вес пациента;
- вид проведенной операции.
Фраксипарин вводится раз в сутки.
При развитии у пациента тромбоза глубоких вен Фраксипарин вводится дважды в сутки с промежутком в 12 часов.
Препарат можно использовать на 4-9 месяце беременности, но только если у пациентки наблюдается высокая вероятность развития венозного тромбоза.
 Фраксипарин
Фраксипарин
Проведение тройной антикоагулянтной терапии (ТАТ)
Такая терапевтическая схема позволяет снизить риск развития тромботического и тромбоэмболического процесса. Соответствующая методика подбирается доктором.
Проведение ТАТ эффективно борется с:
- ИБС;
- инсультом;
- недостаточностью сердца;
- фибрилляцией предсердий;
- острым коронарным синдромом.
ТАТ предполагает совмещение варфарина, клопидогрела и медикаментов на основе ацетилсалициловой кислоты. Продолжительность лечения и дозу определяет только врач. Как правило, лечение длится 3-6 месяцев.
 Показание
Показание
Недостатки терапии на основе антикоагулянтов
Главный недостаток лечения – увеличение вероятности возникновения кровотечений. Они могут возникать не только на кожном покрове, но в ЖКТ и мозгу. В группу риска попадают пациенты, принимающие высокие дозы антикоагулянтов или препараты для повышения их эффективности.
Еще один важный минус – цена медикаментов. Самыми доступными антикоагулянтами считаются препараты с варфарином, однако их прием может негативно сказаться на крови. Антикоагулянты с гепарином рассчитаны для стационарного лечения.
Последний, но не маловажный недостаток антикоагулянтов – специфические негативные влияния на организм, среди которых:
- тромбоцитопения;
- проблемы с эпителием (даже некроз);
- тяжелая аллергия или приступ анафилактического шока.
 Тромбоцитопения
Тромбоцитопения
Как узнать, что антикоагулянты действуют?
Для проверки эффективности непрямых антикоагулянтов был разработан специальный критерий МНО. Согласно ему:
- у больного, не употребляющего медикамент, МНО меньше 1,0;
- у больного, лечащегося Варварином или его аналогами, МНО достигает 2,0 – 3,0 ( такие показатели сигнализируют о возможном кровотечении);
- МНО 1,0 – 2,0 предупреждает о возможном ишемическом инсульте;
- МНО свыше 4,0 показывает несвертывание крови и возможный геморрогический инсульт.
Действие прямых антикоагулянтов проверить невозможно.
Необходимость проверки эффективности антикоагулянтов возникает в ситуациях, когда пациент потерял сознание. Если в его медкарте нет информации о приеме прямого антикоагулянта, определить его наличие в организме достаточно сложно. В такой ситуации введение новой дозы медикамента может вызвать передозировку.
 Потеря сознания
Потеря сознания
Действия при передозировке
Чтобы остановить кровотечение, пациенту вводят концентрированный протромбиновый комплекс, свежезамороженную плазму и Фитонадион.
Осложнения
Самым опасным и вероятным осложнением при приеме антикоагулянтов становится кровотечение из открытых ран, язв на слизистой ЖКТ или сосудов головного мозга. В зону риска попадают такие пациенты:
- вынужденные принимать антикоагулянты в больших количествах;
- страдающие неконтролируемой гипертензией;
- принимающие препараты, которые вступают в реакцию с антикоагулянтами;
- пожилые люди (старше 75-летнего возраста).
Возможны побочные явления, связанные с особенностями конкретного препарата. Так, при приеме варфина есть вероятность развития некрозов кожи. А гепарин способен значительно понизить количество в крови тромбоцитов.
 Осложнение при антикоагулянтной терапии
Осложнение при антикоагулянтной терапии
В любом случае лечение антикоагулянтами не терпит самодеятельности. Оно должно происходить строго под контролем медицинского персонала и при постоянном лабораторном наблюдении.
Информация для врачей
Антикоагулянтная терапия
Применение препаратов, препятствуюших свертыванию крови, или так называемая антикоагулянтная терапия, заняло свое законное место в лечении заболеваний, сопровождающихся различными тромбозами, лишь в середине двадцатого века, хотя сами вещества, обладающие противосвертывающим действием известны давно. Еще в древности было обнаружено, что ранка, остающаяся после укуса пиявки достаточно долго кровоточит, однако это было лишь наблюдение, т.к. основной целью гирудотерапии ( от лат. Hirudo – пиявка) было « отсасывание дурной крови» и не более того. В 30-х годах ХХ века из слюнных желез пиявок было получено вещество, названное гирудином. Однако ни гирудин, ни сама гирудотерапия распространения не получили. Во-первых, по причине трудности соблюдения условий асептики, во-вторых, по причине недоказанности общего антикоагулянтного действия пиявок. Более того, некоторые авторы описывали парадоксальный эффект от их применения – гирудотерапия с успехом использовалась для остановки носовых и горловых кровотечений.
Еще в 80-х годах ХIX века русский ученый И. П. Павлов обнаружил в крови, поступающей в малый круг кровообращения, вещество, затрудняющее ее свертывание. Он же первый высказал предположение о печеночной природе последнего. Лишь через 50 лет это вещество было выделено Хоуэллом из печени быка и названо гепарином ( от лат. hepar – печень). Дальнейшими исследованиями шведских авторов Холмгрена и Виландера было показано, что гепарин синтезируется особыми клетками печеночных капилляров – клетками Эрлиха – и является естественным антикоагулянтом. Быстрое и отчетливое противосвертывающее действие гепарина очень подходило для использования его в лечебных целях, однако имелись и некоторые неудобства. Во-первых, гепарин невозможно применять перорально, так как он распадается под действием пищеварительных ферментов и, естественно, теряет свои свойства. Во-вторых, продолжительность его действия невелика, что требует повторных введений препарата каждые четыре часа или длительной капельной инфузии. Все это в сочетании с относительной дороговизной производства гепарина ( во всяком случае, по тем временам) заставляло ученых искать более удобные и доступные средства.
В поисках препарата, лишенного недостатков гепарина, были использованы наблюдения, над массовым падежом скота, имевшим место в США в 20-х годам ХХ века. Причиной гибели животных были массивные кровоизлияния во внутренние органы. Этот случай получил название « болезни загнивающего клевера», так как позже выяснилось, что животные получали корм, содержащий донник, в котором в результате плохого силосирования накапливалось токсическое вещество 3:3’-метилен-бис- (4 -оксикумарин), обладавшее выраженными антикоагуляционными свойствами. Это вещество было синтезировано Линком и названо дикумаролом. В 1938 году учеными Солондтом и Бестом было высказано предположение о возможности использования дикумарола для лечения тромбозов камер сердца и коронарных артерий, а в 1945 году И. Райтом, Е. Николем, С. Пейджем были описаны первые убедительные результаты применения препарата на практике. Отечественный аналог дикумарола был синтезирован в Уральском филиале ВНИХФИ И. Я. Постовским и М. А. Понюковой в 1946 году и назван дикумарином. Вскоре чешскими химиками Росицким и Фучиком было синтезировано еще одно производное кумарина – препарат пелентан ( в России более известный как неодикумарин). Препарат отличался от дикумарина более быстрым наступлением эффекта менее выраженными кумулятивными свойствами и более быстрым выведением из организма. Еще через некоторое время в Ленинградском институте гематологии был синтезирован препарат фенилиндандион, близкий по фармакологическим свойствам к пелентану. Этот препарат, более известный как фенилин, и получил наибольшее распространение в нашей стране.
Каким же образом действуют антикоагуляниты? Чтобы понять механизм их действия, рассмотрим в упрощенном варианте процесс свертывания крови.
В первую фазу процесса свертывания происходит синтез основного фермента тромбина из протромбина, который, в свою очередь, синтезируется в печени. Этот процесс активируется тканевым тромбопластином и ионами кальция. Во вторую фазу под действием тромбина происходит образование фибрина из фибриногена. Нити фибрина и образуют прочный « каркас» тромба.
Исходя из механизмов действия антикоагулянтов, эти препараты делят на две большие группы: прямые и непрямые. Прямые антикоагулянты вмешиваются в процесс свертывания непосредственно, прямо угнетая действие какого-либо фактора. Так гепарин обладает антитромбиновым эффектом, т. е. он препятствует действию тромбина на процесс перехода фибриногена в фибрин. Исходя из этого становится ясно, что прямые антикоагулянты действуют не только в организме (in vivo), но и in vitro.
Механизм действия непрямых антикоагулянтов иной. Обладая структурным сходством с витамином К ( викасолом), веществом, участвующим в синтезе протромбина, но не обладая его свойствами, эти препараты вытесняют викасол из процесса синтеза протромбина, снижая концентрацию последнего в крови с возникновением гипокоагуляции. Непрямые антикоагулянты не изменяют свойств крови in vitro, т. к. действуют не на факторы коагуляции, а на процесс их синтеза.
Применение непрямых антикоагулянтов в лечебной практике поставило медиков перед серьёзной проблемой. Было необходимо каким-то образом оценивать степень достигнутой гипокоагуляции, так как при передозировке могли развиться серьёзные осложнения. В результате было предложено определять так называемый протромбиновый индекс. Методика его определения была предложена Квиком, и суть ее заключалась в следующем. К крови пациента, забранной в специальную кювету, содержащую цитрат натрия для предотвращения ее свертывания, добавлялся тромбопластин и ионы кальция, в результате чего происходила активация процесса коагуляции. Время, прошедшее от момента активации до образования нитей фибрина на стенках пробирки, получило название протромбинового времени. Однако более удобным оказалось вычислять не протромбиновое время, а протромбиновый индекс или отношение ( ПТИ, ПТО). Индекс является отношением протромбинового времени данного пациента к протромбиновому времени здорового человека ( примерно 16 сек.), принятому за 100%. В норме он варьирует от 70 до 110%, а при лечении антикоагулянтами достигает значений в диапазоне от 30 до 60%.
Использование в течение 60-ти лет непрямых антикоагулянтов в клинической практике с контролем за их эффектом с помощью ПТИ показало, что при определении индекса у здоровых людей с нормальной концентрацией факторов протромбинового комплекса, все используемые лабораторные реактивы ( так называемые тромбопластины), показывают примерно одну и ту же активность от 14 до 18 сек. Но при определении ПТИ у пациентов, принимающих антикоагулянты, различные тромбопластины дают сильно отличающиеся результаты. К примеру, при 50%-ном понижении концентрации факторов протромбинового комплекса, один тромбопластин дает удлинение времени свертывания плазмы в три раза, а другой реактив – в два. В результате, полученные лабораторные показатели резко отличаются друг от друга. Для характеристики степени реагирования тромбопластинов удлинением времени свертывания на один и тот же уровень снижения концентрации факторов протромбиновогокомплекса был введен показатель чувствительности тромбопластина ( не путать с активностью тромбопластина!). Активность тромбопластина может быть приемлемой, к примеру, 15 секунд, но увеличение времени свертывания, соответствующее снижению концентрации факторов протромбинового комплекса на 50%, незначительным ( т.е. тромбопластин имеет низкую чувствительность). В результате, такой тромбопластин даст завышенный результат ПТИ, а врач, регулирующий антикоагулянтную терапию, будет увеличивать дозу препарата с опасностью геморрагических осложнений. Если же тромбопластин имеет высокую чувствительность, т.е. резко удлиняет время свертывания при том же 50%-ном снижении концентрации факторов протромбинового комплекса, то даже при незначительном снижении концентрации последних лаборант может выдать низкое значение ПТИ. В этом случае, врач будет необоснованно уменьшать дозу антикоагулянта с опасностью возникновения у больного тромбоза или эмболии.
Для того, чтобы преодолеть возникающую путаницу при определении ПТИ, предпринимаются действия по стандартизации тромбопластинов по отношению к стандартному тромбопластину Всемирной организации здравоохранения ( ВОЗ) с выведением для каждого вида тромбопластина так называемого международного индекса чувствительности ( МИЧ). Тромбопластин не должен давать удлинение времени свертывания на стандартное снижение концентрации факторов тромбопластинового комплекса более или менее, чем на 20% от стандарта ВОЗ. Протромбиновое отношение ( время,индекс) стали выражать в виде так называемого МНО ( Международное нормализованное отношение). Показатель МНО в единицах уже не будет меняться в зависимости от чувствительности и активности каждого тромбопластина, если известен его МИЧ и активность.
 Наиболее точное определение МНО может быть выполнено с помощью коагулометров, основанных на оптическом или механическом методах регистрации свертывания крови. Самым доступным из таких приборов является МИНИЛАБ 701 ( рис.1) производства фирмы ЮНИМЕД ( г. Москва) ( www.unimedao.ru). Показатели МИЧ и активности используемого тромбопластина вводятся в параметры прибора, а результат МНО выдается автоматически.
Наиболее точное определение МНО может быть выполнено с помощью коагулометров, основанных на оптическом или механическом методах регистрации свертывания крови. Самым доступным из таких приборов является МИНИЛАБ 701 ( рис.1) производства фирмы ЮНИМЕД ( г. Москва) ( www.unimedao.ru). Показатели МИЧ и активности используемого тромбопластина вводятся в параметры прибора, а результат МНО выдается автоматически.
Однако даже достоверное определение МНО не убавляет огромного количества проблем, возникающих при применении антикоагулянтов.
Синтез протромбина в организме человека зависит от многих факторов, но главный – это количество витамина К, поступающего в организм с пищей. В связи с этим подобрать дозу антикоагулянта, которая бы обеспечивала стабильный уровень МНО достаточно сложно. Поэтому пациенту, получающему антикоагулянты, необходимо регулярно определять этот показатель с тем, чтобы периодически ( хотя бы один раз в месяц) корректировать дозу лекарства. А это не всегда возможно, особенно в условиях России, где до ближайшей больницы, способной определить МНО ( даже не говоря о точности определения), может оказаться не одна сотня километров. И если для больного, к примеру, варикозным расширением вен голени уровень МНО имеет не фатальное значение, то для человека с механическим протезом клапана сердца значительные отклонения могут привести к смертельному осложнению. Кроме того, нередко наблюдается повышенная устойчивость к антикоагулянтам, когда должный уровень свертываемости удается поддержать лишь назначением больших доз препарата ( до 8 таблеток фенилина в сутки).
Абсолютными противопоказаниями для антикоагулянтной терапии являются:
- язвенная болезнь желудка и другие заболевания желудочно-кишечного тракта с наклонностью к кровотечениям
- заболевания почек с признаками гематурии или с симптомами явной почечной недостаточности
- заболевания печени, сопровождающиеся недостаточностью протромбиноообразовательной и желчевыделительной функции ( циррозы, хронические гепатиты и холангиты)
- заболевания крови с нарушением гемостатических механизмов и гипопротромбинемией
- К- и С-витаминная недостаточность
- подострый септический эндокардит
- беременность
- травмы головного мозга, сопровождающиеся заторможенностью, а также при наличии крови в спиномозговой жидкости
Отдельной проблемой является проведение антикоагулянтной терапии во время беременности из-за повышения риска развития серьезных послеродовых кровотечений. Следует также отметить, что непрямые антикоагулянты пагубно влияют на плод, поэтому их применение во время беременности противопоказано.
Антикоагулянтная терапия у пациентов с клапанными пороками сердца
*Импакт фактор за 2018 г. по данным РИНЦ
Читайте в новом номере
Институт клинической кардиологии им. А.Л. Мясникова РКНПК МЗ РФ
В последние годы показания к антикоагулянтной терапии у пациентов, страдающих заболеваниями сердца и сосудов, прогрессивно расширяются. В значительной мере это обусловлено результатами международных многоцентровых исследований, появлением новых антикоагулянтных препаратов и созданием более безопасных и надежных тест–систем контроля уровня гипокоагуляции.
Между тем, тактика антикоагулянтной терапии даже для группы больных с наибольшим риском тромбоэмболических осложнений, страдающих “клапанной болезнью” сердца, не имеет строгих, научно–обоснованных протоколов. Обобщенные научные результаты позволяют говорить не о стандартах, а о современных рекомендациях, которые в целом могут быть распространены на группу пациентов и оказывают помощь при индивидуализации назначений у конкретного пациента (R.Becker, J.Ansell., 1995; J.Acar et al.,1996; Е.П. Панченко, А.Б. Добровольский, 1999; С.Л. Дземешкевич, Л.У. Стивенсон, 2000; F.Unger et al., 2000). Речь можно вести лишь о принципах, которые с известной периодичностью следует пересматривать по мере совершенствования кардиохирургии и роста возможностей медикаментозной антикоагулятной терапии.
Чтобы правильно использовать эти принципы и обоснованно их индивидуализировать, необходимо знать основные положения и достижения современной хирургии клапанов сердца:
• диагностику стадий заболевания и патогенетические механизмы компенсации
• виды клапанных протезов и варианты пластических реконструкций клапанов и предсердий
• особенности течения раннего периода после операции и последствия перенесенных послеоперационных осложнений
• достоверность использованных методик тест–контроля эффективности антикоагулянтной терапии
• учитывать образ жизни пациента и сопутствующие заболевания (прежде всего это язвенная болезнь, гипертония, атеросклероз с гиперлипидемией, сахарный диабет, заболевания печени).
Перечисленное – это по сути алгоритм анализа конкретной ситуации перед принятием решения о вмешательстве в протокол антикоагулянтной терапии, подобранной в учреждении, где выполнено оперативное вмешательство.
В настоящей публикации мы излагаем взгляд на проблему, принятый в Отделе сердечно–сосудистой хирургии РКНПК МЗ РФ с учетом возможностей и уровня российской кардиологии и хирургии.
Современная антикоагулянтная терапия состоит из применения непрямых антикоагулянтов (сегодня в России это Фенилин, Синкумар и Варфарин) и антиагрегантов (Аспирин и его кишечно–растворимые формы: Аспирин– Кардио, ТромбоАСС). В раннем послеопреационном периоде и при ряде клинических ситуаций отдаленного послеоперационного периода необходимо использование гепарина. К сожалению, протоколы терапии гепаринами с низким молекулярным весом у пациентов с патологией клапанов сердца не отработаны, официальные рекомендации согласительных международных комиссий, основанные на результатах рандомизированных исследований, отсутствуют.
Оценка эффективности непрямых антикоагулянтов (НАКГ), как основных препаратов в профилактике тромбоэмболических осложнений у пациентов с заболеваниями клапанов сердца, в России значительно устарела. Поэтому, прежде чем анализировать весь спектр клинических ситуаций, влияющих на тактику антикоагулянтной терапии, необходимо определить современные требования к оценке терапии НАКГ.
К сожалению, в большинстве поликлиник и даже клиник России для оценки эффективности терапии непрямыми антикоагулянтами используют расчет протромбинового индекса (ПТИ), рекомендуя у пациентов с протезами клапанов сердца поддерживать его на уровне 30–50%. Между тем, современные исследования свидетельствуют о том, что ПТИ является некалиброванной величиной, информативность этого показателя недостаточна и существует опасность получения грубой ошибки. В течение последних лет все экспертные комитеты рекомендуют использовать для контроля терапии непрямыми антикоагулянтами величину Международного Нормализованного Отношения – МНО (INR– английская аббревиатура). Этот показатель учитывает чувствительность используемого тромбопластина, т.н. Международный Индекс Чувствительности – МИЧ (ISI– английская аббревиатура). Перевод всей службы коагулологии России на определение МНО нам представляется важнейшей и неотложной задачей (Е.П. Панченко, А.Б.Добровольский,1999). В последние годы в клиниках, внедривших в клиническую практику систему раннего и постоянного, домашнего самоконтроля пациентами состояния свертывающей системы крови (ESCAT – Early Self Controlled Anticoagulation Trial ) достигнуто значительное снижение риска тромбоэмболий и кровотечений, связанных с терапией НАКГ. Для этой цели уже разработаны простые и удобные в использовании мониторы – CoaguCheck Plus и INRange.
Рандомизированные исследования свидетельствуют о том, что эта система позволяет проводить оптимальный вариант антикоагуляции низкой интенсивности с минимальным риском как тромбоэмболических, так и геморрагических осложнений (Schutt U. et al .,2000).Тромбоэмболии у пациентов с механическими клапанами сердца удалось снизить практически в 2 раза. Это означает, что по значимости для улучшения отдаленных результатов протезирования клапанов сердца внедрение системы ESCAT сравнимо ,пожалуй, лишь с идеей обшивания седла искусственного клапанного протеза специальной манжеткой. Известно, что это предложение, сделанное более чем 30 лет назад A.Starr и Н.М.Амосовым, позволило снизить частоту тромбоэмболий с 63% до 17% (A.Starr et al.,1967). Наш начальный опыт работы в этом направлении подтверждает оптимизм авторов системы ESCAT и нуждается в дальнейшем расширенном внедрении ее в практику российских кардиологов.
Учет характера и объема хирургического вмешательства на клапанах сердца чрезвычайно важен для выбора тактики и протокола антикоагулянтной терапии. С учетом требуемой интенсивности антикоагуляции все виды хирургических вмешательств на клапанах сердца следует разделить на три группы: пластические реконструкции, имплантация механических протезов, имплантация биологических протезов и трансплантатов. Этот набор хирургических методик применим к любому из клапанов сердца (аортальный, митральный или трикуспидальный). Следует помнить, что пластические операции на аортальном клапане выполняют редко. И, напротив, протезирование трикуспидального клапана – последнее из возможных решений и у больных с приобретенными пороками также выполняется крайне редко. Пластика и протезирование митрального клапана – это хирургические процедуры, выполняемые примерно в соотношении 1:1.

Рис 1. Один из лучших современных протезов для замены митрального клапана – двухстворчатый протез SuMit (США). Супрааннулярное расположение позволяет надежно имплантировать протез,сохраняя при этом подклапанные структуры – хорды и папиллярные мышцы; бортик манжеты протеза, выступающий в предсердие – препятствие для напластований фибрина на створки протеза и,следовательно, условие для снижения риска дисфункций и тромбоэмболий.
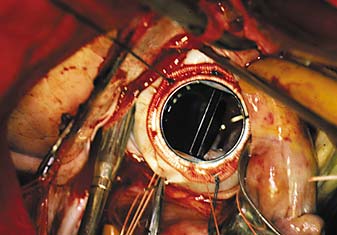
Рис 2.Пластические реконструкции при митральной недостаточности и, нередко, при митральном стенозе завершают имплантацией опорного кольца. Период эндотелизации последнего составляет около 3 мес – это время обязательной, тщательно контролируемой терапии НАКГ. На интраоперационном снимке кольцо AnnuloFlo (США) в митральной позиции.
С учетом этих возможностей современной кардиохирургии тактика антикоагулянтной терапии имеет существенные отличия. Начиная со второго дня после операции (через 24 часа) все наши пациенты получают в течение 5–7 дней гепарин 2500 (6 раз п/к. Далее до 3–х мес – непрямые антикоагулянты с поддержанием МНО на цифрах 2,0–3,0.
В дальнейшем у пациентов с пластикой аортального клапана или после его замены биопротезом можно отменить непрямые антикоагулянты, назначив в качестве постоянной терапии аспирин. Мы не поддерживаем ту точку зрения, что у молодых пациентов с механическим аортальным протезом возможна отмена непрямых антикоагулянтов и назначение только антиагрегантов: независимо от типа механических протезов считаем необходимой пожизненную антикоагулянтную терапию низкой интенсивности с поддержанием МНО на цифрах 2,0–2,5.
Изолированная пластическая реконструкция трикуспидального клапана практически не встречается в кардиохирургической практике (только у пациентов с болезнью Эбштейна), поэтому тактика антикоагулянтной терапии у них определяется объемом и характером вмешательства на других клапанах сердца, чаще митральном. Протезировать трикуспидальный клапан при такой сочетанной патологии нам не приходилось ни разу – практически всегда возможны надежные варианты реконструкции. По данным литературы, в связи с большим риском тромбозов механическихх протезов в трикуспидальную позицию предпочтительнее имплантировать биопротезы. С нашей точки зрения, даже при замене трикуспидального клапана биопротезом, интенсивность антикоагулянтной терапии должна быть выше, чем в других группах пациентов и при этом МНО следует поддерживать от 3,0 до 4,0.
Пациенты с митральным пороком сердца являются наиболее рискованными в плане риска тромбоэмболий : мерцательная аритмия и размеры левого предсердия более 5 см уже сами по себе являются показанием к постоянной терапии непрямыми антикоагулянтами. У пациентов с иснусовым ритмом и пластической реконструкцией митрального клапана (даже при анулопластике кольцом) антикоагулянты могут быть отменены через три месяца. Однако, даже при самом благоприятном течении послеоперационного периода мы рекомендуем им антиагреганты пожизненно (100–325 мг).
Если, несмотря на проводимую терапию НАКГ, у пациента – носителя искусственного клапанного протеза возник эпизод нарушения кровообращения, необходимо усиление антикоагулянтной терапии, даже при отсутствии стойкого неврологического дефицита. Как правило,в такой ситуации рекомендуют добавление антиагрегантной терапии. При наличии ЭХО–признаков избыточного тромбообразования на протезе, появлении клиники его дисфункции или при повторных тромбоэмболиях нужно ставить вопрос перед кардиохирургами о необходимости повторного хирургического вмешательства.
Антикоагулянтная терапия и некардиологические инвазивные (хирургические) процедуры или операции представляют одну из самых серьезных проблем отдаленого периода после протезирования клапанов сердца: риск кроется в необходимости прекращения или снижения интенсивности антикоагулянтной терапии (Ch. Gohlke–Barwolf, 2000).
Стоматологические вмешательства ставят эти вопросы наиболее часто. Наш опыт свидетельствует о том , что общую стратегию антикоагулянтной терапии у таких пациентов менять не следует: риск тромбоэмболий при отмене антикоагулянтов выше, чем риск кровотечения при продолжении приема непрямых антикоагулянтов. Применяемая нами антикоагулянтная терапия умеренной интенсивности позволяет выполнять практически любые стандартные дентологические вмешательства. За 1–2 суток до этого следует снизить МНО до уровня 2,0–2,5.
Такая же тактика, с удержанием МНО более 2, но менее 2,5 неоходима и при выполнении катетеризации сердца и сосудов. Естественно, после выполнения процедуры необходим повышеный контроль и местные мероприятия (давящая повязка, груз, холод) в зоне пункции.
При абдоминальных оперативных вмешательствах необходима отмена непрямых антикоагулянтов с переходом на терапию гепарином. Гепаринотерапию начинают при снижениии МНО до уровня менее 2,0, дозы контролируют по уровню АЧТВ, добиваясь его удлинения в 1,5–2,0 раза. Длительность перерыва в приеме непрямых антикоагулянтов определяется конкретной клинической ситуацией: при отсутствии признаков послеоперационного кровотечения (6–12 часов) вновь следует назначить непрямые антикоагулянты и отменить гепарин при достижении МНО 2,0 и более.
При неотложных, значительных по объему операциях, необходимо переходить на гепарин и при этом обязательно иметь и проводить инфузию свежезамороженной плазмы. Возможна потребность во внутривенном применении Вит К, несмотря на опасность анафилактической реакции.
Непрямые антикоагулянты, протезы клапанов и беременность – к счастью не частое сочетание, однако представляющее серьезную проблему. Нужно помнить о том, что непрямые антикоагулянты, проникая через плацентарный барьер, несут в себе угрозу серьезных врожденных аномалий в период закладки основных органов и систем (Born D. Et al.,1992; Ginsberg J., Hirsh J.,1998). Поэтому существует на сегодня два протокола антикоагулянтной терапии у женщин с искусственными протезами, желающими иметь ребенка. Одна стратегия не предусматривает изменения режима антикоагулянтной терапии и в течение всей беременности пациентки получают непрямые антикоагулянты с поддержанием МНО на цифрах около 2,5. Другая тактика требует назначения гепарина в течение первого триместра с отменой непрямых антикоагулянтов и повтор этого протокола за две недели до родов. Мы не имеем достаточной статистики, чтобы обосновать свою позицию. По данным Z.Ashour и соавт. (2000) из 100 беременных 66 были проведены по второму протоколу с гепарином и 34 с варфарином: в “гепариновой” группе здоровые дети родились у 38 женщин (57,8%), а в “варфариновой” группе у 18 (52,9%) – разница статистически недостоверна.Осложнения со стороны протезов имели место только в “гепариновой” группе: у 9 пациенток развились тромбозы протезов (из них 5 умерли, 4 были успешно реоперированы)
В целом, у женщин детородного возраста, которым предстоит операция на клапанах сердца и которые в перспективе хотят иметь ребенка, следует использовать все возможности для выполнения пластической, клапанносохраняющей операции. Использование биопротезов у пациенток с синусовым ритмом позволяет уменьшить риск тромбоэмболий и кровотечений, но ставит перед ними проблему повторной операции в связи с опасностью кальцификации и дисфункции биопротезов, которые с высокой степенью вероятности возникнут через 5–7 лет после родов. В любом случае, всем таким пациенткам нельзя рекомендовать беременность ранее 12 мес. после операции протезирования клапанов сердца, т.к. именно этот период наиболее тревожен в плане специфических протезных осложнений.
Такова на сегодняшний день стратегия антикоагулянтной терапии Отдела сердечно–сосудистой хирургии РКНПК МЗ РФ. Наш опыт позволяет достаточно уверенно рекомендовать использование этих принципов в ежедневной кардиологической практике.
1. Дземешкевич С.Л., Л.Уо.Стивенсон. Болезни митрального клапана: функция, диагностика, лечение. ГЭОТАР Медицина, Москва,2000.
2. Панченко Е.П., А.Б.Добровольский. Тромбозы в кардиологии. Механизмы развития и возможности терапии. СПОРТ И КУЛЬТУРА,Москва,1999.
3. Acar J., Iung B., Boissel J et al. AREVA: multicenter randomized comparison of low–dose versus standard–dose anticoagulation in patients with mechanical prosthetic heart valves. Circulation,1996,94,2:107–112.
4. Ashour Z., Shawky H., Hussein. Outcome of pregnancy in women with mechanical valves. Texas Heart Institute Journal, 2000,27,3,240–245.
5. Becker R., Ansell J. Antithrombotic therapy. An abbreviated reference for clinicians. Arch. Intern. Med., 1995,155:149–161.
6. Born D., Martinez E.,Almeida P. et al. Pregnancy in patients with prosthetic heart valves: the effect of anticoagulation on mather, fetus and neonate. Am Heart J. 1992,124: 413–417.
7. Ginsberg J., Hirsh J. Use of antithrombotic agents during pregnancy. Chest,1998,114 (5 suppl), 524–530.
8. Gohlke–Barwolf Ch. Anicoagulation in valvar heart disease: new aspects and management during non–cardiac surgery. Heart 2000;84:567–572.
9. Schutt U., Kortke H., Kleikampf G., Korfer R. Early start of INR self–management following mechanical heart valve replacement. (Доклад на 8 конференции Ассоциации сердечно–сосудистых хирургов Украины, Киев,2000).
10. Starr A., Herr R., Wood J. Mitral valve replacement: review of six years experience. J Cardiovasc. Surg., 1967,54,3: 333–359.
11.Unger F., Reiner W.,Horstkotte D. et al. Standards and concepts in valve surgery. Cor europaeum, 2000,8,174–182.
Виды антикоагулянтной терапии, особенности воздействия, кому необходима и противопоказана, ее минусы, и особенности проведения после операции
Российский национальный исследовательский медицинский университет им. Н.И. Пирогова – ОСП «Российский геронтологический научно-клинический центр», Москва, Россия
Введение
Современную кардиологию невозможно представить без использования антитромботических препаратов: антиагрегантов и антикоагулянтов.
В последние годы показания для антитромботической терапии (АТТ) существенно расширились, при этом увеличилось количество пациентов, получающих двойную (комбинация двух антиагрегантов или антиагреганта и антикоагулянта) или тройную (комбинация двух антиагрегантов и антикоагулянта) АТТ. Например, на основании результатов исследования COMPASS [1] в 2019 г. в нашей стране зарегистрировано новое показание для назначения ривароксабана в дозе 2,5 мг 2 раза в день в комбинации с ацетилсалициловой кислотой (АСК) с целью профилактики инсульта, инфаркта миокарда и смерти вследствие сердечно-сосудистых причин, а также предупреждения острой ишемии конечностей и общей смертности у пациентов с ишемической болезнью сердца или заболеванием периферических артерий. Это значит, что большинство пациентов с данными сердечно-сосудистыми заболеваниями имеют показания для двойной антитромботической терапии (ДАТТ) и при отсутствии противопоказаний должны получать ДАТТ неопределенно долго.
Риск желудочно-кишечных кровотечений при использовании антиагрегантов и антикоагулянтов
Применение как антиагрегантов, так и антикоагулянтов сопряжено с повышенным риском развития эрозивно-язвенных поражений желудка и 12-перстной кишки и опасностью желудочно-кишечных кровотечений (ЖКК), в т.ч. фатальных. По данным систематического обзора наблюдательных исследований [2], частота ЖКК при использовании низких доз АСК варьировала от 0,48 до 3,64 на 1000 пациенто-лет, а объединенный относительный риск (ОР) ЖКК составил 1,4 (95% доверительный интервал [ДИ]: 1,2–1,7). По данным мета-анализа [3] 14 рандомизированных плацебо-контролируемых исследований эффективности АСК при первичной и вторичной профилактике сердечно-сосудистых заболеваний с участием 57 000 пациентов, за которыми наблюдали в течение 12–76 месяцев, по сравнению с плацебо ОР ЖКК при лечении АСК составил 2,07 (95% ДИ: 1,61–2,66). По результатам крупного 5-летнего наблюдательного когортного исследования [4], в котором участвовало более 500,000 человек, у пациентов, принимавших АСК в дозах 100–150 мг/сут (n=27 694), частота ЖКК оказалась в 10 раз выше (0,6% против 0,06% в год), чем у здоровых лиц, не получавших АСК, нестероидные противовоспалительные препараты (НПВП), кортикостероиды и антикоагулянты (n=490 000). После внесения поправок на возраст, пол и сопутствующее применение препаратов с потенциальным ульцерогенным действием ОР ЖКК составил 2,6 (95% ДИ: 2,2–2,9). Таким образом, использование низких доз АСК ассоциируется с как минимум 2-кратным увеличением риска ЖКК.
Некоторые представители пероральных антикоагулянтов прямого действия (ППОАК) (дабигатран в дозе 150 мг, ривароксабан, эдоксабан в дозе 60 мг), в целом являющиеся более безопасными, чем варфарин, тем не менее увеличивают риск ЖКК [5–6]. Так, риск большого ЖКК у пациентов с неклапанной фибрилляцией предсердий (ФП), получавших дабигатран 150 мг 2 раза в день, был выше на 48% (ОР=1,48; 95% ДИ: 1,19–1,86; р
1. Eikelboom J.W., Connolly S.J., Bosch J., et al. COMPASS Investigators. Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med, 2017;377:1319–1330. Doi: 10.1056/NEJMoa1709118.
2. Garcia Rodriguez L.A., Martin-Perez M., Henne-kens C.H., et al. Bleeding Risk with Long-Term Low-Dose Aspirin: A Systematic Review of Observational Studies. PLoS One. 2016;11(8):e0160046. Doi: 10.1371/journal.pone.0160046.
3. Laine L. Review article: gastrointestinal bleeding with low-dose aspirin – what’s the risk? Aliment Pharmacol Ther. 2006;24:897–908. Doi: 10.1111/j.1365-2036.2006.03077.x.
4. Sorensen H.T., Mellemkjaer L., Blot W.J., et al. et al. Risk of upper gastrointestinal bleeding associated with use of low-dose aspirin. Am J Gastroenterol. 2000;95:2218–24. Doi: 10.1111/j.1572-0241.2000.02248.x.
5. Cheung K.S., Leung W.K. Gastrointestinal bleeding in patients on novel oral anticoagulants: Risk, prevention and management. World J Gastroenterol. 2017;23(11):1954–63. Doi: 10.3748/wjg.v23.i11.1954.
6. Fawzy A.M., Yang W.Y., Lip G.Y. Safety of direct oral anticoagulants in real-world clinical practice: translating the trials to everyday clinical management. Expert Opin Drug Saf. 2019;18(3):187–209. Doi: 10.1080/14740338.2019.1578344.
7. Connolly S.J., Ezekowitz M.D., Yusuf S., et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361:1139–51. Doi: 10.1056/NEJMoa0905561.
8. Patel M.R., Mahaffey K.W., Garg J., et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365:883–91. Doi: 10.1056/NEJMoa1009638.
9. Giugliano R.P., Ruff C.T., Braunwald E., et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2013;369:2093–104. Doi: 10.1056/NEJMoa1310907.
10. Ruff C.T., Giugliano R.P., Braunwald E., et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet. 2014;383:955–62. Doi: 10.1016/S0140-6736(13)62343-0.
11. Delaney J.A., Opatrny L., Brophy J.M., Suissa S. Drug drug interactions between antithrombotic medications and the risk of gastrointestinal bleeding. CMAJ. 2007;177(4):347–51. Doi: 10.1503/cmaj.070186.
12. Gao F., Chen X., Zhang J. Prevalence of gastric and small-intestinal mucosal injury in elderly patients taking enteric-coated aspirin by magnetically controlled capsule endoscopy. Gastroenterol Res Pract. 2019:1582590. Doi: 10.1155/2019/1582590.
13. Tziatzios G., Gkolfakis P., Papanikolaou I.S., Triantafyllou K. Antithrombotic treatment is associated with small-bowel video capsule endoscopy positive findings in obscure gastrointestinal bleeding: A systematic review and meta-analysis. Dig Dis Sci. 2019;64(1):15–24. Doi: 10.1007/s10620-018-5292-0.
14. Watanabe T., Sugimori S., Kameda N., et al. Small bowel injury by low-dose enteric-coated aspirin and treatment with misoprostol: a pilot study. Clin Gastroenterol Hepatol. 2008;6(11):1279–82. Doi: 10.1016/j.cgh.2008.06.021.
15. Iwamoto J., Mizokami Y., Saito Y., et al. Small-bowel mucosal injuries in low-dose aspirin users with obscure gastrointestinal bleeding. World J Gastroenterol. 2014;20(36):13133–138. Doi: 10.3748/wjg.v20.i36.13133.
16. Kolb J.M., Flack K.F., Chatterjee-Murphy P., et al. Locations and Mucosal Lesions Responsible for Major Gastrointestinal Bleeding in Patients on Warfarin or Dabigatran. Dig Dis Sci. 2018;63(7):1878–89. Doi: 10.1007/s10620-018-5007-6.
17. Sherwood M.W., Nessel C.C., Hellkamp A.S., et al. Gastrointestinal Bleeding in Patients With Atrial Fibrillation Treated With Rivaroxaban or Warfarin: ROCKET AF Trial. J Am Coll Cardiol. 2015;66(21):2271–81. Doi: 10.1016/j.jacc.2015.09.024.
18. Miller C.S., Dorreen A., Martel M., et al. Risk of Gastrointestinal Bleeding in Patients Taking Non–Vitamin K Antagonist Oral Anticoagulants: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2017;15(11):1674–83.e3. Doi: 10.1016/j.cgh.2017.04.031.
19. Оганов Р.Г., Симаненков В.И., Бакулин И.Г. и др. Коморбидная патология в клинической практике. Алгоритмы диагностики и лечения. Кардиоваскулярная терапия и профилактика. 2019;18(1):5–66. Doi: 10.15829/1728-8800-2019-1-5-66.
20. Sostres C., Gargallo C.J., Lanas A. Nonsteroidal anti-inflammatory drugs and upper and lower gastrointestinal mucosal damage. Arthritis Res Ther. 2013;15(Suppl 3):S3. Doi: 10.1186/ar4175.
21. Freedberg D.E., Kim L.S., Yang Y.X. The Risks and Benefits of Long-term Use of Proton Pump Inhibitors: Expert Review and Best Practice Advice From the American Gastroenterological Association. Gastroenterology. 2017;152(4):706–15. Doi: 10.1053/j.gastro.2017.01.031.
22. Xie Y., Bowe B., Li T., et al. Risk of death among users of Proton Pump Inhibitors: a longitudinal observational cohort study of United States veterans. BMJ Open. 2017;7(6):e015735. Doi: 10.1136/bmjopen-2016-015735.
23. Shiraev T.P., Bullen A. Proton Pump Inhibitors and Cardiovascular Events: A Systematic Review. Heart Lung Circ. 2018;27(4):443–50. Doi: 10.1016/j.hlc.2017.10.020.
24. Maggio M., Corsonello A., Ceda G.P., et al. Proton pump inhibitors and risk of 1-year mortality and rehospitalization in older patients discharged from acute care hospitals. JAMA Intern Med. 2013;173(7):518–23. Doi: 10.1001/jamainternmed.2013.2851.
25. Tai F.W.D., McAlindon M.E. NSAIDs and the small bowel. Curr Opin Gastroenterol. 2018;34(3):175–82. Doi: 10.1097/MOG.0000000000000427.
26. Washio E., Esaki M., Maehata Y., et al. Proton Pump Inhibitors Increase Incidence of Nonsteroidal Anti-Inflammatory Drug Induced Small Bowel Injury: A Randomized, Placebo-Controlled Trial. Clin Gastroenterol Hepatol. 2016;14(6):809–15.e1. Doi: 10.1016/j.cgh.2015.10.022.
27. Chen W.C., Lin K.H., Huang Y.T., et al. The risk of lower gastrointestinal bleeding in low-dose aspirin users. Aliment Pharmacol Ther. 2017;45 (12):1542–50. Doi: 10.1111/apt.14079.
28. Tozawa K., Oshima T., Okugawa T., et al. A Randomized, Double-Blind, Placebo-Controlled Study of Rebamipide for Gastric Mucosal Injury Taking Aspirin With or Without Clopidogrel. Dig Dis Sci. 2014;59(8):1885–90. Doi: 10.1007/s10620-014-3108-4.
29. Pittayanon R., Piyachaturawat P., Rerknimitr R., et al. Cytoprotective agent for peptic ulcer prevention in patients taking dual antiplatelet agents: A randomized, double-blind placebo-controlled trial. J Gastroenterol Hepatol. 2019;34(9):1517–22. Doi: 10.1111/jgh.14671.
30. Takeuchi K., Takayama S., Hashimoto E., et al. Effect of rebamipide on gastric bleeding and ulcerogenic responses induced by aspirin plus clopidogrel under stimulation of acid secretion in rats. J Gastroenterol Hepatol. 2014;29(Suppl 4):37–46. Doi: 10.1111/jgh.12774.
31. Nishida U., Kato M., Nishida M., Kamada G., Yoshida T., Ono S. et al. Evaluation of small bowel blood flow in healthy subjects receiving low-dose aspirin. World J Gastroenterol, 2011; 17(2): 226–30. Doi: 10.3748/wjg.v17.i2.226.
32. Mizukami K., Murakami K., Abe T., et al. Aspirin-induced small bowel injuries and the preventive effect of rebamipide. World J Gastroenterol. 2011;17(46):5117–22. Doi: 10.3748/wjg.v17.i46.5117.
33. Kurokawa S., Katsuki S., Fujita T., et al. A randomized, double-blinded, placebo-controlled, multicenter trial, healing effect of rebamipide in patients with low-dose aspirin and/or non-steroidal anti-inflammatory drug induced small bowel injury. J Gastroenterol. 2014;49(2):239–44. Doi: 10.1007/s00535-013-0805-2.
34. Watanabe T., Takeuchi T., Handa O., et al. A Multicenter, Randomized, Double-Blind, Placebo-Controlled Trial of High-Dose Rebamipide Treatment for Low-Dose Aspirin Induced Moderate-to-Severe Small Intestinal Damage. PLoS One. 2015;10(4):e0122330. Doi: 10.1371/journal.pone.0122330.
35. Chan E.W., Lau W.C., Leung W.K., et al. Prevention of Dabigatran-Related Gastrointestinal Bleeding With Gastroprotective Agents: A Population-Based Study. Gastroenterology. 2015;149(3):586–95.e3. Doi: 10.1053/j.gastro.2015.05.002.
36. Maruyama K., Yamamoto T., Aoyagi H., et al. Difference between the Upper and the Lower Gastrointestinal Bleeding in Patients Taking Nonvitamin K Oral Anticoagulants. Biomed Res Int. 2018;2018:7123607. Doi: 10.1155/2018/7123607.
37. Youn S.H., Lim H., Ju Y., et al. Effect of gastroprotective agents on upper gastrointestinal bleeding in patients receiving direct oral anticoagulants. Scand J Gastroenterol. 2018;53(12):1490–95. Doi: 10.1080/00365521.2018.1541478.
38. Yamashita T., Watanabe E., Ikeda T., et al. Observational study of the effects of dabigatran on gastrointestinal symptoms in patients with non-valvular atrial fibrillation. J Arrhythm. 2014;30:478–84. Doi: 10.1016/j.joa.2014.02.011.
39. Bytzer P., Connolly S.J., Yang S., et al. Analysis of upper gastrointestinal adverse events among patients given dabigatran in the RE-LY trial. Clin Gastroenterol Hepatol. 2013;11(3):246–52.e1-5. Doi: 10.1016/j.cgh.2012.10.021.
40. Мартынов А.И., Шептулин А.А., Маев И.В. и др. Новые возможности цитопротекции в лечении и профилактике заболеваний желудка и кишечника (резолюция Экспертного совета и обзор литературы). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2020;30(2):7–14. Doi: 10.22416/1382-4376-2020-30-2-7-14.
Виды антикоагулянтной терапии, особенности воздействия, кому необходима и противопоказана, ее минусы, и особенности проведения после операции
Российский национальный исследовательский медицинский университет им. Н.И. Пирогова – ОСП «Российский геронтологический научно-клинический центр», Москва, Россия
Введение
Современную кардиологию невозможно представить без использования антитромботических препаратов: антиагрегантов и антикоагулянтов.
В последние годы показания для антитромботической терапии (АТТ) существенно расширились, при этом увеличилось количество пациентов, получающих двойную (комбинация двух антиагрегантов или антиагреганта и антикоагулянта) или тройную (комбинация двух антиагрегантов и антикоагулянта) АТТ. Например, на основании результатов исследования COMPASS [1] в 2019 г. в нашей стране зарегистрировано новое показание для назначения ривароксабана в дозе 2,5 мг 2 раза в день в комбинации с ацетилсалициловой кислотой (АСК) с целью профилактики инсульта, инфаркта миокарда и смерти вследствие сердечно-сосудистых причин, а также предупреждения острой ишемии конечностей и общей смертности у пациентов с ишемической болезнью сердца или заболеванием периферических артерий. Это значит, что большинство пациентов с данными сердечно-сосудистыми заболеваниями имеют показания для двойной антитромботической терапии (ДАТТ) и при отсутствии противопоказаний должны получать ДАТТ неопределенно долго.
Риск желудочно-кишечных кровотечений при использовании антиагрегантов и антикоагулянтов
Применение как антиагрегантов, так и антикоагулянтов сопряжено с повышенным риском развития эрозивно-язвенных поражений желудка и 12-перстной кишки и опасностью желудочно-кишечных кровотечений (ЖКК), в т.ч. фатальных. По данным систематического обзора наблюдательных исследований [2], частота ЖКК при использовании низких доз АСК варьировала от 0,48 до 3,64 на 1000 пациенто-лет, а объединенный относительный риск (ОР) ЖКК составил 1,4 (95% доверительный интервал [ДИ]: 1,2–1,7). По данным мета-анализа [3] 14 рандомизированных плацебо-контролируемых исследований эффективности АСК при первичной и вторичной профилактике сердечно-сосудистых заболеваний с участием 57 000 пациентов, за которыми наблюдали в течение 12–76 месяцев, по сравнению с плацебо ОР ЖКК при лечении АСК составил 2,07 (95% ДИ: 1,61–2,66). По результатам крупного 5-летнего наблюдательного когортного исследования [4], в котором участвовало более 500,000 человек, у пациентов, принимавших АСК в дозах 100–150 мг/сут (n=27 694), частота ЖКК оказалась в 10 раз выше (0,6% против 0,06% в год), чем у здоровых лиц, не получавших АСК, нестероидные противовоспалительные препараты (НПВП), кортикостероиды и антикоагулянты (n=490 000). После внесения поправок на возраст, пол и сопутствующее применение препаратов с потенциальным ульцерогенным действием ОР ЖКК составил 2,6 (95% ДИ: 2,2–2,9). Таким образом, использование низких доз АСК ассоциируется с как минимум 2-кратным увеличением риска ЖКК.
Некоторые представители пероральных антикоагулянтов прямого действия (ППОАК) (дабигатран в дозе 150 мг, ривароксабан, эдоксабан в дозе 60 мг), в целом являющиеся более безопасными, чем варфарин, тем не менее увеличивают риск ЖКК [5–6]. Так, риск большого ЖКК у пациентов с неклапанной фибрилляцией предсердий (ФП), получавших дабигатран 150 мг 2 раза в день, был выше на 48% (ОР=1,48; 95% ДИ: 1,19–1,86; р
1. Eikelboom J.W., Connolly S.J., Bosch J., et al. COMPASS Investigators. Rivaroxaban with or without aspirin in stable cardiovascular disease. N Engl J Med, 2017;377:1319–1330. Doi: 10.1056/NEJMoa1709118.
2. Garcia Rodriguez L.A., Martin-Perez M., Henne-kens C.H., et al. Bleeding Risk with Long-Term Low-Dose Aspirin: A Systematic Review of Observational Studies. PLoS One. 2016;11(8):e0160046. Doi: 10.1371/journal.pone.0160046.
3. Laine L. Review article: gastrointestinal bleeding with low-dose aspirin – what’s the risk? Aliment Pharmacol Ther. 2006;24:897–908. Doi: 10.1111/j.1365-2036.2006.03077.x.
4. Sorensen H.T., Mellemkjaer L., Blot W.J., et al. et al. Risk of upper gastrointestinal bleeding associated with use of low-dose aspirin. Am J Gastroenterol. 2000;95:2218–24. Doi: 10.1111/j.1572-0241.2000.02248.x.
5. Cheung K.S., Leung W.K. Gastrointestinal bleeding in patients on novel oral anticoagulants: Risk, prevention and management. World J Gastroenterol. 2017;23(11):1954–63. Doi: 10.3748/wjg.v23.i11.1954.
6. Fawzy A.M., Yang W.Y., Lip G.Y. Safety of direct oral anticoagulants in real-world clinical practice: translating the trials to everyday clinical management. Expert Opin Drug Saf. 2019;18(3):187–209. Doi: 10.1080/14740338.2019.1578344.
7. Connolly S.J., Ezekowitz M.D., Yusuf S., et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med. 2009;361:1139–51. Doi: 10.1056/NEJMoa0905561.
8. Patel M.R., Mahaffey K.W., Garg J., et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med. 2011;365:883–91. Doi: 10.1056/NEJMoa1009638.
9. Giugliano R.P., Ruff C.T., Braunwald E., et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med. 2013;369:2093–104. Doi: 10.1056/NEJMoa1310907.
10. Ruff C.T., Giugliano R.P., Braunwald E., et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet. 2014;383:955–62. Doi: 10.1016/S0140-6736(13)62343-0.
11. Delaney J.A., Opatrny L., Brophy J.M., Suissa S. Drug drug interactions between antithrombotic medications and the risk of gastrointestinal bleeding. CMAJ. 2007;177(4):347–51. Doi: 10.1503/cmaj.070186.
12. Gao F., Chen X., Zhang J. Prevalence of gastric and small-intestinal mucosal injury in elderly patients taking enteric-coated aspirin by magnetically controlled capsule endoscopy. Gastroenterol Res Pract. 2019:1582590. Doi: 10.1155/2019/1582590.
13. Tziatzios G., Gkolfakis P., Papanikolaou I.S., Triantafyllou K. Antithrombotic treatment is associated with small-bowel video capsule endoscopy positive findings in obscure gastrointestinal bleeding: A systematic review and meta-analysis. Dig Dis Sci. 2019;64(1):15–24. Doi: 10.1007/s10620-018-5292-0.
14. Watanabe T., Sugimori S., Kameda N., et al. Small bowel injury by low-dose enteric-coated aspirin and treatment with misoprostol: a pilot study. Clin Gastroenterol Hepatol. 2008;6(11):1279–82. Doi: 10.1016/j.cgh.2008.06.021.
15. Iwamoto J., Mizokami Y., Saito Y., et al. Small-bowel mucosal injuries in low-dose aspirin users with obscure gastrointestinal bleeding. World J Gastroenterol. 2014;20(36):13133–138. Doi: 10.3748/wjg.v20.i36.13133.
16. Kolb J.M., Flack K.F., Chatterjee-Murphy P., et al. Locations and Mucosal Lesions Responsible for Major Gastrointestinal Bleeding in Patients on Warfarin or Dabigatran. Dig Dis Sci. 2018;63(7):1878–89. Doi: 10.1007/s10620-018-5007-6.
17. Sherwood M.W., Nessel C.C., Hellkamp A.S., et al. Gastrointestinal Bleeding in Patients With Atrial Fibrillation Treated With Rivaroxaban or Warfarin: ROCKET AF Trial. J Am Coll Cardiol. 2015;66(21):2271–81. Doi: 10.1016/j.jacc.2015.09.024.
18. Miller C.S., Dorreen A., Martel M., et al. Risk of Gastrointestinal Bleeding in Patients Taking Non–Vitamin K Antagonist Oral Anticoagulants: A Systematic Review and Meta-analysis. Clin Gastroenterol Hepatol. 2017;15(11):1674–83.e3. Doi: 10.1016/j.cgh.2017.04.031.
19. Оганов Р.Г., Симаненков В.И., Бакулин И.Г. и др. Коморбидная патология в клинической практике. Алгоритмы диагностики и лечения. Кардиоваскулярная терапия и профилактика. 2019;18(1):5–66. Doi: 10.15829/1728-8800-2019-1-5-66.
20. Sostres C., Gargallo C.J., Lanas A. Nonsteroidal anti-inflammatory drugs and upper and lower gastrointestinal mucosal damage. Arthritis Res Ther. 2013;15(Suppl 3):S3. Doi: 10.1186/ar4175.
21. Freedberg D.E., Kim L.S., Yang Y.X. The Risks and Benefits of Long-term Use of Proton Pump Inhibitors: Expert Review and Best Practice Advice From the American Gastroenterological Association. Gastroenterology. 2017;152(4):706–15. Doi: 10.1053/j.gastro.2017.01.031.
22. Xie Y., Bowe B., Li T., et al. Risk of death among users of Proton Pump Inhibitors: a longitudinal observational cohort study of United States veterans. BMJ Open. 2017;7(6):e015735. Doi: 10.1136/bmjopen-2016-015735.
23. Shiraev T.P., Bullen A. Proton Pump Inhibitors and Cardiovascular Events: A Systematic Review. Heart Lung Circ. 2018;27(4):443–50. Doi: 10.1016/j.hlc.2017.10.020.
24. Maggio M., Corsonello A., Ceda G.P., et al. Proton pump inhibitors and risk of 1-year mortality and rehospitalization in older patients discharged from acute care hospitals. JAMA Intern Med. 2013;173(7):518–23. Doi: 10.1001/jamainternmed.2013.2851.
25. Tai F.W.D., McAlindon M.E. NSAIDs and the small bowel. Curr Opin Gastroenterol. 2018;34(3):175–82. Doi: 10.1097/MOG.0000000000000427.
26. Washio E., Esaki M., Maehata Y., et al. Proton Pump Inhibitors Increase Incidence of Nonsteroidal Anti-Inflammatory Drug Induced Small Bowel Injury: A Randomized, Placebo-Controlled Trial. Clin Gastroenterol Hepatol. 2016;14(6):809–15.e1. Doi: 10.1016/j.cgh.2015.10.022.
27. Chen W.C., Lin K.H., Huang Y.T., et al. The risk of lower gastrointestinal bleeding in low-dose aspirin users. Aliment Pharmacol Ther. 2017;45 (12):1542–50. Doi: 10.1111/apt.14079.
28. Tozawa K., Oshima T., Okugawa T., et al. A Randomized, Double-Blind, Placebo-Controlled Study of Rebamipide for Gastric Mucosal Injury Taking Aspirin With or Without Clopidogrel. Dig Dis Sci. 2014;59(8):1885–90. Doi: 10.1007/s10620-014-3108-4.
29. Pittayanon R., Piyachaturawat P., Rerknimitr R., et al. Cytoprotective agent for peptic ulcer prevention in patients taking dual antiplatelet agents: A randomized, double-blind placebo-controlled trial. J Gastroenterol Hepatol. 2019;34(9):1517–22. Doi: 10.1111/jgh.14671.
30. Takeuchi K., Takayama S., Hashimoto E., et al. Effect of rebamipide on gastric bleeding and ulcerogenic responses induced by aspirin plus clopidogrel under stimulation of acid secretion in rats. J Gastroenterol Hepatol. 2014;29(Suppl 4):37–46. Doi: 10.1111/jgh.12774.
31. Nishida U., Kato M., Nishida M., Kamada G., Yoshida T., Ono S. et al. Evaluation of small bowel blood flow in healthy subjects receiving low-dose aspirin. World J Gastroenterol, 2011; 17(2): 226–30. Doi: 10.3748/wjg.v17.i2.226.
32. Mizukami K., Murakami K., Abe T., et al. Aspirin-induced small bowel injuries and the preventive effect of rebamipide. World J Gastroenterol. 2011;17(46):5117–22. Doi: 10.3748/wjg.v17.i46.5117.
33. Kurokawa S., Katsuki S., Fujita T., et al. A randomized, double-blinded, placebo-controlled, multicenter trial, healing effect of rebamipide in patients with low-dose aspirin and/or non-steroidal anti-inflammatory drug induced small bowel injury. J Gastroenterol. 2014;49(2):239–44. Doi: 10.1007/s00535-013-0805-2.
34. Watanabe T., Takeuchi T., Handa O., et al. A Multicenter, Randomized, Double-Blind, Placebo-Controlled Trial of High-Dose Rebamipide Treatment for Low-Dose Aspirin Induced Moderate-to-Severe Small Intestinal Damage. PLoS One. 2015;10(4):e0122330. Doi: 10.1371/journal.pone.0122330.
35. Chan E.W., Lau W.C., Leung W.K., et al. Prevention of Dabigatran-Related Gastrointestinal Bleeding With Gastroprotective Agents: A Population-Based Study. Gastroenterology. 2015;149(3):586–95.e3. Doi: 10.1053/j.gastro.2015.05.002.
36. Maruyama K., Yamamoto T., Aoyagi H., et al. Difference between the Upper and the Lower Gastrointestinal Bleeding in Patients Taking Nonvitamin K Oral Anticoagulants. Biomed Res Int. 2018;2018:7123607. Doi: 10.1155/2018/7123607.
37. Youn S.H., Lim H., Ju Y., et al. Effect of gastroprotective agents on upper gastrointestinal bleeding in patients receiving direct oral anticoagulants. Scand J Gastroenterol. 2018;53(12):1490–95. Doi: 10.1080/00365521.2018.1541478.
38. Yamashita T., Watanabe E., Ikeda T., et al. Observational study of the effects of dabigatran on gastrointestinal symptoms in patients with non-valvular atrial fibrillation. J Arrhythm. 2014;30:478–84. Doi: 10.1016/j.joa.2014.02.011.
39. Bytzer P., Connolly S.J., Yang S., et al. Analysis of upper gastrointestinal adverse events among patients given dabigatran in the RE-LY trial. Clin Gastroenterol Hepatol. 2013;11(3):246–52.e1-5. Doi: 10.1016/j.cgh.2012.10.021.
40. Мартынов А.И., Шептулин А.А., Маев И.В. и др. Новые возможности цитопротекции в лечении и профилактике заболеваний желудка и кишечника (резолюция Экспертного совета и обзор литературы). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2020;30(2):7–14. Doi: 10.22416/1382-4376-2020-30-2-7-14.
Упражнения при грыже позвоночника
Упражнения при межпозвоночной грыже
Упражнения при грыже позвоночника позволяют восстановить здоровье позвоночника, способствуют укреплению мышц всех отделов позвоночника: шейного, грудного и поясничного, уменьшению размеров грыжи. Когда мышцы спины слабые, межпозвонковые диски при определенных условиях (травмы, большая нагрузка, резкие движения или падения) могут вылезти за пределы позвоночного столба. Так и образуется грыжа. Она начинает сдавливать нервные корешки, появляются боли. Выполняйте данный комплекс упражнений при грыже, пока не поздно и можно восстановить спину без операции. Все упражнения при межпозвоночной грыже показаны на фото. Внимательно им следуйте.
Упражнение 1 – для спины при грыже в пояснице



Исходное положение: лежим на спине на полу, руки – в сторону, ладонями вниз.
Не отрывая от пола верхнюю часть тела, плавно разворачиваем левое бедро вправо до упора. Левая нога при этом отрывается от пола, но остается прижатой к правой ноге. Задерживаемся так на 2-3 секунды и так же плавно возвращаемся в исходное положение. Повторяем то же самое с правым бедром в левую сторону. Это упражнение хорошо для укрепления продольных мышц спины.
Считаем повторы: вправо 8 повторов, и влево – 8 повторов. Это будет 1 подход. Первые 2-3 занятия нужно выполнять 1 подход, следующие 2-3 занятие уже по 2 подхода, затем все время по 3 подхода. Перерыв между подходами – 2 минуты.
Внимательно следим за дыханием! Не задерживаем. В исходном положении – вдох. На пике мышечного напряжения – выдох.
Упражнение 2 – при грудной грыже позвоночника



Исходное положение: лежим на спине, ноги в стороны, стопы на ширине плеч. Руки скрещены на груди, держаться для равновесия за плечи.
Делаем вдох и медленно поворачиваем корпус вправо до упора, отрываем от пола левое плечо. При этом таз и ноги двигаться не должны. Находимся в этом положении 2 секунды и возвращаемся в исходное. Затем делаем то же самое, но уже в другую сторону.
Считаем повторы: 8 повторов в одну сторону, 8 – в другую. Первые 2-3 занятия нужно выполнять 1 подход, следующие 2-3 занятие уже по 2 подхода, затем все время по 3 подхода. Перерыв между подходами – 2 минуты.
Следим за дыханием! Не задерживаем. В исходном положении – вдох. На пике мышечного напряжения – выдох.
Упражнение 3 – при грыже в пояснице



ПРИМЕЧАНИЕ! Следите, чтобы во время упражнения ноги не отрывались от пола. Чтобы ноги легче скользили, упражнение лучше выполнять в штанах и носках. Когда упражнение станет слишком легким, снимите носки, чтобы было сопротивление.
Исходное положение: лежим на спине, ноги вместе, носки на себя, руки разведены в стороны, ладони вниз.
Не отрывая от пола голову и плечи, двигаем обеими ногами влево, как бы скользя по полу, но не поднимая вверх. Напрягаются боковые мышцы живота и поясница. Задерживаемся в этом положении 2-3 секунды и так же аккуратно и скользя возвращаемся в исходное положение. Далее делаем аналогично, но уже в другую сторону.
Cчитаем повторы: 8 повторов в одну сторону, и 8 повторов в другую сторону. Первые 2-3 занятия нужно выполнять 1 подход, следующие 2-3 занятие уже по 2 подхода, затем все время по 3 подхода. Перерыв между подходами – 2 минуты.
Следим за дыханием! Не задерживаем. В исходном положении – вдох. На пике мышечного напряжения – выдох.
Упражнение 4 – при грыже грудного отдела позвоночника



Исходное положение: лежим на спине, ноги врозь, стопы на ширине плеч, руки скрещены на груди, ладони охватывают предплечья. Не отрывая туловище от пола, скользящим движением делаем максимальный наклон телом влево. Таз и ноги не должны двигаться.
Задерживаемся в наклоне на 2-3 секунды и плавно возвращаемся в исходное положение. Потом делаем то же самое, но в правую сторону.
Считаем повторы. Выполняем 8 поворотов в одну сторону, 8 – в другую. Это будет 1 подход. Первые 2-3 занятия нужно выполнять 1 подход, следующие 2-3 занятие уже по 2 подхода, затем все время по 3 подхода. Перерыв между подходами – 2 минуты.
Следим за дыханием. Не задерживаем. В исходном положении – вдох. На пике мышечного напряжения – выдох.
ПРИМЕЧАНИЕ! Если вам упражнения даются тяжело, можно положить под тело клеенки


Исходное положение: стоя с прямой спиной, смотрим перед собой. Медленно делаем небольшой наклон с прямой спиной, опустив руки вниз и согнув колени. Попа должна быть “оттопырена”. Остаемся в наклоне 2-3 секунды и плавно возвращаемся в исходное положение.
Считаем повторы. Делаем 3 подхода по 8 повторов. Начинающие начинают с 1-го подхода. Перерыв между ними – 2 минуты.
Следим за дыханием! Не задерживаем. В исходном положении – вдох. На пике мышечного напряжения – выдох.
Упражнение 6 – укрепление спины и поверхности бедра

Исходное положение: лежим на животе, руки вдоль туловища ладонями кверху, подбородок касается пола. Ноги закреплены. Максимально отрываем от пола туловище и одновременно поднимаем руки ладонями вверх.
Смотрим прямо перед собой. Замираем на 2-3 секунды и возвращаемся в исходное положение.
Считаем повторы. 8 – в одну сторону, 8 – в другую. Начинающие начинают с 1-го подхода. Перерыв между ними – 2 минуты.
Следим за дыханием! Не задерживаем. В исходном положении – вдох. На пике мышечного напряжения – выдох.
ПРИМЕЧАНИЕ! Если это упражнение дается тяжело, то можно начать с приподнимания груди от пола, напрягая и расслабляя мышцы. Затем постепенно увеличивать амплитуду движения.
Упражнение 7 – укрепление мышц живота



Исходное положение: лежим на левом боку, левая рука вытянута перед собой ладонью вниз. Правая рука вверху и касается ладонью пола.
Прямую правую руку и прямую правую ногу тянем друг к другу, приподнимаю ногу и руку одновременно. Голова приподнята, взгляд перед собой. Находимся в этом положении 2-3 секунды и медленно возвращаемся в исходное положение.
Считаем повторы. 8 повторов – это 1 подход. Начинающие начинают с 1-го подхода. Перерыв между ними – 2 минуты.
Следим за дыханием! Не задерживаем. В исходном положении – вдох. На пике мышечного напряжения – выдох.



Исходное положение: лежим на правом боку, правая рука вытянута перед собой ладонью вниз. Левая рука вверху и касается ладонью пола.
Прямую левую руку и прямую левую ногу тянем друг к другу, приподнимаю ногу и руку одновременно. Голова приподнята, взгляд перед собой. Находимся в этом положении 2-3 секунды и медленно возвращаемся в исходное положение.
Считаем повторы. Выполняем 8 повторов. Это будет 1 подход. Начинающие начинают с 1-го подхода. Перерыв между ними – 2 минуты.
Следим за дыханием! Не задерживаем. В исходном положении – вдох. На пике мышечного напряжения – выдох.
Упражнение 9 – растяжение поясничного отдела


Исходное положение: лежим на полу, руки вдоль туловища. Сгибаем ноги, аккуратно подтягивая стопы к ягодицам. Стараемся подтянуть максимально близко друг к другу – медленно. И медленно возвращаемся в исходное положение.
Следим за дыханием. Не задерживаем. В исходном положении – вдох. На пике мышечного напряжения – выдох.
Количество повторов. Выполняем 3 подхода по 12 повторов. Начинающие начинают с 1-го подхода. Перерыв между ними – 2 минуты.
Упражнение 10 – укрепление мышц пресса


Исходное положение: лежим на полу, руки – за головой, колени согнуты, ноги ступнями опираются на пол.
Не отрывая ног от пола, поднимаем голову и плечи, тянем их вперед. Напрягаем мышцы, задерживаемся в этом положении 2-3 секунды и плавно возвращаемся в исходное положение.
Следим за дыханием. Не задерживаем. В исходном положении – вдох. На пике мышечного напряжения – выдох.
Считаем повторы. Выполняем 3 подхода по 12 повторов. Начинающие начинают с 1-го подхода. Перерыв между ними – 2 минуты.
Данный комплекс упражнений при грыже позвоночника предусмотрен при отсутствии резких острых болей. Если боль есть и не дает выполнять упражнения при межпозвоночной грыже даже по 1 подходу и без утяжелителей – сначала необходимо обратится к неврологу для снятия болевого синдрома.
Эффект не стоит ожидать сразу! Только через 3-6 месяцев можно делать повторную МРТ для оценки результата.
После прохождения курса лечебной гимнастики с инструктором, запомнив правильность выполнения упражнений, вы сможете продолжать занятия дома. Рекомендуемая частота – 3 занятия в неделю. После прохождения курса из 10 занятий, можно выполнять гимнастику 2 раза в неделю для поддержания здоровой спины.
Стоимость 1 занятия с инструктором – 1000 руб. Продолжительность – 30 минут.
Наши специалисты

Запись в Пресненский центр: +7 (495) 266-30-55
Адрес: М. 1905 года, ул. 1905 года, д. 7 стр. 1




- Головные боли
- Боли в шее
- Боли в спине
- Нарушение осанки
- Боли в суставах
- Боли в ногах
| Клиника соответствует стандартам качества ISO 9001:2008 | |
| Победитель премии 2017 – Права потребителей и качество обслуживания | |
 | Победитель конкурса Клиника года 2016 |
 | Победитель премии Спорт и Россия 2017 |
Скачайте наше мобильное приложение Panacea


Записаться на прием можно :
1. По телефону 7 (495) 255-37-37
2. Через мобильное приложение PANACEA
3. Через агрегаторы DOC DOC, про Докторов и другие.
При оформлении документов необходимо иметь с собой паспорт.
- Рефлексотерапия
- Лечебная физкультура
- Физиотерапия
- УВТ
- Карта сайта
- Лечебная гимнастика
- Мануальная терапия
- Лечебный массаж
Имеются противопоказания, необходимо проконсультироваться со специалистом.
Информация, размещенная на сайте, не является публичной офертой. Актуальную информацию о ценах, акциях и предложениях уточняйте по телефону.




