Инспра : инструкция по применению
Состав
действующее вещество : эплеренон;
1 таблетка содержит 25 мг или 50 мг эплеренона;
вспомогательные вещества : лактоза моногидрат, целлюлоза микрокристаллическая натрия кроскармеллоза; гипромеллоза; натрия лаурилсульфат; тальк магния стеарат Opadry желтый YS-1-12524-А.
Лекарственная форма
Таблетки, покрытые пленочной оболочкой.
Основные физико-химические свойства: таблетки, покрытые пленочной оболочкой, желтого цвета, ромбовидной формы, со стилизованным гравировкой «Pfizer» с одной стороны таблетки и «NSR» над «25» или «50» – с другой стороны таблетки для таблеток по 25 мг и 50 мг соответственно.
Фармакологическая группа
Калийсберегающие диуретики. Антагонисты альдостерона. Эплеренон. Код АТХ C03D A04.
Фармакологические свойства
Механизм действия. Эплеренон имеет относительную селективность в связке с рекомбинантными рецепторами человека к минералокортикоидов по сравнению с его взаимодействием с рекомбинантными рецепторами человека в глюкокортикоидов, прогестерона и андрогенов. Эплеренон препятствует связыванию рецепторов с альдостерона – важным гормоном ренин-ангиотензин-, участвующий в регуляции артериального давления и задействована в патофизиологических механизмах развития сердечно-сосудистых заболеваний.
Фармакодинамические эффекты. Было продемонстрировано, что эплеренон приводит к стойкому повышению уровня ренина в плазме крови и уровня альдостерона в сыворотке крови, что совпадает с угнетением пути отрицательной обратной влияния альдостерона на секрецию ренина. При этом повышение активности ренина в плазме крови и уровней альдостерона в крови не приводит к подавлению действия эплеренона.
В ходе исследований по определению диапазона доз при хронической сердечной недостаточности (классы II-IV по классификации Нью-Йоркской кардиологической ассоциации (NYHA)) добавления эплеренона к стандартной схеме лечения приводило к ожидаемому дозозависимого повышение уровня альдостерона. Подобным образом в ходе кардиологическо-нефрологического исследования EPHESUS (исследование эффективности и летальности при применении эплеренона пациентам с острым инфарктом миокарда, осложненной дисфункцией левого желудочка и сердечной недостаточностью) лечение эплереноном приводило к значительному повышению уровня альдостерона. Полученные результаты подтверждают блокировки рецепторов минералокортикоидов в этой популяции.
Первичными конечными точками в исследовании EPHESUS были общая летальность и комбинированная конечная точка (летальный исход или госпитализация вследствие нарушений со стороны сердечно-сосудистой системы). 14,4% субъектов из группы эплеренона и 16,7% субъектов из группы плацебо умерли (по любым причинам), а 26,7% субъектов из группы эплеренона и 30% субъектов из группы плацебо достигли соответствия критериям комбинированной конечной точки (летальный исход или госпитализация вследствие нарушений со стороны сердечно-сосудистой системы). Таким образом, в ходе исследования EPHESUS эплеренон снижал риск летального исхода по любым причинам на 15% (ВР 0,85; 95% ДИ 0,75-0,96; p = 0,008) по сравнению с плацебо в основном за счет снижения летальности вследствие нарушений со стороны сердечно-сосудистой системы. Риск летального исхода или госпитализации вследствие нарушений со стороны сердечно-сосудистой системы при применении эплеренона был снижен на 13% (ВР 0,87; 95% ДИ 0,79-0,95, p = 0,002). Абсолютное снижение риска составило 2,3% для такой конечной точки как общая летальность, и 3,3% – для такой конечной точки, как летальный исход или госпитализация вследствие нарушений со стороны сердечно-сосудистой системы. Клиническая эффективность эплеренона, в первую очередь, была продемонстрирована при назначении лечения пациентам в возрасте до 75 лет. Польза от лечения субъектов в возрасте от 75 лет изучена недостаточно. Улучшение или стабилизацию показателей функциональной классификации по NYHA наблюдали в статистически значимо большей части субъектов, принимавших эплеренон, по сравнению с пациентами из группы плацебо. Частота развития гиперкалиемии составляла 3,4% в группе эплеренона и 2% в группе плацебо (p
Показания
- Дополнение к стандартному лечению с применением β-блокаторов с целью снижения риска заболеваемости и летальности, связанных с сердечно-сосудистыми заболеваниями, в стабильных пациентов с дисфункцией левого желудочка (фракция выброса левого желудочка ≤ 40%) и клиническими признаками сердечной недостаточности после недавно перенесенного инфаркта миокарда.
- Дополнение к стандартной оптимальной терапии с целью снижения риска заболеваемости и летальности, связанной с сердечно-сосудистыми заболеваниями, у взрослых пациентов с сердечной недостаточностью II класса (хронической) по классификации NYHA и дисфункцией левого желудочка (фракция выброса левого желудочка ≤ 30%) ( см. раздел «Фармакологические»).
Противопоказания
- Гиперчувствительность к эплеренона или к любой из вспомогательных веществ.
- Уровень калия в сыворотке крови> 5 ммоль / л на момент начала лечения.
- Почечная недостаточность тяжелой степени (расчетная скорость клубочковой фильтрации
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Фармакодинамические взаимодействия.
Калийсберегающие мочегонные препараты и калийсодержащими добавки. Эплеренон не следует назначать пациентам, получающим другие калийсберегающие мочегонные препараты и калийсодержащими добавки за повышенного риска развития гиперкалиемии (см. Раздел «Противопоказания»). Под влиянием калийсберегающих мочегонных препаратов также может усиливаться действие гипотензивных препаратов и других мочегонных средств.
Ингибиторы АПФ, блокаторы рецепторов ангиотензина. При применении эплеренона в комбинации с ингибитором АПФ и / или блокатор рецепторов ангиотензина риск гиперкалиемии может увеличиваться. Рекомендуется осуществлять тщательный контроль за уровнем калия в сыворотке крови и показателями функции почек, особенно у пациентов с риском нарушения функции почек, например, у пациентов пожилого возраста. Эплеренон не следует применять одновременно в тройной комбинации вместе с ингибитором АПФ и блокаторами рецепторов ангиотензина (см. Разделы «Противопоказания» и «Особенности применения»).
Литий. Исследования взаимодействия эплеренона с литием не проводили. Вместе с тем, у пациентов, получавших литий одновременно с ингибиторами АПФ и мочегонными препаратами, были описаны случаи токсического действия лития (см. Раздел «Особенности применения»). Следует избегать одновременного применения эплеренона и препаратов лития. Если нет возможности избежать применения этой комбинации необходимо контролировать уровень лития в плазме крови (см. Раздел «Особенности применения»).
Циклоспорин, такролимус. Циклоспорин и такролимус могут привести к нарушению функции почек и повысить риск развития гиперкалиемии. Следует избегать одновременного применения эплеренона и циклоспорина или такролимуса. В случае необходимости назначения циклоспорина и такролимуса в ходе лечения эплереноном рекомендуется тщательно контролировать уровень калия в сыворотке крови (см. Раздел «Особенности применения»).
Нестероидные противовоспалительные препараты (НПВП). За счет непосредственного влияния на клубочковую фильтрацию лечения НПВП может привести к острой почечной недостаточности, особенно у пациентов, входящих в группу высокого риска (пожилой возраст и / или обезвоживания). Пациентам, получающим эплеренон и НПВП, до начала лечения следует обеспечить адекватный водный режим и контролировать их функцию почек.
Триметоприм. Одновременное назначение триметоприма и эплеренона повышает риск развития гиперкалиемии. Следует контролировать уровень калия в сыворотке крови и показатели функции почек, особенно у пациентов пожилого возраста и пациентов с нарушением функции почек.
α-1-блокаторы (например, празозин, альфузозин). При комбинировании α-1-блокаторов и эплеренона существует возможность усиления гипотензивного действия и / или развития ортостатической гипотензии. В ходе одновременного применения α-1-блокаторов следует контролировать клиническое состояние пациентов по ортостатической гипотензии.
Трициклические антидепрессанты, нейролептики, амифостин, баклофен. Одновременное применение этих лекарственных средств и эплеренона потенциально может усиливать гипотензивное действие и повышать риск развития ортостатической гипотензии.
Глюкокортикоиды, тетракозактид. При одновременном назначении этих лекарственных средств и эплеренона существует возможность ослабления гипотензивного действия вследствие задержки жидкости и натрия.
Фармакокинетические взаимодействия.
Исследования in vitro свидетельствуют, что эплеренон не является ингибитором изоферментов CYP1A2, CYP2C19, CYP2C9, CYP2D6 или CYP3A4. Эплеренон не является субстратом или ингибитором Р-гликопротеина.
Дигоксин. Уровень системной экспозиции (AUC) дигоксина при одновременном применении с эплереноном растет на 16% (90% ДИ 4-30%). Следует с осторожностью назначать дигоксин в дозах, близких к верхней границе терапевтического диапазона.
Варфарин. Клинически значимых фармакокинетических взаимодействий с варфарином описано не было. Следует с осторожностью назначать варфарин в дозах, близких к верхней границе терапевтического диапазона.
Субстраты CYP3A4. Результаты фармакокинетических исследований с образцами-субстратами CYP3A4 (то есть мидазоламом и цизапридом) не выявили признаков выраженных фармакокинетических взаимодействий при одновременном применении этих средств и эплеренона.
- Мощные ингибиторы CYP3A4 При одновременном применении эплеренона и средств, угнетающих активность фермента CYP3A4, возможно развитие выраженных фармакокинетических взаимодействий. Под влиянием мощного ингибитора CYP3A4 (кетоконазол 200 мг 2 раза в сутки) AUC эплеренона увеличивалась на 441% (см. Раздел «Противопоказания»). Одновременное применение эплеренона и мощных ингибиторов CYP3A4 (кетоконазол, итраконазол, ритонавир, нелфинавира, кларитромицина, телитромицина и нефазадону) противопоказано (см. «Противопоказания»).
- Слабые и умеренные ингибиторы CYP3A4: применение одновременно с эритромицином, саквинавиром, амиодароном, дилтиазем, верапамил или флуконазолом приводило к выраженным фармакокинетических взаимодействий с повышением уровней AUC на 98-187%. Соответственно, при одновременном назначении эплеренона и слабых или умеренных ингибиторов CYP3A4 доза эплеренона не должна превышать 25 мг (см. Раздел «Способ применения и дозы»).
Индукторы CYP3A4. Одновременное применение эплеренона и зверобоя (мощный индуктор CYP3A4) приводило к снижению AUC эплеренона на 30%. Применение мощных индукторов CYP3A4 (таких как рифампицин) может приводить к более выраженному снижению AUC эплеренона. Из-за риска снижения эффективности эплеренона не рекомендуется применять одновременно с этим препаратом мощные индукторы CYP3A4 (рифампицин, карбамазепин, фенитоин, фенобарбитал, зверобой) (см. Раздел «Особенности применения»).
Антациды. Исходя из результатов клинического фармакокинетического исследования, при одновременном применении эплеренона и антацидных препаратов не ожидается выраженных взаимодействий.
Особенности применения
Гиперкалиемия. В ходе лечения эплереноном, согласно его механизма действия, возможно развитие гиперкалиемии. У всех пациентов в начале лечения и в ходе изменения дозы препарата следует контролировать уровень калия в сыворотке крови. В дальнейшем рекомендуется проводить периодический контроль, особенно у пациентов, входящих в группу риска возникновения гиперкалиемии (таких как пациенты пожилого возраста, пациенты с почечной недостаточностью (см. Раздел «Способ применения и дозы») и диабетом). После начала лечения эплереноном Не рекомендуется использовать калийсодержащими добавки за повышенного риска развития гиперкалиемии. Было продемонстрировано, что снижение дозы эплеренона приводит к снижению концентрации калия в сыворотке крови. В ходе одного исследования было продемонстрировано, что дополнительное назначение гидрохлоротиазида в ходе лечения эплереноном компенсировало повышение концентрации калия в сыворотке крови.
При применении эплеренона в комбинации с ингибитором АПФ и / или блокатор рецепторов ангиотензина риск гиперкалиемии может увеличиваться. Эплеренон не следует применять одновременно в тройной комбинации вместе с ингибитором АПФ и блокаторами рецепторов ангиотензина (см. Разделы «Противопоказания» и «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Нарушение функции почек. У пациентов с нарушениями функции почек (в том числе с диабетической микроальбуминурией) следует регулярно контролировать уровень калия. Снижение функции почек сопровождается повышением риска гиперкалиемии. Хотя результаты исследования EPHESUS, проведенного с участием пациентов с диабетом 2 типа и микроальбуминурией, ограничены, в этой малой группе пациентов наблюдали повышенную частоту возникновения гиперкалиемии. Соответственно лечение таких пациентов следует проводить с осторожностью. Эплеренон не удаляется с помощью гемодиализа.
Нарушение функции печени. У пациентов с легкими и умеренными нарушениями функции печени (классы А и В по классификации Чайлд-Пью) повышение уровня калия сыворотки крови более 5,5 ммоль / л не происходило. Такие пациенты нуждаются в контроле уровней электролитов. Применение эплеренона для лечения пациентов с тяжелыми нарушениями функций почек не изучали, поэтому эплеренон противопоказан к применению таким пациентам (см. Разделы «Способ применения и дозы» и «Противопоказания»).
Индукторы CYP3A4: одновременное применение эплеренона и мощных индукторов CYP3A4 Не рекомендуется (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Применение лития, циклоспорина, такролимуса следует избегать во время лечения эплереноном (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Фертильность. Информации о влиянии на фертильность человека нет.
В состав препарата входит лактоза моногидрат, поэтому его не следует назначать пациентам с редкими наследственными расстройствами (непереносимостью галактозы, врожденной недостаточностью лактазы Лаппа или синдромом нарушения всасывания глюкозы и галактозы).
Применение в период беременности или кормления грудью.
Беременность. Адекватных данных о применении эплеренона беременным женщинам нет. Сведения, полученные в ходе исследований на животных, не указывают на непосредственное или косвенное неблагоприятное влияние на течение беременности, развитие эмбриона и плода, роды и послеродовый развитие. Назначать эплеренон беременным женщинам следует с осторожностью.
Кормления грудью. Неизвестно, эплеренон проникает в грудное молоко после перорального применения. В то же время данные доклинических исследований свидетельствуют о наличии эплеренона и / или его метаболитов в молоке крыс и о нормальном развитии потомства, испытало влияние эплеренона следующим образом. Поскольку потенциал возникновения побочных эффектов у младенцев, находящихся на грудном вскармливании не исследован, следует решить, прекращать кормление грудью или прекращать применение препарата в зависимости от важности препарата для матери.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Исследований влияния эплеренона на способность управлять автотранспортом или другими механизмами не проводили. Эплеренон не вызывает сонливости или нарушения когнитивных функций, но в ходе управления автотранспортом или другими механизмами следует принимать во внимание возможность развития головокружения у ходе лечения.
Способ применения и дозы
Взрослые.
Для индивидуального подбора дозировки препарат существует в дозах 25 мг и 50 мг. Максимальная суточная доза составляет 50 мг в сутки.
Эплеренон можно применять как с пищей, так и независимо от приема пищи (см. Раздел «Фармакокинетика»).
Пациенты с сердечной недостаточностью после перенесенного инфаркта миокарда. Рекомендуемая поддерживающая доза эплеренона составляет 50 мг 1 раз в сутки. Лечение следует начинать с дозы 25 мг 1 раз в сутки и постепенно повышать до целевой дозы 50 мг 1 раз в сутки. Желательно достичь этого уровня дозы за 4 недели, учитывая уровень калия в сыворотке крови (см. Таблицу, приведенную ниже).
Лечение эплереноном обычно начинают через 3-14 дней после острого инфаркта миокарда.
Пациенты с сердечной недостаточностью II класса (хронической) по классификации NYHA. Лечение пациентов с хронической сердечной недостаточностью II класса по классификации NYHA следует начинать с дозы 25 мг 1 раз в сутки и постепенно повышать до целевой дозы 50 мг 1 раз в сутки. Желательно достичь этого уровня дозы за 4 недели, учитывая уровень калия в сыворотке крови (см. Таблицу ниже и раздел «Особенности применения»).
Пациентам, у которых уровень калия в сыворотке крови превышает 5 ммоль / л, не следует начинать лечение эплереноном (см. Раздел «Противопоказания»).
Уровень калия в сыворотке крови следует определять до начала лечения эплереноном, в ходе первой недели лечения и через месяц после начала лечения или коррекции дозы. В случае необходимости следует периодически определять уровень калия в сыворотке крови позже в течение лечения.
После начала лечения дозу препарата следует корректировать с учетом концентрации калия в сыворотке крови, как указано в таблице ниже.
Коррекция дозы после начала лечения.
Передозировка
Сообщений о побочных реакциях, связанные с передозировкой эплеренона у людей, получено не было. Ожидается, что наиболее вероятными проявлениями передозировки у человека будут артериальная гипотензия или гиперкалиемия. Эплеренон невозможно вывести из организма с помощью гемодиализа. Было продемонстрировано, что эплеренон эффективно связывается с активированным углем. При развитии артериальной гипотензии следует начинать поддерживающее лечение. При развитии гиперкалиемии следует начинать лечение согласно стандартам.
Побочные реакции
В ходе двух исследований (EPHESUS и EMPHASIS-HF) было продемонстрировано, что общая частота развития побочных реакций при применении эплеренона и плацебо была одинаковой.
Ниже приведены побочные реакции, которые, возможно, связаны с применением эплеренона и которые возникали в ходе лечения чаще, чем в ходе применения плацебо, или серьезные побочные реакции, возникающие в ходе лечения чаще, чем в ходе применения плацебо, или те, которые были описаны в ходе постмаркетингового наблюдения.
Побочные реакции классифицированы по системам органов и по абсолютной частоте: очень часто (≥ 1/10), часто (≥ 1/100 –
Инструкция по применению ИНСПРА (INSPRA)






Форма выпуска, состав и упаковка
Таблетки, покрытые оболочкой желтого цвета, ромбовидные, с надписью “Pfizer” на одной стороне и надписью “NSR” над цифрой “25” – на другой.
| 1 таб. | |
| эплеренон | 25 мг |
Вспомогательные вещества: лактозы моногидрат, целлюлоза микрокристаллическая (E460i), натрия кроскармеллоза (E466), гипромеллоза (E464), натрия лаурилсульфат (E487), тальк (E553), магния стеарат (E470).
Состав оболочки: опадрай желтый YS-1-12524-A (гипромеллоза 3cP (E464), гипромеллоза 6cP (E464), титана диоксид (E171), макрогол 400 (E1521), полисорбат 80 (E433), железа оксид желтый (E172), железа оксид красный (E172)).
10 шт. – блистеры (3) – коробки картонные.
10 шт. – блистеры (5) – коробки картонные.
 таб., покрытые оболочкой, 50 мг: 30 или 50 шт.
таб., покрытые оболочкой, 50 мг: 30 или 50 шт.
Рег. №: 7872/06/11 от 16.12.2011 – Истекло
Таблетки, покрытые оболочкой желтого цвета, ромбовидные, с надписью “Pfizer” на одной стороне и надписью “NSR” над цифрой “50” – на другой.
| 1 таб. | |
| эплеренон | 50 мг |
Вспомогательные вещества: лактозы моногидрат, целлюлоза микрокристаллическая (E460i), натрия кроскармеллоза (E466), гипромеллоза (E464), натрия лаурилсульфат (E487), тальк (E553), магния стеарат (E470).
Состав оболочки: опадрай желтый YS-1-12524-A (гипромеллоза 3cP (E464), гипромеллоза 6cP (E464), титана диоксид (E171), макрогол 400 (E1521), полисорбат 80 (E433), железа оксид желтый (E172), железа оксид красный (E172)).
10 шт. – блистеры (3) – коробки картонные.
10 шт. – блистеры (5) – коробки картонные.
Фармакологическое действие
Эплеренон обладает относительной избирательностью в связывании с рекомбинантными минералокортикоидными рецепторами человека по сравнению с его связыванием с рекомбинантными глюкокортикоидными, прогестероновыми и андрогенными рецепторами. Эплеренон предотвращает связывание альдостерона, ключевого гормона ренин-ангиотензин-альдостероновой системы (РААС), которая вовлечена в регулирование артериального давления и патофизиологию сердечно-сосудистого заболевания. Было показано, что эплеренон вызывает длительное повышение уровней ренина в плазме и альдостерона в сыворотке, соответствующее ингибированию отрицательной регулирующей обратной связи альдостерона с секрецией ренина. Итоговое повышение активности ренина в плазме и уровня циркулирующего альдостерона не ослабляют действие эплеренона.
В исследованиях диапазона доз при хронической сердечной недостаточности (II-IV класс по NYHA) добавление эплеренона к стандартной терапии приводило к ожидаемому дозозависимому повышению уровня альдостерона. Подобным образом в кардиоренальном подисследовании EPHESUS, лечение эплереноном привело к значительному повышению альдостерона. Эти результаты подтверждают блокаду минералокортикоидного рецептора в этих популяциях.
Эплеренон изучался в исследовании эффективности и выживаемости при применении эплеренона для лечения сердечной недостаточности после острого инфаркта миокарда (EPHESUS). EPHESUS было двойным слепым плацебо-контролируемым исследованием с участием 6632 пациентов с острым инфарктом миокарда (ИМ), дисфункцией левого желудочка (оценивалась по фракции выброса левого желудочка (ФВЛЖ) ≤40%) и клиническими проявлениями сердечной недостаточности. В дополнение к стандартной терапии пациенты получали эплеренон в течение 3-14 дней (в среднем 7 дней) после острого инфаркта миокарда в начальной дозе 25 мг 1 раз/сут. Доза постепенно увеличивалась до целевой 50 мг 1 раз/сут через 4 недели, если содержани калия в сыворотке было Всасывание и распределение
Абсолютная биодоступность эплеренона неизвестна. C max достигается примерно через 2 ч. C max и AUC пропорциональны дозе для доз от 10 до 100 мг и менее пропорциональны – при применении дозы более 100 мг. Равновесное состояние достигается в течение 2 дней. Прием пищи не влияет на абсорбцию.
Эплеренон примерно на 50% связывается с белками плазмы крови, преимущественно с альфа 1 -кислыми гликопротеинами. Средний V d в равновесном состоянии составляет 50 (±7) л. Эплеренон не связывается с эритроцитами.
Метаболизм и выведение
Метаболизм эплеренона осуществляется, в основном, под действием CYP3A4. Активные метаболиты эплеренона в плазме крови человека не обнаружены.
В неизмененном виде с мочой и калом выводится менее 5% дозы эплеренона. После однократного приема внутрь меченого препарата около 32% дозы выводилось с калом и около 67% – с мочой. T 1/2 эплеренона составляет около 3-5 ч, клиренс из плазмы крови – примерно 10 л/ч.
Фармакокинетика в особых клинических случаях
Возраст, пол и раса:
- фармакокинетика эплеренона в дозе 100 мг 1 раз/сут изучалась у пожилых пациентов (65 лет и старше), мужчин и женщин, и у чернокожих пациентов. Фармакокинетика препарата существенно не отличалась у мужчин и женщин. В равновесном состоянии у пожилых пациентов C max и AUC были соответственно на 22% и 45% выше, чем у молодых пациентов (18-45 лет). В равновесном состоянии у чернокожих пациентов C max и AUC были ниже соответственно на 19% и 26%.
Почечная недостаточность:
- фармакокинетику эплеренона изучали у больных с почечной недостаточностью различной степени тяжести и у пациентов, находящихся на гемодиализе. По сравнению с пациентами контрольной группы у больных с тяжелой почечной недостаточностью выявили увеличение равновесных AUC и C max на 38% и 24% соответственно, а у больных, находящихся на гемодиализе – их снижение на 26% и 3%. Корреляции между клиренсом эплеренона из плазмы крови и клиренсом креатинина не обнаружено. Эплеренон не удаляется при гемодиализе.
Печеночная недостаточность:
- фармакокинетику эплеренона в дозе 400 мг сравнивали у больных с умеренным нарушением функции печени (класс В по шкале Чайлд-Пью) и здоровых добровольцев. Равновесные C max и AUC эплеренона были увеличены на 3.6% и 42% соответственно. У больных с тяжелой печеночной недостаточностью эплеренон не изучался, поэтому его применение в этой группе больных противопоказано.
Сердечная недостаточность:
- фармакокинетику эплеренона в дозе 50 мг изучали у больных с сердечной недостаточностью (класс II-IV по классификации NYHA). Равновесные AUC и C max у больных с сердечной недостаточностью были соответственно на 38 и 30% выше, чем у здоровых добровольцев, подобранных по возрасту, массе тела и полу. При популяционном фармакокинетическом анализе, проведенном в подгруппе больных, участвующих в исследовании EPHESUS, было установлено, что клиренс эплеренона у больных с сердечной недостаточностью сходен с таковым у здоровых пожилых людей.
Инспра ® (Inspra)
таблетки, покрытые оболочкой, 50 мг: 20, 28, 30, 50, 100 или 200 шт. Рег. №: ЛСР-004052/10
Клинико-фармакологическая группа:
Форма выпуска, состав и упаковка
Таблетки, покрытые оболочкой желтого цвета, ромбовидные, с надписью “NSR” над цифрой “50” на одной стороне и “Pfizer” – на другой.
| 1 таб. | |
| эплеренон | 50 мг |
Вспомогательные вещества: лактозы моногидрат, целлюлоза микрокристаллическая, натрия кроскармеллоза, гипромеллоза, натрия лаурилсульфат, тальк, магния стеарат.
Состав пленочной оболочки: опадрай желтый YS-1-12524-A (гипромеллоза, титана диоксид, макрогол, полисорбат 80, краситель железа оксид желтый, краситель железа оксид красный.
10 шт. – блистеры (2) – пачки картонные.
10 шт. – блистеры (3) – пачки картонные.
10 шт. – блистеры (5) – пачки картонные.
10 шт. – блистеры (10) – пачки картонные.
10 шт. – блистеры (20) – пачки картонные.
14 шт. – блистеры (2) – пачки картонные.
Описание активных компонентов препарата «Инспра ® »
Фармакологическое действие
Калийсберегающий диуретик. Эплеренон обладает относительной селективностью в отношении минералокортикоидных рецепторов у человека по сравнению с глюкокортикоидными, прогестероновыми и андрогенными рецепторами и препятствует их связыванию с альдостероном – ключевым гормоном ренин-ангиотензин-альдостероновой системы (РААС), который участвует в регуляции АД и патогенезе сердечно-сосудистых заболеваний.
Эплеренон вызывает стойкое увеличение уровней ренина в плазме крови и альдостерона в сыворотке крови. В последствие, секреция ренина подавляется альдостероном по механизму обратной связи. При этом повышение активности ренина или уровня циркулирующего альдостерона не влияет на эффекты эплеренона.
У больных с хронической сердечной недостаточностью II-IV функционального класса по классификации NYHA добавление эплеренона к стандартной терапии приводило к прогнозируемому дозозависимому увеличению уровня альдостерона. В исследовании EPHESUS по изучению функции сердца и почек у пациентов также было установлено значительное увеличение уровня альдостерона в результате терапии эплереноном. Эти данные подтверждают блокаду минералокортикоидных рецепторов.
Эффекты эплеренона изучали в двойном слепом плацебо-контролируемом исследовании EPHESUS у 6632 больных с острым инфарктом миокарда (ИМ), дисфункцией левого желудочка (фракция выброса ® не связано с приемом пищи. Для индивидуального подбора дозы могут быть использованы дозировки 25 и 50 мг. Лечение следует начинать с дозы 25 мг 1 раз/сут и увеличивать ее до 50 мг 1 раз/сут в течение 4 недель с учетом концентрации калия в сыворотке крови (см. таблицу). Терапию препаратом целесообразно начинать в течение 3-14 дней после острого инфаркта миокарда. Рекомендуемая поддерживающая доза препарата составляет 50 мг 1 раз/сут.
Концентрацию калия в сыворотке крови следует определять до назначения препарата, в течение первой недели и через 1 месяц после начала терапии или при изменении дозы препарата. В дальнейшем также необходимо периодически контролировать концентрацию калия в сыворотке крови.
Подбор дозы после начала лечения
| Концентрация калия в сыворотке крови (ммоль/л) | Действие | Изменение дозы |
| 6.0 | Отмена препарата | Не применимо |
После временного прекращения приема препарата в связи с повышением концентрации калия в сыворотке крови до > 6.0 ммоль/л, терапию препаратом можно возобновить в дозе 25 мг через день, когда концентрация калия в сыворотке крови составит пожилых пациентов не требуется. В связи с возрастным снижением функции почек у пожилых пациентов повышается риск развития гиперкалиемии, особенно при наличии сопутствующих заболеваний, способствующих увеличению концентраций эплеренона в сыворотке крови, в частности, при нарушении функции печени от легкой до умеренной степени тяжести. Рекомендуется периодически определять концентрацию калия в сыворотке крови.
Коррекции стартовой дозы у больных с легким нарушением функции почек не требуется. Рекомендуется периодически определять концентрацию калия в сыворотке крови. Эплеренон не удаляется при диализе.
Коррекции стартовой дозы у больных с нарушением функции печени от легкой до умеренной степени тяжести не требуется. Учитывая увеличение концентрации эплеренона у таких больных, рекомендуется регулярно контролировать концентрацию калия в сыворотке крови, особенно у пожилых пациентов.
При одновременном применении препаратов, оказывающих слабое или умеренно выраженное ингибирующее действие на CYP3A4, например, амиодарона, дилтиазема и верапамила, лечение препаратом Инспра ® можно начать с дозы 25 мг 1 раз/сут, при этом доза последнего не должна превышать 25 мг 1 раз/сут.
Побочное действие
В исследовании EPHESUS общая частота нежелательных явлений при применении препарата Инспра ® (78.9%) была сходной с таковой при использовании плацебо (79.5%). Из-за нежелательных явлений лечение препаратом и плацебо было прекращено у 4.4% и 4.3% больных соответственно. Ниже перечислены нежелательные явления, зарегистрированные в исследовании EPHESUS, которые могли быть связаны с лечением, а также серьезные нежелательные явления, частота которых значительно превышала таковую в группе плацебо. Нежелательные явления распределены по системам организма и частоте: частые (> 1/100, 1/1000, Со стороны системы кроветворения: нечастые – эозинофилия.
Нарушения метаболизма и питания: частые – гиперкалиемия; нечастые – дегидратация, гиперхолестеринемия, гипертриглицеридемия, гипонатриемия.
Со стороны ЦНС: частые – головокружение; нечастые – головная боль, бессонница.
Со стороны сердечно-сосудистой системы: частые – снижение АД; нечастые – фибрилляция предсердий, инфаркт миокарда, левожелудочковая недостаточность, ортостатическая гипотония, тромбоз артерий нижних конечностей.
Со стороны дыхательной системы: нечастые – фарингит.
Со стороны пищеварительной системы: частые – диарея, тошнота; нечастые – метеоризм, рвота.
Со стороны кожных покровов: нечастые – повышенная потливость, зуд.
Со стороны костно-мышечной системы: нечастые – боль в спине, судороги в икроножных мышцах ног.
Со стороны почек и мочевыводящих путей: частые – нарушение функции почек; нечастые – пиелонефрит.
Общие реакции: нечастые – астения, недомогание.
Лабораторные показатели: нечастые – повышение уровня остаточного азота мочевины, креатинина.
В исследовании EPHESUS отмечено увеличение числа случаев инсульта у пациентов пожилого возраста (старше 75 лет). Однако частота инсульта достоверно не отличалась между группами эплеренона (30) и плацебо (22).
Противопоказания
— концентрация калия в сыворотке крови в начале лечения > 5.0 ммоль/л;
— умеренная или выраженная почечная недостаточность (клиренс креатинина осторожностью: сахарный диабет 2 типа и микроальбуминурия; одновременное применение эплеренона, ингибиторов АПФ или антагонистов рецепторов ангиотензина II, препаратов, содержащих литий, циклоспорина или такролимуса, дигоксина и варфарина в дозах, близких к максимальным терапевтическим.
Беременность и лактация
Сведений о применении препарата у беременных женщин нет. Препарат следует назначать с осторожностью и только в тех случаях, когда ожидаемая польза для матери значительно превышает возможный риск для плода/ребенка.
Сведений о выведении эплеренона после приема внутрь с грудным молоком нет. Возможные нежелательные эффекты эплеренона на новорожденных, находящихся на грудном вскармливании, не известны, поэтому целесообразно или прекратить кормление грудью, или отменить препарат, в зависимости от его важности для матери.
Применение при нарушениях функции печени
Противопоказан при тяжелой печеночной недостаточности.
Применение при нарушениях функции почек
Противопоказан при умеренной или выраженной почечной недостаточности.
Применение в пожилом возрасте
Коррекции стартовой дозы у пожилых пациентов не требуется. В связи с возрастным снижением функции почек у пожилых пациентов повышается риск развития гиперкалиемии, особенно при наличии сопутствующих заболеваний, способствующих увеличению концентраций эплеренона в сыворотке крови, в частности при нарушении функции печени от легкой до умеренной степени тяжести. Рекомендуется периодически определять концентрацию калия в сыворотке крови.
Применение для детей
Противопоказан детям до 18 лет.
Особые указания
При лечении эплереноном может развиться гиперкалиемия, которая обусловлена его механизмом действия. В начале лечения и при изменении дозы препарата у всех пациентов следует контролировать концентрацию калия в сыворотке крови. В дальнейшем периодический контроль концентрации калия рекомендуется проводить пациентам с повышенным риском развития гиперкалиемии, например, пожилым больным с почечной недостаточностью и сахарным диабетом. Учитывая повышенный риск развития гиперкалиемии, назначение препаратов калия после начала лечения эплереноном не рекомендуется. Снижение дозы эплеренона приводит к снижению концентрации калия в сыворотке крови. В одном исследовании добавление гидрохлоротиазида к эплеренону препятствовало увеличению концентрации калия в сыворотке крови.
Нарушение функции почек
У пациентов с нарушением функции почек, в т.ч. диабетической микроальбуминурией, рекомендуется регулярно контролировать концентрацию калия в сыворотке крови. Риск развития гиперкалиемии увеличивается при снижении функции почек. Хотя число больных сахарным диабетом 2 типа и микроальбуминурией в исследовании EPHESUS было ограниченным, тем не менее, в этой небольшой выборке было отмечено увеличение частоты гиперкалиемии. В связи с этим у таких больных лечение следует проводить с осторожностью. Эплеренон не удаляется при гемодиализе.
Нарушение функции печени
У больных с легким или умеренным нарушением функции печени (класс А и В по шкале Чайлд-Пью) увеличения концентрации калия в сыворотке крови более 5.5 ммоль/л выявлено не было. У таких пациентов следует контролировать уровень электролитов. У больных с тяжелым нарушением функции печени эплеренон не изучался, поэтому его применение противопоказано.
Одновременное применение эплеренона с мощными индукторами CYP3A4 не рекомендуется.
Циклоспорин, такролимус, препараты, содержащие литий
Во время лечения эплереноном следует избегать назначения этих средств.
Таблетки содержат лактозу, поэтому их не следует назначать больным с редкими наследственными заболеваниями, такими как непереносимость галактозы, недостаточность лактазы lapp и синдром мальабсорбции глюкозы-галактозы.
Влияние на способность к вождению автотранспорта и управлению механизмами
Эффекты эплеренона на способность управлять автомобилем или пользоваться техникой не изучались. Эплеренон не вызывает сонливости или нарушения когнитивной функции, однако, необходимо учитывать возможность появления головокружения при лечении этим препаратом.
Передозировка
Случаев передозировки эплеренона у человека не описано. Наиболее вероятными проявлениями передозировки могут быть снижение АД и гиперкалиемия.
Лечение: эплеренон не удаляется при гемодиализе. Установлено, что эплеренон активно связывается с активированным углем. При появлении симптоматической гипотензии необходимо назначить поддерживающее лечение. В случае развития гиперкалиемии показана стандартная терапия.
Лекарственное взаимодействие
Калийсберегающие диуретики и препараты калия: учитывая повышенный риск развития гиперкалиемии, эплеренон не следует назначать больным, получающим калийсберегающие диуретики и препараты калия. Калийсберегающие диуретики могут усилить эффекты антигипертензивных средств и других диуретиков.
Препараты, содержащие литий: взаимодействие эплеренона с литием не изучалось. Однако, у больных, получавших литий в сочетании с диуретиками и ингибиторами АПФ, описаны случаи интоксикации литием. Следует избегать одновременного применения эплеренона и лития. Если подобная комбинация необходима, целесообразно контролировать концентрации лития в плазме крови.
Циклоспорин, такролимус: циклоспорин и такролимус могут вызвать нарушение функции почек и повысить риск развития гиперкалиемии. Следует избегать одновременного применения эплеренона и циклоспорина или такролимуса. Если во время лечения эплереноном потребуется назначение циклоспорина или такролимуса, рекомендуется тщательно контролировать концентрацию калия в сыворотке крови и функцию почек.
НПВП: лечение НПВП может привести к острой почечной недостаточности за счет прямого подавления клубочковой фильтрации, особенно у больных группы риска (пожилые пациенты и/или пациенты с дегидратацией). При совместном применении этих средств до начала и во время лечения необходимо обеспечивать адекватный водный режим и контролировать функцию почек.
Триметоприм: одновременное применение триметоприма с эплереноном повышает риск развития гиперкалиемии. Рекомендуется контролировать концентрацию калия в сыворотке крови и функцию почек, особенно у больных с почечной недостаточностью и у пожилых людей.
Ингибиторы АПФ и антагонисты рецепторов ангиотензина II: применять эплеренон с ингибиторами АЛФ или антагонистами рецепторов ангиотензина II следует с осторожностью. Подобная комбинация может привести к увеличению риска развития гиперкалиемии, особенно у пациентов с нарушением функции почек, в т.ч. у пожилых людей. Рекомендуется тщательно контролировать функцию почек и концентрацию калия в сыворотке крови.
Альфа 1 -адреноблокаторы (празозин, альфузозин): при одновременном применении альфа 1 -адреноблокаторов с эплереноном может усилиться гипотензивное действие и/или увеличиться риск развития ортостатической гипотензии, в связи с чем рекомендуется контролировать АД при перемене положения тела.
Трициклические антидепрессанты, нейролептики, амифостин, баклофен: при одновременном применении этих средств с эплереноном может усилиться антигипертензивный эффект или увеличиться риск развития ортостатической гипотензии.
Глюкокортикоиды, тетракозактид: одновременное применение этих средств с эплереноном может привести к ослаблению антигипертензивного эффекта (задержка натрия и жидкости).
Исследования in vitro свидетельствуют о том, что эплеренон не ингибирует изоферменты CYP1А2, CYP2C19, CYP2C9, CYP2D6 и CYP3A4. Эплеренон не является субстратом или ингибитором гликопротеина Р.
Дигоксин: AUC дигоксина при одновременном применении с эплереноном увеличивается на 16% (90% ДИ: 4-30%). Необходимо соблюдать осторожность, если дигоксин применяется в дозах, близких к максимальным терапевтическим.
Варфарин: клинически значимого фармакокинетического взаимодействия с варфарином не выявлено. Необходимо соблюдать осторожность, если варфарин применяется в дозах, близких к максимальным терапевтическим.
Субстраты CYP3A: в специальных исследованиях признаков фармакокинетического взаимодействия эплеренона с субстратами CYP3A4, например, мидазоламом и цизапридом, выявлено не было.
— мощные ингибиторы CYP3A4: при применении эплеренона со средствами, ингибирующими CYP3A4, возможно значимое фармакокинетическое взаимодействие. Мощный ингибитор CYP3A4 (кетоконазол 200 мг 2 раза/сут) вызывал увеличение AUC эплеренона на 441%. Одновременное применение эплеренона с мощными ингибиторами CYP3A4, такими как кетоконазол, итраконазол, ритонавир, нелфинавир, кларитромицин, телитромицин и нефазодон, противопоказано;
— слабые и умеренные ингибиторы CYP3A4: одновременное применение с эритромицином, саквинавиром, амиодароном, дилтиаземом, верапамилом и флуконазолом сопровождалось значимым фармакокинетическим взаимодействием (степень увеличения AUC варьировала от 98% до 187%). При одновременном применении этих средств с эплереноном доза последнего не должна превышать 25 мг.
Индукторы CYP3A4: одновременный прием настойки зверобоя (мощный индуктор CYP3A4) с эплереноном вызывал снижение AUC последнего на 30%. При применении более мощных индукторов CYP3A4, таких как рифампицин, возможно более выраженное снижение AUC эплеренона. Учитывая возможное снижение эффективности эплеренона, одновременное применение мощных индукторов CYP3A4 (рифампицина, карбамазепина, фенитоина, фенобарбитала, настойки зверобоя) не рекомендуется.
Антациды: на основании фармакокинетического клинического исследования значительного взаимодействия антацидов с эплереноном при их одновременном применении не предполагается.
Луцентис
Луцентис (ранибизумаб) представляет собой лекарственный препарат, основное назначение которого является интравитреальное введение с антивазопролиферативной целью. Интравитреальная инъекция является одним из самых эффективных методов терапевтического воздействия в современной офтальмологической практике. Таким способом лекарственные препараты могут попадать непосредственно к цели своего влияния – сетчатке глаза для лечении различной тяжелой патологии глазного дна. Сертифицированным лекарственным средством для интравитреального введения является препарат Луцентис, о котором и пойдет речь в данной статье.

Что такое Луцентис
Действующим веществом препарата Луцентис является ранибизумаб, который, с биохимической точки зрения, представляет собой фрагмент человеческого рекомбинантного моноклонального антитела, предназначенный для внутриглазного введения. Многие патологические состояния глазного дна, в том числе влажная форма макулярной дегенерации и диабетическая ретинопатия, сопровождаются разрастанием аномальных по строению и функциональным свойствам новообразованных кровеносных сосудов. Такие сосуды являются неполноценными, склонны к частым разрывам, что сопровождается кровоизлияниями в сетчатку глаза, стекловидное тело и субретинальное пространство.
Подобный патологический процесс является, по сути, бесконечным и приводит к необратимой потере зрения. Приостановить пролиферацию патологических кровеносных сосудов помогает особая группа препаратов – антивазопролиферативные агенты. К этой группе и относится ранибизумаб или Луцентис. Укол Луцентиса связывает и, тем самым, блокирует биологическую активность человеческого сосудистого эндотелиального фактора роста (VEGF), что и препятствует росту кровеносных сосудов.
Состав и форма выпуска Луцентиса
Препарат Луцентис представляет собой стерильный бесцветный или бледно-желтый слегка опалесцирующий раствор, находящийся в заполненном производителем одноразовом шприце или стеклянном одноразовом флаконе. Стерильный раствор содержит 10 мг/мл ранибизумаба. Вспомогательные вещества, содержащиеся в растворе, – гистидин, полисорбат, трегалозы дигидрат. Объем раствора во флаконе – 2,3 мл. Флакон препарата не может быть использован для нескольких пациентов, соответственно один укол Луцентиса рассчитан только на одно интравитреальное введение. Производитель препарата Луцентис – Novartis Pharma (Швейцария). Хранить препарат необходимо в холодильнике соблюдая температурный режим – 2-8 °C. Замораживать препарат запрещено. Хранить необходимо в защищенном от света месте. Нарушение условий хранения или транспортировки может повлиять на лечебные свойства препарата.

Механизм действия Луцентиса
Препарат Луцентис (Ранибизумаб) представляет собой фрагмент антитела к эндотелиальному фактору роста сосудов А (VEGF-A). Доказано, что именно VEGF-A вызывает неоваскуляризацию и пропотевание жидкости через сосудистую стенку, — процессы, лежащие в основе прогрессирования влажной формы макулярной дегенерации и других заболеваний сетчатки глаза. Применение Луцентиса приводит к связыванию VEGF-A, препятствуя тем самым взаимодействию молекул данного вещества с одноименными рецепторами (VEGFR1 и VEGFR2). Описываемые рецепторы локализуются на поверхности эндотелиальных клеток, выстилающих внутреннюю стенку капилляров. Укол Луцентиса приводит к редукции эндотелиальной пролиферации, уменьшению пропотевания жидкости через сосудистую стенку и формированию гораздо меньшего количества новых функционально неполноценных кровеносных сосудов.
По данным фармакокинетического анализа, период полувыведения ранибизумаба из стекловидного тела после укола Луцентиса при использовании стандартной дозировки 0, 5 мг составляет около 9 дней. Концентрация лекарственного препарата в плазме уменьшается пропорционально его элиминации из полости глазного яблока. Следует отметить, что концентрация ранибизумаба в плазме в 90000 раз меньше его концентрации в полости глазного яблока. Это означает, что системного действия препарат фактически не оказывает.
Показания к применению Луцентиса
Инструкцией по применению Луцентиса, а также данными множества научных исследований, определены следующие показания к интравитреальному введению данного препарата:
- Неоваскулярная (влажная) форма макулярной дегенерации.
- Отек макулы, возникающий в результате окклюзии ретинальной вены.
- Диабетическая ретинопатия, проявляющая отеком макулы.
- Хориоидальная неоваскуляризация, вызванная миопией.
Данный список показаний является общим. Необходимость интравитреального введения Луцентиса определяется лечащим врачом для каждого конкретного пациента исходя из клинической картины, а также динамики состояния глазного дна.
Частота приема и дозировка Луцентиса
Препарат Луцентис предназначен исключительно для интравитреального введения. Частота введения и режим дозирования зависит от вида патологии глазного дна:
- При неоваскулярной (влажной) форме макулярной дегенерации 0,5 мг (0,05 мл 10 мг/мл раствора) укол Луцентиса рекомендовано выполнять с интервалом 1 интравитреальное введение препарата 1 раз в месяц (минимальный промежуток между инъекциями – 28 дней). Во время лечения необходим периодический осмотр глазного дна и контроль остроты зрения. Допустимо урежение введения препарата после 3-хкратного последовательного введения при условии стабилизации состояния и улучшения остроты зрения. Допустимо, чтобы укол Луцентиса выполнялся 1 раз в 3 месяца после последовательного 4-хкратного применения препарата.
- Базовый режим дозирования при возникающем в результате блокады ретинальной вены отеке макулы, а также при диабетической патологии сетчатки аналогичный — 0,5 мг (0,05 мл 10 мг/мл раствора) Луцентиса рекомендовано для интравитреального введения 1 раз в месяц. Ежемесячный укол Луцентиса должен чередоваться с контролем состояния глазного дна и остроты зрения.
- Вызванная миопией хориоидальная неоваскуляризация требует интравитреального введения 0,5 мг Луцентиса каждый месяц в течение трех месяцев. По показаниям курс лечения можно повторять.
Контроль динамики заболевания осуществляется посредством оценки остроты зрения, а также проведением флуоресцентной ангиографии и оптической когерентной томографии. При неоваскулярной форме макулярной дегенерации, а также в случае ассоциированной с патологической миопией хориоидальной неоваскуляризации отсутствие отрицательной динамики по остроте зрения и состоянию сетчатки считается мерой эффективности терапии. При отсутствии эффекта от нескольких введений Луцентиса врач вправе отменить терапию, не дожидаясь окончания курса лечения. Применение Луцентиса можно сочетать с лазерной коагуляцией сетчатки.
Интравитреальное введение Луцентиса
Интравитреальное введение Луцентиса является оперативным вмешательством на глазном яблоке, поэтому должно проводиться в стерильной операционной. Оптимальной профилактикой послеоперационных инфекционных осложнений является соблюдение всех правил асептики, а также обработка операционного поля йодсодержащим антисептиком, при отсутствии аллергической реакции на йод. Перед манипуляцией врач проводит осмотр глазного дня и измерение внутриглазного давления. Толщина иглы для интравитреального введения Луцентиса – 27-30G. Место введения располагается в 3,5-4 мм от лимба, в так называемом pars plana, чтобы не задеть сетчатку и хрусталик. После прохождения иглы в полость глазного яблока производится постепенное интравитреальное введение Луцентиса в стекловидное тело. Укол Луцентиса является практически безболезненным, поэтому местной анестезии в виде глазных капель или геля с анестетиком достаточно.
 |
| Укол Луцентиса |
Контроль внутриглазного давления необходимо проводить в течение 30 минут после интравитреального введения Луцентиса. Также специалистом обязательно проводится контроль перфузии по ретинальной артерии. Через 3-7 дней после манипуляции необходим офтальмологический осмотр для контроля состояния глазного дна и раннего выявления инфекционных осложнений. Профилактическое введение антибиотика после интравитреального применения Луцентиса остается на усмотрение лечащего врача.
Противопоказания к введению Луцентиса
Противопоказания к применению описываемого препарата определяются не только свойствами самого лекарственного средства, но и методикой его использования. Существуют ситуации, когда само по себе интравитреальное введение Луцентиса противопоказано тому или иному пациенту. Применение Луцентиса противопоказано в следующих клинических ситуациях:
- Индивидуальная непереносимость или гиперчувствительность к ранибизумабу, ранее возникавшие аллергические реакции на введение данного препарата.
- Доказанные инфекционно-воспалительные процессы глазного яблока и периокулярной области.
- Беременность и период лактации также являются противопоказаниям к применению Луцентиса.
- Возраст пациента до 18 лет, поскольку научные исследования по применению Луцентиса у пациентов детского возраста не проводились.
Как и показания, так и противопоказания к интравитреальному введению Луцентса определяются лечащим врачом индивидуально для каждого пациента.
Препараты-аналоги Луцентиса
Группа антипролиферативных средств представлена не только Луцентисом. Существуют и другие препараты со схожим механизмом действия. Рассмотрим некоторые из них:
- Авастин. Действующим веществом данного препарата является бевацизумаб, который по механизму действия схож с ранибизумабом или Луцентисом. Авастин активно применялся с целью химиотерапевтического лечения онкологических заболеваний. Позже были проведены научные исследования и доказана эффективность Авастина, как антипролиферативного агента. Бевацизумаб применяется для терапии диабетической ретинопатии, хориоидальной неоваскуляризации и неоваскулярной макулярной дегенерации.
- Эйлеа. Действующее вещество данного препарата – афлиберцепт. Данное средство было одобрено для терапии патологии глазного дна в 2011 году. Показания к применению сходи с таковыми у Луцентиса. Особенностью данного средства является его способность связывать не только эндотелиальный сосудистый фактор роста, но и плацентарный фактор роста. Особенностью данного препарата является более продолжительное время действия.
 |  |
| Авастин (бевацизумб) и препаратЭйлеа (афлиберцепт) | |
Выбор препарата из группы антивазопролиферативных средств всегда остается за лечащим врачом. Пациента всегда подробно информируют обо всех особенностях, на основании полученной информации он дает согласие на интравитреальное введение Луцентиса или любого другого его аналога.
Луцентис. Цена и стоимость лечения
Цена лечения Луцентисом включает не только стоимость препарата, но и саму процедурой интравитреального введения. Данная процедура, несмотря на кажущуюся несложность, является не менее ответственной манипуляцией, чем другие разновидность вмешательств в офтальмологии. Существует риск развития инфекционных осложнений после введения препарата в полость глазного яблока. Поэтому подобная манипуляция должна проводиться только высококвалифицированным специалистом в условиях стерильности. Необходимость проведения интравитреального введения Луцентиса в специализированной операционной, а также использование большого количества расходных материалов и определяет стоимость применения Луцентиса. Цена препарата Луцентис в розничной аптечной сети России составляет 50000-52000 рублей. Стоимость интравитреального введения препарата колеблется в диапазоне 18000-25000 рублей. Также необходимо помнить о контрольных посещениях офтальмолога в процессе лечения, а также о назначаемых врачом диагностических манипуляциях.
Луцентис. Отзывы и рекомендации
Луцентис – один из современных и безопасных антивазопролиферативных агентов, применение которого успешно помогает остановить прогрессирование таких грозных офтальмологических заболеваний, как диабетическая ретинопатия и неоваскулярная (влажная) форма макулярной дегенерации. Применение Луцентиса имеет большое количество положительных отзывов как среди пациентов с патологией сетчатки, так и среди практикующих врачей-офтальмологов. Его использование помогло сохранить и улучшить зрение огромному количеству пациентов. И если Вам ранее выполнялся укол Луцентиса, будем признательны, если Вы оставите свой отзыв о препарате на нашем сайте на странице Отзывы. Ведь возможно, что именно Ваш опыт и отзыв о Луцентисе поспособствуют выбору других пациентов.
Инструкция по применению
БВИСА эндопротез синовиальной жидкости «Нолтрекс ™ »
по ТУ 9398-001-52820385-2015
Версия 2 от 10.03.2020
Варианты исполнения: НОЛТРЕКС 2,5; НОЛТРЕКС 3,0; НОЛТРЕКС 5,0
Состав:
- 3-мерный полиакриламид, %: 4,0 ± 1,5;
- вода очищенная, %: 96,0 ± 1,5;
- ионы серебра, %: 0,0001 – 0,0025.
Описание
БВИСА Эндопротез синовиальной жидкости НОЛТРЕКС™ по ТУ 9398-001-52820385-2015 (Материал биополимер водосодержащий с ионами серебра стерильный «АРГИФОРМ»), (далее – Эндопротез или НОЛТРЕКС™).
Высоковязкий, высокомолекулярный, студенисто-образный полимер, цвет от прозрачного до светло-жёлтого, стерильный. НОЛТРЕКС™ – синтетический материал для эндопротезирования и коррекции вязкопластических свойств синовиальной жидкости сустава. Не содержит компонентов животного происхождения. Вследствие большой плотности геля допустимо присутствие небольшого количества пузырьков в объёме шприца.
Механизм действия и биодеградация
НОЛТРЕКС™ действует, восстанавливая вязкость синовиальной жидкости в суставах, поражённых остеоартрозом (остеоартритом). В результате этого купируется болевой синдром и улучшается подвижность сустава. Особенностью НОЛТРЕКС™ является более длительное действие в сравнении с фармацевтическими препаратами и материалами для вискосапплементации. НОЛТРЕКС™ подвергается очень медленной биодеградации в среднем в течение более 6 месяцев. Биодеградация НОЛТРЕКС™ происходит через внеклеточный лизис и медленную резорбцию макрофагами. Процесс биодеградации полиакриламида в полости сустава происходит быстрее, чем в мягких тканях. На скорость выведения из суставной полости влияет также индивидуальная реактивность пациента. Выводится преимущественно через почки и печень, не повреждая ткани. Метаболиты полиакриламида (с помощью радиоактивных меток) обнаруживаются в моче и желчи.
Показания к применению
Любая стадия остеоартроза (остеоартрита) суставов.
НОЛТРЕКС™ предназначен для применения только квалифицированным медицинским персоналом (в соответствии с законодательством), владеющим техникой внутрисуставной инъекции.
Информация для врачей
Вводить НОЛТРЕКС™ в полость сустава с использованием иглы размером 18G – 21G, совместимой с адаптером Luer-Lock™. При наличии избыточной жидкости в суставе следует добиться прекращения экссудации и вводить материал не ранее чем через 48-72 часа после ликвидации воспалительного процесса. Введение Эндопротеза в сустав без предварительной эвакуации избыточной жидкости и/или купирования воспаления нецелесообразно и может привести к нежелательным последствиям. При наличии пузырьков в геле перед введением эндопротеза шприц следует несколько раз сильно встряхнуть поршнем кверху, при этом пузырьки переместятся под поршень. В дальнейшем при введении Эндопротеза шприц более не встряхивать, густая консистенция геля обеспечит нахождение пузырьков рядом с поршнем, по завершении введения Эндопротеза пузырьки оставить в шприце и в сустав не вводить. Введение через иглу 21Gx1½ (по сравнению с иглой большего диаметра) уменьшает болезненность инъекции, но требует большего давления на поршень и увеличения времени введения. В связи с высокой плотностью НОЛТРЕКС™ при чрезмерном нажатии и скорости введения возможно выдавливание геля в обратную сторону цилиндра через поршень. Средняя рекомендуемая скорость введения 3-5 минут на инъекцию. В течение суток (или более – по показаниям) после процедуры нагрузки на заинтересованный сустав ограничиваются.
При манипуляции на коленном суставе НОЛТРЕКС™ рекомендуется вводить в верхний заворот предпочтительно с наружной стороны (пациент находится в положении лёжа). Неоднократное введение в коленный сустав в положении пациента сидя создает вероятность повредить иглой большого диаметра хрящевой покров суставных поверхностей и мениски. Для снижения рисков внутрисуставные интервенции рекомендуется проводить под ультразвуковым контролем, данная рекомендация в особенности касается манипуляций на тазобедренном суставе. Для уменьшения болевых ощущений непосредственно при инъекции рекомендуется предварительное обезболивание тканей местным анестетиком (см. раздел Совместимость) как непосредственно в зоне введения, так и внутри сустава. При введении Эндопротеза в полость сустава пациент может ощущать чувство наполнения, а при случайном введении в мягкие ткани – распирание. Введение в мягкие ткани, в том числе в синовиальные ткани или капсулу сустава, может привести к внутрисуставным или мягкотканным осложнениям, что относится к нежелательным последствиям, связанным с нарушением техники введения, и должно быть устранено путём эвакуации материала из мягких тканей и назначением симптоматического лечения при наличии показаний.
Рекомендуемые схемы введения
Методика и схема введения НОЛТРЕКС™ подбираются индивидуально по усмотрению врача в зависимости от стадии остеоартроза (остеоартрита), особенностей сустава, клинического состояния.
1.1. В коленный сустав НОЛТРЕКС™ вводится в общем количестве от 2,0 мл до 12,5 мл за курс. Курс от 1 до 5 инъекций. Допустимо вводить в коленный сустав до 5,0 мл единовременно (за одну процедуру).
1.2. В тазобедренный сустав Эндопротез вводится в общем количестве от 2,0 мл до 5,0 мл за курс. Курс от 1 до 2 инъекций.
1.3. В голеностопный и другие суставы, в зависимости от их размера, введение материала рассчитывается индивидуально. Рекомендуется не превышать 2,0 – 2,5 мл за одну процедуру.
2.1. При курсовой схеме рекомендуемый интервал между инъекциями одна неделя.
2.2. Во избежание переполнения сустава плотным медленно резорбируемым Эндопротезом при хорошем клиническом результате курс НОЛТРЕКС™ рекомендуется прекратить!
2.3. При хорошей переносимости возможно единовременное лечение нескольких суставов.
2.4. Курсы целесообразно повторять 1 раз в 6 – 24 мес. в зависимости от клинических проявлений.
2.5. Схема повторного курса инъекций может быть сокращена по показаниям.
Внимание! Индивидуально подобранный курс лечения и правильная техника введения – ключевая точка для эффективного результата.
Предупреждение
Врач должен соблюдать правила асептики и технику внутрисуставной инъекции!
Не вводить в лимфатические, железистые и другие мягкие ткани, а также при наличии венозного или лимфатического стаза в области целевого сустава. Действие Эндопротеза при аутоиммунных заболеваниях не исследовано.
Меры предосторожности
Процедура лечения аналогична другим внутрисуставным инъекциям и несёт минимальный риск осложнений (артралгия, воспаление, внутреннее кровотечение при травмировании сосудов и др.). Соблюдать обычные меры предосторожности: введение НОЛТРЕКС™ возможно только в условиях чистой перевязочной или операционной квалифицированным медицинским персоналом.
Противопоказания
- воспалительные состояния кожных покровов в области предполагаемого введения НОЛТРЕКС™;
- острые инфекционные заболевания или инфекционные обострения хронических заболеваний;
- выпот в суставе;
- введение НОЛТРЕКС™ в инфицированный или воспалённый сустав, синовит;
состояние после артроскопических операций (применение возможно не ранее, чем через 1 неделю непосредственно после вмешательства, строго при отсутствии признаков воспаления);
- диабет является относительным противопоказанием – принимая во внимание лёгкую уязвимость тканей при диабете, необходимо внимательнее относиться к использованию НОЛТРЕКС™ у этой категории пациентов;
- беременность и лактация (см. ниже).
Побочные эффекты
Наиболее вероятны осложнения, связанные с перипроцедурной или временной постпроцедурной (не более 72 часов) болью или жжением. Они могут быть купированы с помощью нестероидных противовоспалительных анальгетиков.
Другие возможные побочные эффекты и осложнения связаны со способом введения путем внутрисуставной инъекции: (а) боль или отёк в месте инъекции, ощущение распирания, жжение, артралгия, выпот в суставе, синовит, асептический острый артрит; (б) инфекции (пиогенный артрит, прямое инфицирование сустава при инфекционных болезнях, остеомиелит, сепсис и т. д.); (в) подкожные нейропатии, медикаментозная эмболия сосудов. Некоторые из осложнений, связанных со способом введения, можно избежать, строгим соблюдением правил асептики и техники введения.
Поскольку НОЛТРЕКС™ не содержит материалов животного происхождения, вероятность аллергической реакции очень низка, но не исключена. Возможна индивидуальная непереносимость к компонентам Эндопротеза. Но ни в клинических исследованиях, ни во время пост-маркетингового наблюдения не сообщалось о каких-либо аллергических реакциях или случаях отторжения.
Пациенту рекомендуется проконсультироваться с врачом при непроходящей боли или чувстве жжения в суставе, покраснении, припухлости в месте инъекции, изменении области сустава, чувстве распирания или инородного тела в суставе или околосуставной области, признаках аллергической реакции.
О неблагоприятных реакциях следует сообщать представителю ООО «НЦ «БИОФОРМ».
Совместимость
Возможно одновременное применение НОЛТРЕКС™ с местными анестетиками (новокаин, лидокаин). Действие в комбинации с другими лекарственными средствами не исследовано. Взаимодействие с другими изделиями, предназначенными для восстановления вязкости синовиальной жидкости, при единовременном применении (за одну процедуру) не исследовано.
Внимание!
Эндопротез инертен, не радиоактивен.
Убедиться в настоящем местоположении Эндопротеза можно с помощью МРТ или УЗИ.
При необходимости НОЛТРЕКС™ может быть извлечен путем пункции и промывания полости сустава.
Извлекать НОЛТРЕКС™ из мягких тканей следует с помощью шприца с толстой иглой или путем инцизии.
Применение при беременности и кормлении грудью
Испытания на животных показали сохранность репродуктивной функции вследствие применения НОЛТРЕКС™. Влияние материала на эмбриогенез и лактацию не исследовано. Адекватные и строго контролируемые исследования у беременных и кормящих женщин не проводились. Применение при беременности и лактации не рекомендовано.
Форма выпуска
НОЛТРЕКС™ поставляется стерильным, готовым к применению. Коммерческая упаковка НОЛТРЕКС™ включает в себя: одноразовый пластиковый шприц с наконечником «Luer-Lock™», наполненный материалом, закупоренный стоппером, упакованный в блистер, стерилизованный паром; инструкция по применению.
Объём НОЛТРЕКС™, содержащегося в шприце, указан на упаковке. Срок годности указан на упаковке. Номер партии указан на упаковке. Не допускается использование по истечению срока годности.
Не допускается повторное применение.
Условия хранения
Хранить при температуре от +1° до +30°С. Беречь от влаги. Не подвергать воздействию солнечного света, не замораживать. Хранить в недоступном для детей месте.
Условия транспортирования
НОЛТРЕКС™ в транспортной таре изготовителя должен быть устойчив к воздействию климатических факторов при транспортировании любым видом крытого транспорта по условиям хранения, но в интервале температур от +1° до +30°С. НОЛТРЕКС™ можно транспортировать при температуре от +1°С до +40 °С без существенного снижения эффективности при условии, что общий срок температурного режима выше 30 °С не превышает 28 дней в течение срока годности.
Стерильность
НОЛТРЕКС™ поставляется стерильным, готовым к применению. Стерилизовано паром. Стерильность гарантируется только при отсутствии повреждений. При поврежденной упаковке, не использовать. Не подлежит повторной стерилизации.
Порядок утилизации
Использованные, поврежденные изделия или их части подлежат уничтожению, как медицинские отходы класса Б (эпидемиологически опасные отходы) в соответствии с СанПиНом 2.1.7.2790-10.
Изделия с истекшим сроком годности подлежат уничтожению как медицинские отходы класса А (эпидемиологически безопасные отходы, приближенные по составу к бытовым) в соответствии с СанПиНом 2.1.7.2790-10.
Гарантии производителя
Изготовитель гарантирует сохранение свойств НОЛТРЕКС™ в течение указанного срока годности только при соблюдении правил хранения, транспортирования и настоящей инструкции по применению.
Производитель
По вопросам качества изделия НОЛТРЕКС™ обращаться по адресу производства:
Общество с ограниченной ответственностью «НАУЧНЫЙ ЦЕНТР «БИОФОРМ»
108811, г. Москва, Километр Киевского шоссе 22-й (п. Московский), домовлад. 4, стр. 2, этаж 5, блок Г.
Ссылки
Для получения дополнительной информации о НОЛТРЕКС™, а именно: Файл биологической безопасности, Файл клинических испытаний, Файл библиографии обращаться в ООО «НЦ «БИОФОРМ» в России или к Вашему региональному представителю.
Профессионалам
Обновление инструкции АЦЦ® Лонг
Информируем Вас о новых данных по безопасности лекарственного препарата АЦЦ® Лонг, таблетки шипучие, 600 мг:
- В раздел «Побочное действие» добавлена нежелательная реакция – «стоматит» (нечасто) и указана информация о случаях развития коллапса (частота неизвестна).
- В разделе «Взаимодействие с другими лекарственными препаратами» откорректирована информация о совместном приеме с нитроглицерином: одновременное применение с ацетилцистеином может привести к усилению сосудорасширяющего и антитромбоцитарного эффектов нитроглицерина. Если требуется совместное применение нитроглицерина и ацетилцистеина, то следует контролировать состояние пациента на предмет потенциального развития артериальной гипотензии (иногда тяжелой, может проявляться головной болью)
- Добавлена информация в разделе «Особые указания»: о необходимости соблюдения осторожности при применении препарата у пациентов с непереносимостью гистамина; а также о том, что следует избегать применения препарата у пациентов с почечной и/или печеночной недостаточностью во избежание дополнительного образования азотистых соединений.
Данная информация касается новых данных, которые могут отсутствовать в инструкциях к препарату АЦЦ® Лонг, таблетки шипучие, 600 мг, находящемуся в обращении до конца срока годности.
Обновленная информация по продуктам опубликована на сайте http://grls.rosminzdrav.ru
Узнать подробнее вы можете в письме, нажав на «прочитать письмо»
Механизм действия ацетилцистеина
При воспалении слизистой оболочки дыхательных путей (при ОРИ) слизь становится вязкой и обволакивает реснички, мешая их нормальной работе.
Разрушая дисульфидные связи мукополисахаридов, ацетилцистеин уменьшает вязкость и адгезивность мокроты, без существенного увеличения ее объема.
За счет уменьшения вязкости мокроты и, как следствие, усиления цилиарной активности мерцательного эпителия применение ацетилцистеина позволяет нормализовать мукоцилиарный транспорт для естественного отхождения мокроты и выздоровления.
Адаптировано по «Симонова О.И. Простые ответы на сложные вопросы о муколитиках для детей.
Вопросы современной педиатрии. 2015; 14 (4): 38-42
Ацетилцистеин включен в следующие стандарты МЗ РФ медико-санитарной и специализированной медицинской помощи при болезнях органов дыхания в сравнении с другими муколитическими средствами 2 :
Дети и взрослые
Взрослые
АЦЦ* — препараты ацетилцистеина.
Стандарты первичной медико-санитарной и специализированной медицинской помощи. Класс X. Болезни органов дыхания (J00-J99). http://www.rosminzdrav.ru
Клинические исследования
Ацетилцистеин и карбоцистеин при острых инфекциях верхних и нижних дыхательных путей у детей без хронической бронхолегочной патологии
В 2013 г. в библиотеке Кохрейн (The Cochrane Library) был опубликован обновленный систематический обзор исследований по оценке эффективности и безопасности ацетилцистеина и карбоцистеина при терапии острых инфекций верхних и нижних дыхательных путей у детей без хронической бронхолегочной патологии.
Ацетилцистеин изучали в 20 исследованиях, число участников в возрасте от 2 мес до 13 лет составило 1080, из них 831 получал лечение. Контролируемыми исследованиями были 9, в них путь введения препарата был пероральным, за исключением одного исследования, где использовалось внутримышечное введение. Пациенты в контрольной группе получали либо плацебо, либо активное лечение, либо не получали ничего.
Безопасность была оценена с использованием клинических, биологических (полный анализ крови и мониторинг функции печени и почек), радиографических параметров, а также результатов исследования функции легких. Все контролируемые исследования показали хорошую клиническую безопасность, за исключением слабовыраженных неблагоприятных явлений со стороны желудочно-кишечного тракта (рвота) у двух пациентов, что привело к прекращению участия одного из них.
В ряде статей в возрастной группе до двух лет на фоне применения муколитиков ацетилцистеина и карбоцистеина в ряде случаев отмечалась парадоксальная бронхорея, однако в исследованиях данные эпизоды задокументированы не были. Объяснения данного явления заключались не только в гиперпродукции слизи при невозможности адекватного оттока, ограниченного малым диаметром бронхов, но и в неверном подборе дозы препаратов.
Исследования показали эффективность применения муколитиков (например, уменьшение кашля на 6—7й день). Ацетилцистеин уменьшал частоту, интенсивность и продолжительность симптомов заболевания у детей с острыми заболеваниями верхних и нижних дыхательных путей (без хронической бронхо-легочной патологии).
Результаты данного обзора демонстрируют эффективность ацетилцистеина и, в целом, хорошую безопасность у детей старше двух лет. Однако было доступно очень мало данных для оценки безопасности для детей младше 2 лет.
Chalumeau M, Duijvestijn YCM, Acetylcysteine and carbocysteine for acute upper and lower respiratory tract infections in paediatric patients without chronic broncho-pulmonary disease (Review). The Cochrane Library 2013, Issue 5.По данным обзора 20 исследований с привлечением 1080 больных ОРИ в возрасте до 13 лет, из которых 831 получал лечение (остальные-контроль). Безопасность и переносимость ацетилцистеина оценены как хорошие у детей старше 2х лет (с использованием клинических, биологических и радиографических методов, результатов исследования функций легких). Chalumeau M, Duijvestijn YCM. Acetylcysteine and carbocysteine for acute upper and lower respiratory tract infections in paediatric patiens without chronic broncho-pulmonary disease. Cochrane Database of Systematic Reviews 2013, Issue 5, Art. No.: CD003124. DOI: 10.1002/14651858. CD003124.pub4. / Шалюмо М., Дуйвестин И.С.М. и др. Ацетилцистеин и карбоцистеин в лечении инфекции верхних и нижних дыхательных путей у детей без хронических бронхолегочных заболеваний, библиотека Кохран плюс, 2013, выпуск 5.
Оценка эффективности влияния ацетилцистеина на реологические свойства мокроты
В исследовании, проведенном проф. И. М. Кахновским и посвященном оценке эффективности влияния препарата АЦЦ ® на реологические свойства мокроты, было доказано, что клинически его муколитическое действие проявляется уже с 1-го дня лечения и к 3-му дню достигает максимума. На фоне приема АЦЦ ® отмечалось улучшение дренажной функции бронхов.
Кахновский И. В. и соавт. Оценка эффективности влияния ацетилцистеина на реологические свойства мокроты. Вязкость мокроты к концу лечения уменьшилась с 35,3±10 до 23,7±6 нс2/м2, адгезия – с 46,8±6,7 до 30,9±5,2 н/м2. Данные исследования эффективности ацетилцистеина (АЦЦ ® 200мг порошок для приготовления раствора для приема внутрь) у 20 пациентов с острой пневмонией или хроническим бронхитом (средний возраст 55 лет). Адаптировано по Клиническая фармакология и терапия, 1997, том 6, №1, с. 29-30.
Сравнительное исследование некоторых отхаркивающих и муколитических препаратов у детей разных возрастных групп, страдающих острыми и хроническими бронхолегочными заболеваниям
В исследовании на базе Российского государственного медицинского университета под наблюдением находилось 259 детей с острой и хронической бронхолегочной патологией в возрасте с первых дней жизни до 15 лет.
Дети были разделены на три группы:
- 1 группа детей (92 человека) получали АЦЦ ® ;
- 2 группа детей (117 человек) получали амброксол:
- группа сравнения (50 человек) получали бромгексин (30) или Мукалтин (20).
В результате проведенных наблюдений было установлено, что наилучший клинический эффект у детей с острым бронхитом был получен при применении ацетилцистеина.
При назначении бромгексина и амброксола также отмечался выраженный муколитический эффект, но в более поздние сроки от начала лечения. В приступном периоде бронхиальной астмы при назначении ацетилцистеина в комплексной терапии наилучший эффект был достигнут у детей младшей возрастной группы.
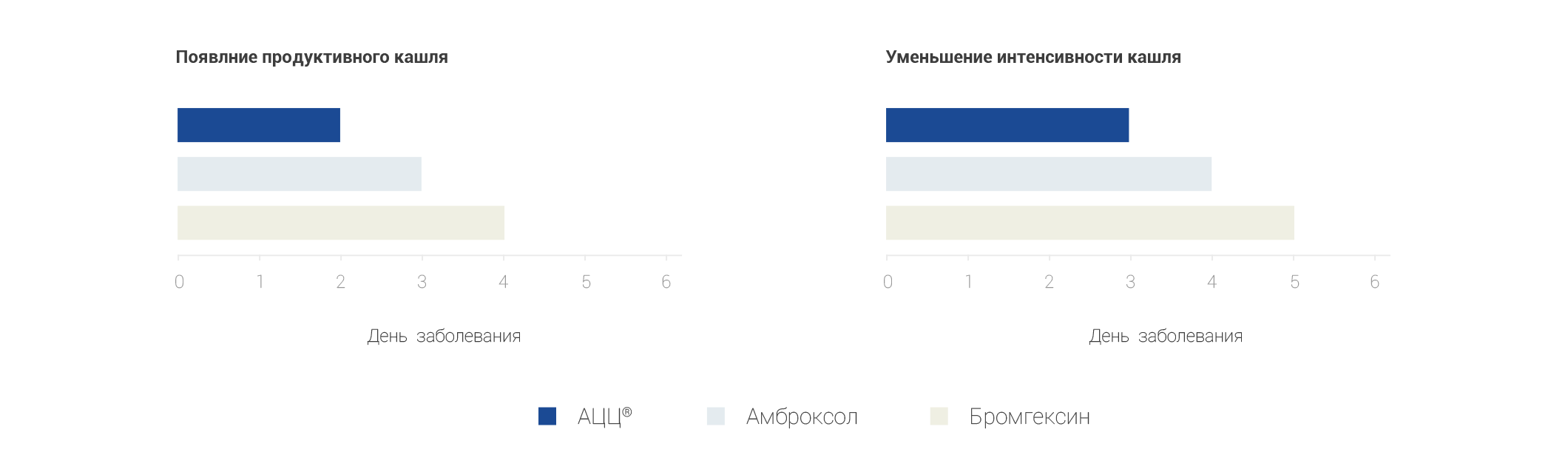
Зайцева О.В. Рациональный выбор муколитической терапии в лечении болезней органов дыхания у детей. РМЖ, 2009, Т. 17, №19, с.1217-1222.
Пострегистрационное открытое проспективное исследование (фаза IV) в параллельных группах с целью оценки клинической эффективности, переносимости и безопасности АЦЦ ® у детей с острыми респираторными заболеваниями
Исследование проведено на 2 клинических базах г. Москвы (Детской городской клинической больницы Святого Владимира и ФГУЗ Детской клинической больницы №38 – ЦЭП ФМБА России). Под наблюдением находились 60 детей в возрасте от 2 до 10 лет с клиническими проявлениями острого респираторного заболевания с трудноотделяемой мокротой (острый бронхит, в т.ч. с обструктивным синдромом, острый стенозирующий ларинготрахеит, пневмония).
Дети были разделены на 2 группы:
- 1 группа : 40 человек, получали АЦЦ ® ;
- 2 группа: 20 человек, получали амброксол.
Проведенное исследование показало, что использование ацетилцистеина в комплексной терапии острых заболеваний органов дыхания у детей способствует достижению продуктивного кашля с улучшением дренажной функции бронхов, особенно у детей первых лет жизни, купированию симптомов интоксикации, продолжительности кашля, что способствовало уменьшению сроков госпитализации у детей с острыми респираторными заболеваниями.
В ходе проведенного исследования только у одного пациента отмечались нежелательные явления в виде диспепсии с тошнотой и рвотой в первые сутки от начала приема изучаемого препарата, в связи с чем пациент был исключен из исследования.
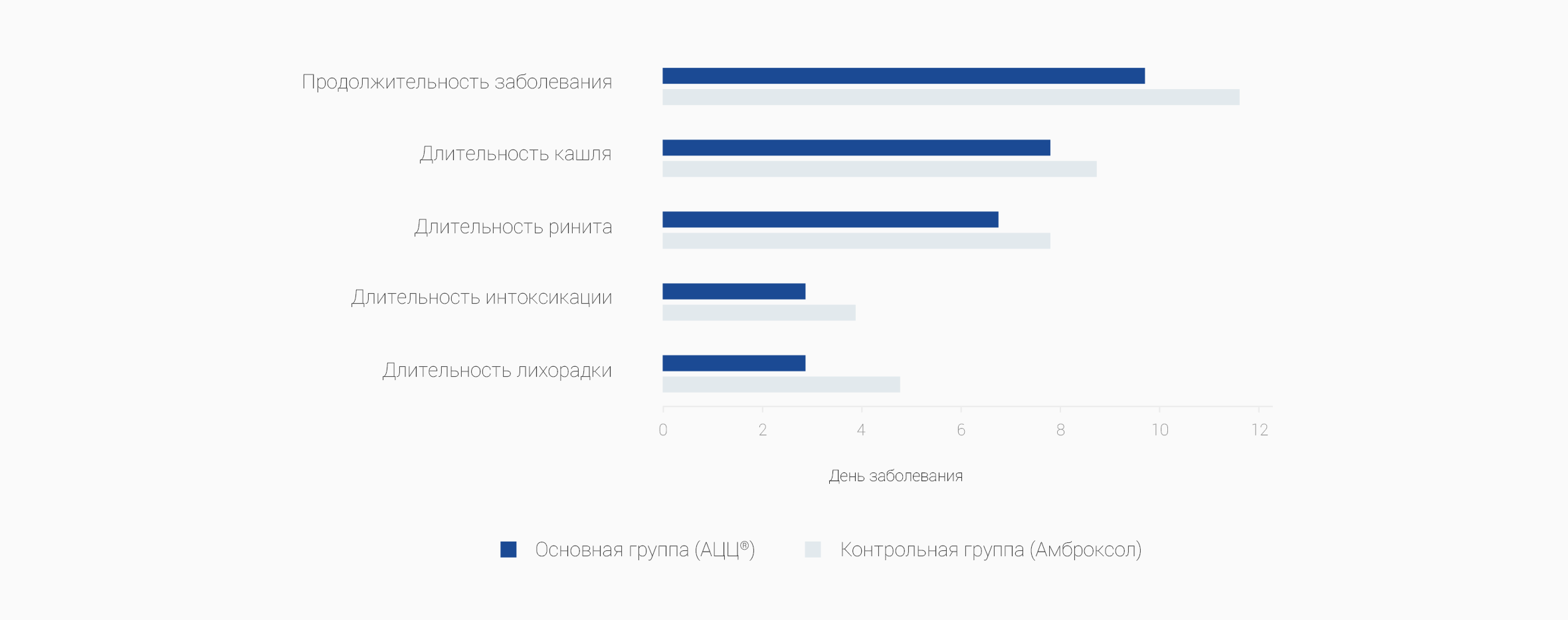
Таким образом, благодаря тройному действию — муколитическому, антиоксидантному и противовоспалительному — применение АЦЦ ® при ОРИ способствует сокращению длительности кашля, уменьшению интенсивности воспалительной реакции и сокращению продолжительности заболевания.
По данным открытого проспективного исследования в параллельных группах с участием 60 детей в возрасте от 2 до 10 лет (40 человек получали ацетилцистеин, 20 человек получали амброксол) с клиническими проявлениями ОРЗ, в т.ч. с кашлем с трудноотделяемой мокротой. Применение ацетилцистеина способствовало достижению продуктивного кашля с улучшением дренажной функции бронхов, купированию симптомов интоксикации, продолжительности кашля, что способствовало уменьшению сроков госпитализации у детей с острыми респираторными заболеваниями (9,7±2,5 дней при приеме ацетилцистеина против 10,9±2,3 дней при приеме амброксола). Адаптировано по: Зайцева С., Локшина Э., Зайцева О. и др. Новая лекарственная форма ацетилцистеина у детей с острыми респираторными заболеваниями, Врач, 2010, с. 60-63.
Контролируемое исследование эффективности применения комбинации тиамфеникола и ацетилцистеина при респираторных инфекциях у детей
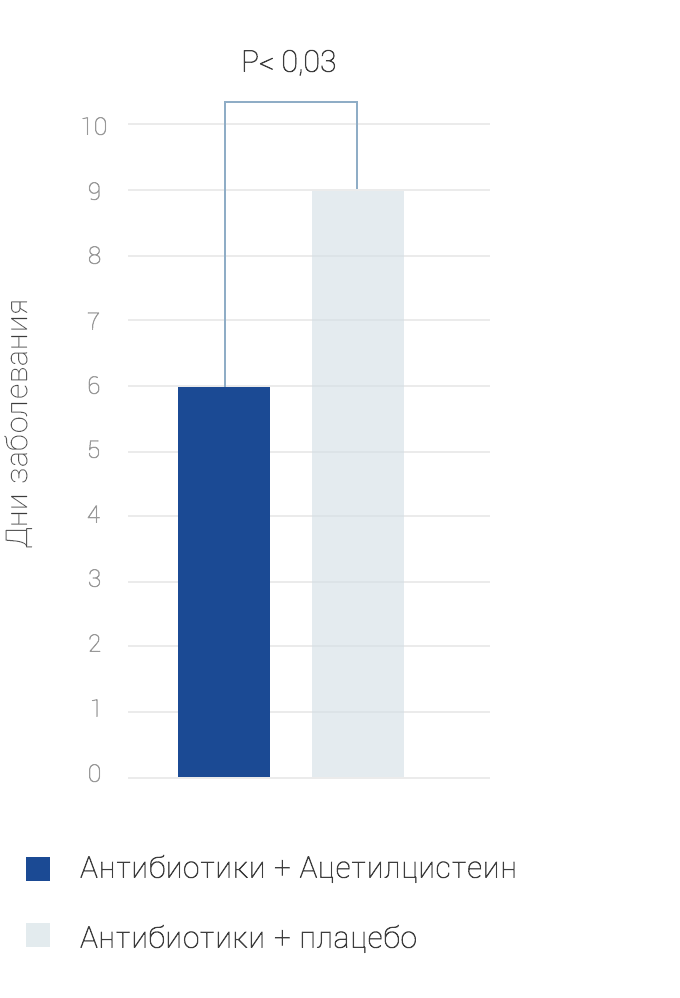
По данным Bellomo G., в рандомизированное клиническое исследование были включены 59 детей с инфекциями респираторного тракта (из них 22 – младше 1 года, 28 – от 1 до 5 лет и 9 – старше 5 лет), которые были разделены на 2 группы:
- 30 детей получали антибиотик и ацетилцистеин,
- 29 детей получали антибактериальный препарат и плацебо.
В ходе исследования было выявлено, что комбинация ацетилцистеина и антибиотика (тиамфеникола) приводит к достоверному уменьшению длительности заболевания инфекциями верхних дыхательных путей у детей на 3 дня (р 1
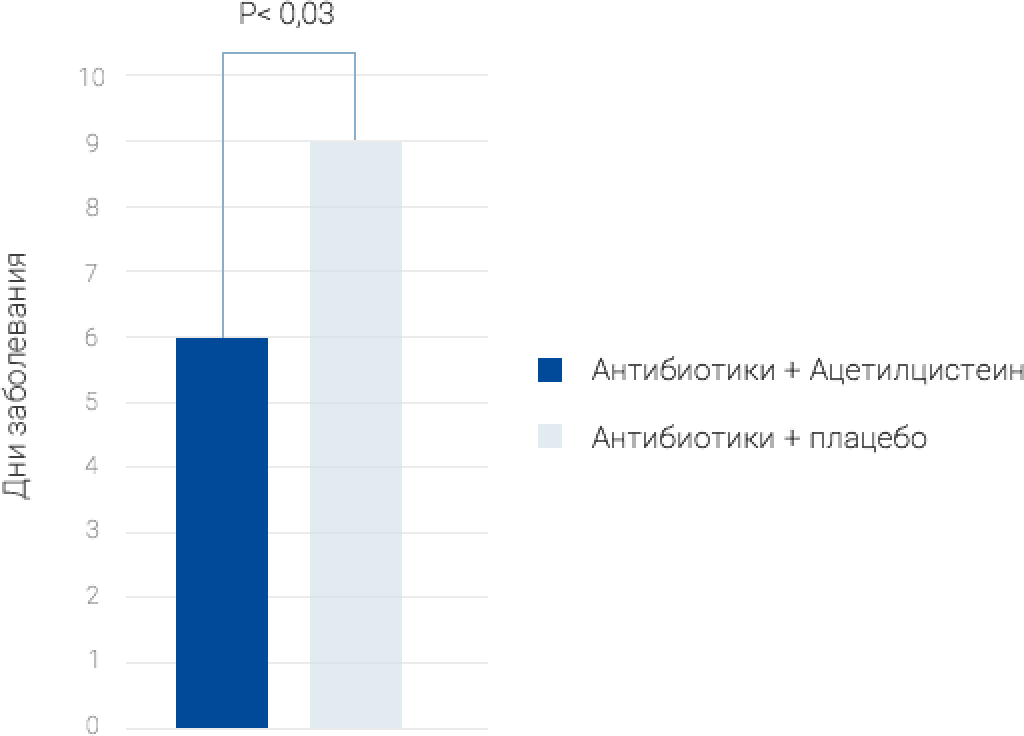
Рандомизированное контролируемое исследование, в котором принимало участие 59 пациентов с острым бронхитом и другими инфекциями дыхательных путей 1 , достоверно показало, что при использовании ацетилцистеина у детей сокращается длительность заболевания.
Пациенты были разделены на две группы: в первой принимали антибиотик в комбинации с ацетилцистеином, во второй — только антибиотик. Комбинация ацетилцистеина и антибиотика приводит к достоверному уменьшению длительности заболевания инфекциями верхних дыхательных путей у детей на 3 дня.
Не по инструкции: Как регулируется применение препаратов офф-лейбл
В июне ГосДума планирует рассмотреть законопроект, который позволит врачам назначать детям с онкологическими и гематологическими заболеваниями лекарственные препараты off-label.
Эта тема давно и широко обсуждается. Так, в декабре 2020 г. в Совете Федерации прошло заседание Экспертного совета по здравоохранению на тему применения ЛП «офф-лейбл». Тогда же несколько благотворительных организаций направили Министру здравоохранения открытое письмо о необходимости включения в стандарты медицинской помощи ЛП off-label.
Ответом на поднятую проблему и стал внесенный в ГосДуму законопроект.
Не по инструкции: что такое off-label?
В 1997 г. FDA дала следующее определение off-label — «это применение по показанию, в лекарственной форме, режиме дозирования, для популяции или по иным параметрам применения, не упомянутым в утвержденной инструкции». А в 2016 г. определение появилось и в пространстве Евразийского экономического союза. Правилами надлежащей практики фармаконадзора ЕАЭС, утвержденным Решением Совета ЕЭК от 03.11.2016 № 87, установлено, что «вне инструкции» (off-label) представляет собой намеренное применение лекарственного препарата с медицинской целью не в соответствии с общей характеристикой лекарственного препарата или инструкцией по медицинскому применению».
Отступления от инструкции могут быть разными [1]:
- несоответствие показаний к применению показаниям в инструкции;
- применение ЛП несмотря на противопоказания;
- применение к популяциям, в отношении которых инструкция исключает применение (например, возраст, беременность, период лактации и т.п.);
- применение способа введения, не предусмотренного инструкцией;
- использование ЛП без предварительного введения пробной дозы;
- использование доз в размерах, отличных от указанных в Инструкции;
- использование кратности, отличающейся от Инструкции;
- применение препарата за рамками длительности его применения;
- нарушение целостности твердой неделимой лекарственной формы;
- прием препарата в запрещённой комбинации;
- использование «аналогии», например, когда:
- используется ЛП, инструкция которого не включает лечение определённого заболевания,
- есть другой препарат (с другим торговым наименованием), но с тем же МНН, но в инструкции по которому это заболевание есть.
Дети off-label
Большинство off-label назначений приходится на сферу педиатрии. Причем такая ситуация характерна не только для России, но и для Европейского союза.
В докладе «Исследование применения ЛП off-label в Европейском союзе», отмечается, что в педиатрии в условиях стационара доля назначений off-label находится в диапазоне от 13 до 69%, а в амбулатории — от 2 до 100%. В статьях российских педиатров также встречаются подобные данные [2].
Заместитель министра здравоохранения Глаголев С.В. на заседании экспертного совета назвал такие цифры применения off-label: 20% в общем объеме назначений ЛП и более 70% в педиатрии.
Основная причина отсутствия у многих препаратов показаний к применению у детей – недостаток клинических исследований. Большинство клинических исследований проводится на взрослой популяции и переносить такие результаты на детей фармацевтические компании не могут.
Как сейчас назначается препарат off-label
В настоящее время дети могут получить препарат off-label. Но для этого требуется решение врачебной комиссии.
Согласно ч. 1 ст. 37 Закона «Об основах охраны здоровья в РФ» № 323-ФЗ медицинская помощь организуется и оказывается «с учетом стандартов медицинской помощи». Частью 14 ст. 37 № 323-ФЗ предусмотрено, что «стандарт медицинской помощи… включает в себя усредненные показатели частоты предоставления и кратности применения … зарегистрированных на территории РФ лекарственных препаратов… в соответствии с инструкцией по применению лекарственного препарата».
Клинические же рекомендации могут включать off-label препараты. Так, в Требованиях к структуре КР, утв. приказом Минздрава РФ от 28 февраля 2019 г. № 103н указано, что: «… перед наименованием лекарственного препарата ставится знак «#», а также указываются сведения… с указанием ссылок на клинические исследования… либо ссылок на соответствующие источники литературы в случае, если тезис-рекомендация относится к лекарственному препарату…, используемому не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата».
Однако в настоящее время КР не могут быть основой для назначения ЛП, врач обязан руководствоваться стандартом.
Согласно части 15 ст. 37 № 323-ФЗ «назначение и применение лекарственных препаратов, …, не входящих в соответствующий стандарт медицинской помощи или не предусмотренных соответствующей клинической рекомендацией, допускаются в случае наличия медицинских показаний (индивидуальной непереносимости, по жизненным показаниям) по решению врачебной комиссии». Это подтверждает и Порядок назначения ЛП, утв. Приказом Минздрава РФ от 14 января 2019 г. № 4н.
Таким образом, при назначении препарата off-label врач должен получить решение врачебной комиссии.
Непростые сложности
Неясное регулирование
У профессионального сообщества нет единства по вопросу назначения off-label. Например, высказывается мнение, что даже врачебная комиссия не уполномочена принимать решение о назначении ЛП не в соответствии с инструкцией. Это мнение основывается на том, что процитированные выше нормы прямо не предусматривают возможность назначить ЛП off-label.
При этом суды признают незаконными действия по отказу в предоставлении пациенту препаратов, не входящих в стандарт оказания медицинской помощи, или off-label, назначенных врачебной комиссией. Такая практика сложилась и на уровне судов общей юрисдикции [3], и на уровне Верховного суда РФ [4]. Но дискуссии продолжаются.
Проблемы врачебных комиссий
Назначение ЛП через врачебную комиссию – долгое и не всегда эффективное решение для пациента.
В докладе Росздравнадзора за 2020 год отмечается, что по результатам проверок выявлено более 80 случаев нерассмотрения врачебной комиссией вопросов назначения ЛП при наличии медицинских показаний.
Единственный путь доступа к ЛП для маленького пациента – врачебная комиссия – оборачивается потерей драгоценного времени.
Какие проблемы решает законопроект?
Прежде всего безопасность
Достаточно ли проработаны такие предложения? Ведь назначение детям препаратов off-label сопряжено с риском возникновения серьезных нежелательных реакций. Так, в статье «Исследование безопасности применения ЛП у детей» сделан вывод, что более высокому риску развития осложнений лекарственной терапии подвержены именно дети.
Европейским агентством по лекарственным средствам (EMA) сформулирована Надлежащая практика использования лекарств не по прямому назначению (Good Off-Label Use Practices (GOLUP)).
В декларации установлены критерии использования лекарств off-label:
1) наличие медицинской необходимости, основанной на полученных данных при осмотре и обследовании пациента;
2) отсутствие лицензированных альтернатив терапии, приемлемых для пациента;
3) обзор и критическая оценка имеющихся научных данных по определенному ЛП, что необходимо для принятия решения о непрямом использовании препарата в конкретном случае;
4) пациентам (или их законным представителям) должна быть предоставлена полная информация о назначенной терапии;
5) фиксация результатов применения в определенных документах, что важно для прогноза неблагоприятных событий, которые возникают при применении лекарств не по назначению.
Законопроект в целом учитывает эти критерии.
Но законодателю также имело бы смысл не ограничиваться онкологическими и гематологическими заболеваниями и детьми, а действовать более системно – предусмотреть возможность назначения off-label пациентам и с другими жизнеугрожающими и хроническими заболеваниями, тогда, когда есть медицинская необходимость. С таким предложением недавно выступили 32 общественные и пациентские организации, направив президенту и правительству РФ открытое письмо.
[1] Классификация на основе выступления замминистра здравоохранения Глаголева С.В.
[2] Например, в статье «Исследование безопасности применения ЛП у детей», в обзоре «Проблема off label: опыт РДКБ».
[3] Напр., в решениях Свердловского районного суда г. Иркутска (Иркутская область) от 23 января 2020 г. по делу № 2-1/2020, Приокского районного суда г. Нижний Новгород (Нижегородская область) от 18 февраля 2020 г. по делу № 2-2642/2019 прямо говорится о препаратах off-label
[4] Напр., Определение ВС РФ от 2 декабря 2019 г. № 11-КГ19-24, Определение от 29 мая 2018 г. № 11-КГ18-8.


