Показания к имплантируемому кардиовертеру-дефибрилятору, прогнозы, результативность и сложности реабилитации
Показания рассматриваются с точки зрения необходимости первичной и вторичной профилактики внезапной смерти. Первичная профилактика – это лечебное вмешательство, проводимое у пациентов с высоким риском смерти от ЖТ или ФЖ, у которых, однако, эти тахиаритмии еще никогда не возникали. Вторичная профилактика – это лечение пациентов, у которых уже наблюдались эпизоды ЖТ и ФЖ.
Показания для имплантации кардиовертера-дефибриллятора в Великобритании
(Национальный институт здоровья и клинического мастерства)
а) С целью вторичной профилактики. Вопрос об имплантации дефибриллятора следует рассмотреть в отношении следующих пациентов при условии, что аритмия не связана с острым ИМ или устранимой причиной: 1.Лица, пережившие внезапную сердечную смерть, вызванную ФЖ или ЖТ
2. Пациенты, перенесшие устойчивую ЖТ, сопровождавшуюся синкопальным состоянием или выраженными нарушениями гемодинамики
3. Пациенты, перенесшие устойчивую ЖТ, не сопровождавшуюся синкопальным состоянием или остановкой кровообращения, у которых ФВ ЛЖ 120 мс
2. Пациенты, страдающие следующими заболеваниями сердца при наличии факторов высокого риска внезапной смерти:
а) синдром удлиненного интервала QT
б) ГКМП
в) синдром Бругада
г) аритмогенная кардиомиопатия ПЖ
д) состояние после хирургической коррекции врожденного порока сердца
В ряде крупных клинических исследований было показано, что у данных пациентов установка имплантируемого кардиовертер-дефибриллятора (ИКД) обеспечивает снижение смертности по сравнению с антиаритмической терапией. В целом, по данным этих исследований, смертность от сердечных причин снижается на 50%, а общая смертность – примерно на 24%.
Проведенный анализ показал, что за 3-летний период на каждые 4-5 ИКД приходится одна сохраненная жизнь. Эти рекомендации основаны на результатах исследований, в которых было показано, что у данных пациентов установка ИКД приводит к уменьшению смертности по сравнению с антиаритмической терапией (в основном с использованием амиодарона).
Относительно пункта д было показано, что у больных с тетрадой Фалло, перенесших хирургическое вмешательство с целью коррекции порока, предикторами внезапной смерти являются увеличение продолжительности комплекса QRS и дисфункция желудочков.
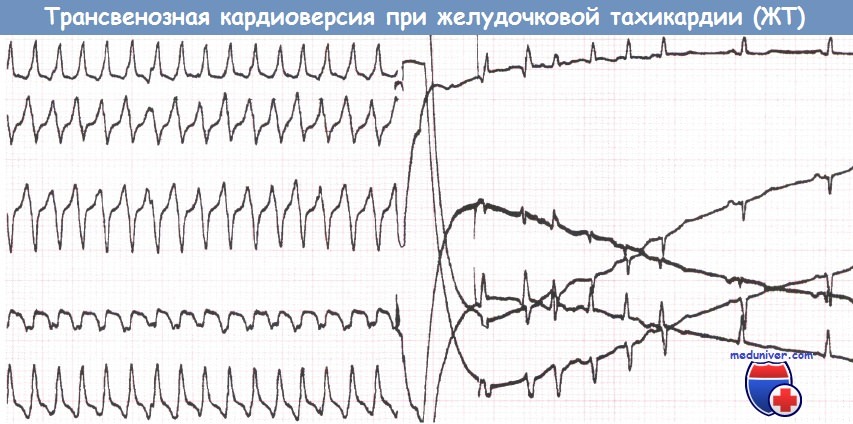 Трансвенозная кардиоверсия по поводу желудочковой тахикардии (ЖТ)
Трансвенозная кардиоверсия по поводу желудочковой тахикардии (ЖТ)
Дополнительные показания для первичной профилактики, не противоречащие рекомендациям Великобритании
В трех недавних исследованиях было показано, что у пациентов с резко сниженной функцией ЛЖ (ФВ ЛЖ  Трепетание желудочков:
Трепетание желудочков:
а Трепетание желудочков. Частота сокращений желудочков 230 в минуту. Комплексы QRS уширены и деформированы.
b Желудочковая тахикардия, появившаяся после электрошоковой терапии. Позднее появился устойчивый синусовый ритм.
Показания для имплантации кардиовертера-дефибриллятора по руководству Американской коллегии кардиологов и Американской ассоциации сердца
Ниже перечислены основные рекомендации (т.е. рекомендации I класса).
Имплантация имплантируемого кардиовертер-дефибриллятора (ИКД) показана пациентам:
1) выжившим после остановки сердца вследствие ФЖ или устойчивой ЖТс нарушением гемодинамики (только после обследования с целью установления этиологии данных аритмий и исключения всех полностью обратимых причин)
2) с органическим заболеванием сердца и спонтанной устойчивой ЖТ независимо от того, протекала ли она с нарушением гемодинамики или без такового
3) с синкопальным состоянием неустановленной природы и клинически значимой, гемодинамически нестабильной устойчивой ЖТ или ФЖ, индуцированной в ходе электрофизиологического исследования
4) с ФВ ЛЖ 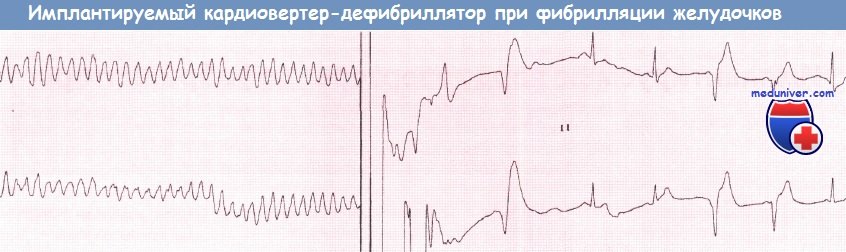 Устранение фибрилляции желудочков (ФЖ) при помощи имплантируемого кардиовертер-дефибриллятора (ИКД)
Устранение фибрилляции желудочков (ФЖ) при помощи имплантируемого кардиовертер-дефибриллятора (ИКД)
Уточнения, касающиеся имплантации кардиовертера-дефибриллятора с целью первичной профилактики
Перед применением результатов клинических исследований на практике необходимо обсудить с пациентом как негативные аспекты установки имплантируемого кардиовертер-дефибриллятора (ИКД), так и существенную пользу данного вмешательства.
Недостатками являются возможность развития осложнений, связанных с установкой имплантируемого кардиовертер-дефибриллятора (ИКД), как в ближайшем, так и в отдаленном периоде, вероятность неадекватного срабатывания устройства, возможность отрицательного влияния на психику пациента, а также ограничения, связанные с управлением автотранспортом (см. ниже).
Пациент должен понимать, что, несмотря на доказанную в клинических исследованиях значительную пользу установки имплантируемого кардиовертер-дефибриллятора (ИКД), в течение первых 3 лет после имплантации примерно лишь 1 реципиент из 11 получит соответствующую жизнесохраняющую электротерапию. По данным недавно предпринятого анализа результатов 8-летнего наблюдения оказалось, что для спасения одной жизни нужно установить ИКД 8 пациентам.
С возрастом у пациента увеличивается вероятность развития других «некардиальных» заболеваний, которые могут сократить жизнь (к ним относятся, например, инсульт или рак). Таким образом, с точки зрения ожидаемой продолжительности жизни, у пожилого пациента с нарушенной функцией желудочков вероятность того, что установка ИКД окажется полезной, меньше, чем у лиц молодого или среднего возраста.
Недавно в одном исследовании было продемонстрировано, что установка имплантируемого кардиовертер-дефибриллятора (ИКД) больному, удовлетворяющему трем и более критериям (возраст старше 70 лет, класс NYHA выше II, мочевина сыворотки >26 мг/дл, продолжительность QRS >120 мс, наличие ФП), вероятнее всего, окажется бесполезной с позиции первичной профилактики.
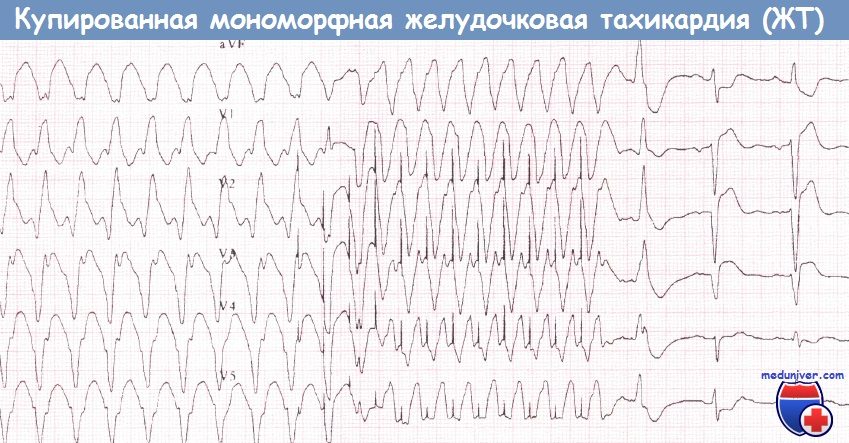 Мономорфная ЖТ, купированная с помощью короткой серии частых желудочковых стимулов: артефакты стимулов лучше всего видны в отведениях V3 и V4.
Мономорфная ЖТ, купированная с помощью короткой серии частых желудочковых стимулов: артефакты стимулов лучше всего видны в отведениях V3 и V4.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Новейший метод лечения аритмии сердца – имплантация ИКД (кардиовертера-дефибриллятора)
![]()
- Прогресс в медицинских технологиях обогатил врача новыми лечебными методиками и процедурами, которые позволяют контролировать и устранять аритмии. Имплантируемый кардиовертер-дефибриллятор (ИКД) – прибор, предназначенный для устранения угрожающих жизни аритмий и предотвращения внезапной остановки сердца, совмещающее в себе функцию кардиостимуляции (а при необходимости кардиоверсии/дефибрилляции). Кроме того, поскольку аритмия может ухудшать, а в некоторых случаях, и сама оказывать повреждающее действие на сердце (истощать сердечную мышцу, нарушать работу клапанного аппарата, вызывать увеличение размеров полостей сердца), риск аритмии возможно уменьшить, приобщаясь к здоровому образу жизни, включающему правильное питание и занятие спортом.
Товар добавлен в избранное
Имплантация кардиовертера-дефибриллятора
Имплантируемый кардиовертер-дефибриллятор (ИКД) – прибор, предназначенный для устранения угрожающих жизни аритмий и предотвращения остановки сердца.
 Аппарат позволяет производить экстренную дефибрилляцию, когда пациент, страдающий от желудочковой тахикардии или фибрилляции желудочков, находится при смерти. Нанесением высокоэнергетического разряда (шока) и при необходимости – с последующей кардиостимуляцией прибор останавливает смертельно опасную аритмию и спасает от летального исхода.
Аппарат позволяет производить экстренную дефибрилляцию, когда пациент, страдающий от желудочковой тахикардии или фибрилляции желудочков, находится при смерти. Нанесением высокоэнергетического разряда (шока) и при необходимости – с последующей кардиостимуляцией прибор останавливает смертельно опасную аритмию и спасает от летального исхода.
Куда и как устанавливается прибор?
Прибор ИКД обычно имплантируется под местной анестезией. Он устанавливается под ключицей, а выходящие из него электроды (провода, покрытые оболочкой) помещаются в сердце. Эта процедура обычно занимает 1–2 часа.
Электроды вводятся в вену на плече или у основания шеи. Кардиолог вводит провод в нужную камеру сердца, проверяет его положение на экране рентгеновского аппарата и закрепляет провод стежком на плече. Затем провод подключается к кардиостимулятору, который помещается в небольшой «карман», пространство между кожей и грудной мышцей. Врачи проверяют работу прибора, а затем зашивают разрез.
Принципы работы имплантируемого дефибриллятора
Аналогичны принципам работы кардиостимулятора, но при этом устройство дополняется функцией экстренной дефибрилляции. Что касается разновидностей, то современные приборы могут быть:
Однокамерными. Имеют только один дефибриллирующий электрод, который имплантируется в правый желудочек.
Двухкамерными. Оснащены двумя электродами, один из которых идет в правый желудочек, второй – в правое предсердие. Обычно их используют при сложных нарушениях в проводящей системе сердца. Некоторые двухкамерные дефибрилляторы оснащены дополнительными функциями, что обеспечивает минимизацию частоты ненужной стимуляции правого желудочка, а значит, и профилактику развития застойной сердечной недостаточности и проявлений мерцательной аритмии.
Трехкамерными. Это устройства для сердечной ресинхронизирующей терапии с функцией дефибрилляции (CRT-D).
Подкожными (S-ICD). В настоящее время не зарегистрированы на территории Российской Федерации.

Имплантируемый кардиовертер-дефибриллятор (ИКД) состоит из:
• Батарея (аккумулятор), которая снабжает электрической энергией имплантируемый дефибриллятор для того, чтобы он мог стимулировать сердце (посылать электрический импульс по электроду к сердцу). Маленькая герметичная литиевая батарея служит много лет. Когда батарея истощается, имплантируемый дефибриллятор полностью заменяется.
• Микросхема – подобна маленькому компьютеру внутри кардиостимулятора. Микросхема трансформирует энергию батареи в слабые электрические импульсы, которые пациент не чувствует. Микросхема контролирует продолжительность и мощность электрической энергии, затрачиваемой для импульса.
• Коннекторный блок – прозрачный блок из пластика находится в верхней части имплантируемого дефибриллятора. Коннекторный блок служит для соединения электродов и кардиостимулятора.

Электроды
Имплантируемый дефибриллятор через вены соединяется с сердцем посредством специальных электродов. Электроды крепятся в полости правого предсердия и в полости правого желудочка. В зависимости от вида ИКД (однокамерный, двухкамерный, трехкамерный) каждый электрод имеет свои конструктивные особенности и предназначен для стимуляции одной из камер сердца.
Ход операции
Имплантация прибора у взрослых проводится под местной анестезией, наркоз, как правило, применяется только у детей. Небольшой разрез делают под ключицей и через подключичную вену под рентген-контролем вводится электрод внутрь сердца. Наружный конец электрода соединяется с самим аппаратом, который погружается в подкожную жировую клетчатку в подключичной области. После чего разрез ушивают.
 Рис. Рентгеновский снимок с ИКД и электродом
Рис. Рентгеновский снимок с ИКД и электродом
После операции
Через 1-2 дня после операции проводится программирование аппарата. Это безболезненная процедура, которая не требует повторного хирургического вмешательства.
Нуждаются ли ИКД в замене?
Все ИКД нуждаются в замене. Частота замены зависит от типа устройства и скорости истощения батареи питания, на которую влияет частота возникновения опасных аритмий, потребность функционирования ИКД в качестве электрокардиостимулятора, дополнительные диагностические и лечебные функции, запрограммированные в ИКД.
Если опасная аритмия, требующая дефибриллирующих шоков, не возникает, аппарат может находиться в «ждущем» режиме в течение многих лет. ИКД заменяют, когда в нём еще достаточно энергии для устранения аритмий, которые могут возникнуть в период ожидания замены. Реимплантация ИКД обычно менее длительная процедура. Если электроды функционируют хорошо, их, не заменяя на новые, стыкуют с другим аппаратом.
В каждой конкретной ситуации выбор устройства осуществляется хирургом-аритмологом.
Иплантируемые кардиовертеры-дефибрилляторы BIOTRONIK®
Сегодня немецкий производитель BIOTRONIK® – один из крупнейших мировых производителей медицинской техники, включая кардиостимуляторы и кардиовертеры-дефибрилляторы.
Компания специализируется на опытно-конструкторской и производственной работе, выпуская оборудование для сердечно-сосудистой системы и имплантируемые электронные системы.

Рис. ИКД BIOTRONIK Lumax 340 DR-T
ПРИМЕНЕНИЕ ИМПЛАНТИРУЕМЫХ КАРДИОВЕРТЕРОВ-ДЕФИБРИЛЛЯТОРОВ ДЛЯ ПРОФИЛАКТИКИ ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ


ventricular tachycardia, electrophysiological study, sudden cardiac death, ventricular fibrillation, multicentered trials, implanted cardioverters-defibrillators, prevention


Origins of sudden cardiac death and methods of its prevention are analyzed. The data of multicenter trials on assessment of the effectiveness of implanted cardioverters-defibrillators in prevention of sudden death are considered. The authors’ data on implantation of cardioverters-defibrillators and catheter ablation of ventricular tachycardias are given.


ВА-N36 от 25/11/2004, стр. 65-70 /.. В помощь практическому врачу


Под внезапной сердечной смертью (ВСС) понимают смерть развившуюся моментально или смерть наступившую в течение часа с момента возникновения острых изменений в клиническом статусе пациента [1]. В структуре общей смертности на долю ВСС приходится около 10% [2]. Согласно данным Национального центра медицинской статистики США в 1985 г. около 400000 смертей были классифицированы как внезапные у лиц старше 25 лет. В Российской Федерации официальные статистические данные по этому вопросу противоречивы в силу объективных и субъективных причин. Так в 2002 г., в такой государственной структуре как Министерство Обороны, по данным медицинских отчетов диагноз ВСС смерти фигурировал как причина смерти только у 36 человек. Принимая во внимание то, что средняя продолжительность жизни мужского населения в России гораздо ниже, чем в индустриально развитых странах и составляет 57 лет, можно предположить, что абсолютное число внезапных смертей в общей популяции будет велико.
Механизмами, лежащими в основе развития ВСС в подавляющем большинстве случаев являются желудочковая тахикардия (ЖТ) и фибрилляция желудочков (ФЖ) – 95%, а оставшиеся 5% приходятся на долю брадиаритмий и асистолии. Основной причиной ВСС является ишемическая болезнь сердца (ИБС). На ее долю приходится около 80% всех внезапных смертей. Интересны такие факты, что у 25% больных ИБС ВСС является первой клинической манифестацией болезни и 50% больных ИБС умирают внезапно [3]. К другим нозологическим формам, при которых ВСС является исходом течения заболевания, относятся дилятационная и гипертрофическая кардиомиопатии (ДКМП и ГКМП), аритмогенная дисплазия правого желудочка (АДПЖ), синдромы Бругада и удлиненного QT, аномалии развития коронарных артерий и прочие состояния.
По данным J.Ruskin (1998) основными причинами ВСС являются: ИБС, ДКМП, гипертрофия левого желудочка, ГКМП, приобретенные и врожденные пороки сердца, острый миокардит, АДПЖ, аномалии развития коронарных артерий, саркоидоз, амилоидоз, опухоли сердца, дивертикулы левого желудочка, синдром WPW, синдром удлиненного интервала QT, лекарственная проаритмия, кокаиновая интоксикация, выраженный электролитный дисбаланс и идиопатическая ЖТ.
В 1984 г. J.T.Bigger выделил предикторы ВСС и провел анализ вероятности ее развития в зависимости от конкретной клинической ситуации. Им было установлено, что указания на перенесенный острый инфаркт миокарда (ОИМ) в анамнезе, значение фракции выброса левого желудочка (ФВ) ниже 40%, эпизоды желудочковой тахикардии, синкопальные состояния и сердечный арест в анамнезе являются наиболее прогностически значимыми предикторами развития ВСС. На основании анализа полученных данных были выделены группы с высоким и умеренным риском развития ВСС (см. табл. 1).
Таблица 1. Риск развития внезапной сердечной смерти в течение года в группах пациентов.
Группа высокого риска
где, ОИМ – острый инфаркт миокарда, ФВ – фракция выброса, ЖЭ – частая желудочковая экстрасистолия, ЖТ – желудочковая тахикардия, ВСС – внезапная сердечная смерть.
В современной кардиологии основными методами профилактики ВСС являются: имплантация кардиовертера-дефибриллятора (ИКД), проведение постоянной медикаментозной антиаритмической терапии (ААТ), выполнение радиочастотной абляции (РЧА) с целью устранения желудочковых нарушений ритма, осуществление реваскуляризации коронарных артерий. История применения ИКД в клинической практике насчитывает не более тридцати лет и сегодня эффективность современных устройств при ФЖ и ЖТ приближается к 100%.
В 1970 г. M.Mirowski и M.Mower, потрясенные внезапной смертью своего коллеги, предложили концепцию создания имплантируемого прибора, который мог бы автоматически проводить неотложную терапию в случае развития жизнеугрожающих желудочковых тахиаритмий. Уже в 1980 г. M.Mirowski осуществил первую в мире успешную операцию по имплантации ИКД молодой женщине с рецидивирующими эпизодами сердечного ареста вследствие ФЖ. В последующем этот вид терапии стал одним из самых эффективных методов профилактики ВСС.
Современный ИКД представляет собой систему, состоящую из устройства, заключенного в небольшой титановый корпус и соединенных с ним одного или более электродов, расположенных в камерах сердца. Аппарат содержит источник питания (литиево-серебрянно-ваннадиевую батарею), преобразователь напряжения, резисторы, конденсатор, микропроцессор, системы анализа сердечного ритма, высвобождения разряда, базу данных электрограмм аритмических событий. В клинической практике применяются желудочковые и предсердные электроды с пассивной и активной фиксацией для проведения дефибрилляции, антитахикардической, антибрадикардической электрокардиостимуляции и ресинхронизирующей терапии. На сегодняшний день используются одно-, двух- и трехкамерные (бивентрикулярные) системы.
В основе детекции аритмий лежит анализ частоты собственного ритма, морфологии желудочкового сигнала, стабильность RR-интервала, соотношение характеристик предсердной и желудочковой активности (в двухкамерных системах). Указанные характеристики позволяют устройству дифференцировать желудочковые и наджелудочковые тахиаритмии.
В ИКД существуют так называемые зоны детекции быстрых и медленных ЖТ. В том случае, если частота аритмии попадает в первую зону, то происходит разряд дефибриллятора для купирования ФЖ или быстрой ЖТ. Во второй зоне возможно проведение различных видов антитахикардической желудочковой стимуляции для подавления аритмий. Параметры детекции и алгоритмы терапии для каждой зоны определяются в зависимости от характеристик ЖТ с помощью программатора. При последующем наблюдении, в зависимости от клинической ситуации, проводимой медикаментозной терапии эти значения могут корригироваться.
Алгоритм терапии устанавливается индивидуально, на основании переносимости больным тахикардии. При гемодинамически незначимой, относительно медленной ЖТ, могут быть эффективны burst (стимуляция короткими пачками импульсов с частотой на 10-30% превышающей частоту тахикардии) или ramp (стимуляция импульсами с постепенно увеличивающейся частотой, при которой каждый импульс укорачивает цикл стимуляции по сравнению с предыдущим) режимы антитахикардической стимуляции, а при их неэффективности – кардиоверсией. При развитии ФЖ или быстрой ЖТ первым шагом в терапии сразу является дефибрилляция. При этом мощность разряда должна на 10 Дж превышать интраоперационный порог дефибрилляции с последующим пошаговым увеличением агрессивности терапии в виде нарастания мощности разряда до максимальных значений (30 Дж), а также с изменением полярности в цепи дефибрилляции от корпуса ИКД к внутрисердечному электроду и наоборот [4].
ЭФФЕКТИВНОСТЬ ИКД ПРИ РАЗЛИЧНЫХ НОЗОЛОГИЧЕСКИХ ФОРМАХ, ДАННЫЕ МНОГОЦЕНТРОВЫХ ИССЛЕДОВАНИЙ
Вторичная профилактика ВСС
Эффективность ИКД для вторичной профилактики ВСС у больных ИБС была доказана несколькими крупными многоцентровыми исследованиями, проведенными в 90-х годах ХХ века. Исследование The Antiarrhythmics Versus Implantable Defibrillators – AVID (ААТ амиодароном в сравнение с дефибрилляторами) включало 1016 пациентов, имевших в анамнезе указания на один или более эпизодов ФЖ или устойчивую гемодинамически значимую ЖТ. Кроме того, у этих больных была снижена ФВ. В первой группе больные получали амиодарон, а пациентам второй группы имплантировался ИКД. Анализ полученных предварительных результатов привел к тому, что этическим комитетом было принято решение о досрочном завершении исследования.
Причиной досрочного завершения исследования стали данные, свидетельствующие о том, что в группе больных с ИКД смертность была на 29% ниже, чем в группе пациентов, получавших ААТ [5]. Интересен тот факт, что данное исследование состоялось через 13 лет после вышеупомянутой публикации T.J.Bigger, а критериями включения больных в протокол являлись хорошо известные положения, характеризующие группы пациентов с умеренным и высоким риском развития ВСС, которые были выделены еще в 1984 г.
В исследовании The Multicenter Automatic Defibrillator Implantation Trial – MADIT I (многоцентровое исследование имплантированных ИКД) приняло участие 196 пациентов ИБС, c неустойчивой ЖТ, ФВ левого желудочка менее 35% и индуцированной во время эндокардиального электрофизиологического исследования (ЭФИ) устойчивой и не купируемой новокаинамидом ЖТ или ФЖ. В первой группе пациентам проводилась медикаментозная ААТ, а во второй выполнялась имплантация ИКД. За 27 месяцев наблюдения в группе ИКД уменьшение общей смертности составило 54% [6].
При включении в протокол исследования The Multicenter Unsustained Tachycardia Trial – MUSTT (многоцентровое исследование пациентов с неустойчивой желудочковой тахикардией) критерии были схожи с предыдущим: указания на ОИМ в анамнезе, ФВ ниже 40%, спонтанная неустойчивая ЖТ и/или ЖТ индуцированная при эндокардиальном ЭФИ. Больные были разделены на три группы. Если у пациента в ходе эндокардиального ЭФИ верифицировалась ЖТ, то по его выбору ему проводилась либо ААТ, с последующими контрольными эндокардиальными ЭФИ, для оценки эффективности проводимого лечения, либо ему имплантировался ИКД или же никакая профилактика ВСС не проводилась. За пять лет наблюдения смертность в группе с ИКД составила 24%, в группе с ААТ – 55% и в группе без терапии – 48% [7].
Результаты вышеперечисленных исследований показали значительное снижение количества внезапных смертей в группах больных получавших терапию ИКД по сравнению с ААТ. Данный факт позволяет утверждать, что на сегодняшний день ИКД является средством выбора для проведения вторичной профилактики сердечного ареста у больных ИБС.
Первичная профилактика ВСС
Оценка эффективности первичной профилактики ВСС у пациентов ИБС с имплантированными ИКД проводилась в таких исследованиях как The Coronary Artery Bypass Graft Patch – CABG Patch (исследование пациентов перенесших аортокоронарное шунтирование). В нем приняло участие 900 пациентов с ФВ ниже 35%, у которых регистрировались поздние потенциалы на ЭКГ высокого разрешения и была выполнена процедура коронарной реваскуляризации методом аортокоронарного шунтирования (АКШ). Больные подразделялись на 2 группы. В первой проводилась имплантация ИКД с использованием эпикардиальных электродов, а во второй назначалась медикаментозная ААТ. За 32±16 месяцев наблюдения показатели общей смертности в обеих группах не практически не отличались. Интересен тот факт, что около 10% смертей в группе больных с ИКД были связаны с процедурой имплантации устройства, которая в тот период времени подразумевала выполнение торакотомии с использованием общей анестезией [8].
Исследование The Second Multicenter Automatic Defibrillator Implantation Trial – MADIT II (второе многоцентровое исследование имплантированных ИКД) включало 1232 пациента ИБС, с указанием на ОИМ в анамнезе и ФВ ниже 30%. Проводилась рандомизация на группы пациентов с ИКД и контрольную, в которой проводилась только базовая терапия ИБС и недостаточности кровообращения. За период наблюдения 20 месяцев смертность в группе ИКД составила 14,2%, а в контрольной группе 19,8% [9]. Эти данные предполагают значительное увеличение числа имплантаций ИКД в индустриально развитых странах. Так только в Германии ожидается трехкратное увеличение процедур имплантации. Хотя уже на сегодняшний день Германия занимает передовые позиции по числу имплантаций (120 устройств в год на 1 миллион населения).
Первичная и вторичная профилактика ВСС
В ряде исследований проводилась оценка как первичной, так и вторичной профилактики ВСС при патологии сердца, не связанной с поражением коронарных артерий. Эффективность ИКД у больных ДКМП проводилась в исследовании Cardiomyopathy Trial (CAT) в котором участвовало 104 пациента с ФВ ниже 30%. Результаты показали, что выживаемость среди пациентов, получавших ИКД-терапию и ее не получавших, не отличалась за 32 месячный период наблюдения. В протокол были включены как лица, пережившие сердечный арест , так и без него. Значимых различий в выживаемости среди этих групп больных не было. В работе M.Zecchin было продемонстрировано, что имплантация ИКД абсолютно показана тем больным ДКМП, у которых в анамнезе имеются указания на эпизод сердечного ареста. Более того было выявлено, что имплантация ИКД в случае сочетания сниженной ФВ (ниже 30%), увеличения конечно-диастолического диаметра левого желудочка более 70 мм, эпизодов неустойчивой ЖТ и длительного анамнеза заболевания, согласно современным данным, является эффективным методом как вторичной, так и первичной профилактики ВСС у больных с ДКМП. [2].
Эффективность ИКД для первичной и вторичной профилактики ВСС у 132 больных АДПЖ была продемонстрирована в исследовании DARVIN. Было показано, что в 50% случаев ИКД осуществлял терапию, причем существенных различий в аритмических событиях и эпизодах включения ИКД в группах пациентов, которым осуществлялась первичная и вторичная профилактика, не было. Кроме того, данные этого исследования позволили выделить факторы высокого риска развития жизнеугрожающих аритмий у пациентов с АДПЖ. Прежде всего, это лица пережившие сердечный арест, имеющие в анамнезе эпизоды гемодинамически нестабильной ЖТ, молодой возраст и вовлечение в процесс левых отделов сердца [10, 11].
Анализ результатов многочисленных работ с участием значительного числа пациентов с различной патологией миокарда показал, что предвестники, определенные в 1984 г. J.T.Bigger, на сегодняшний день остаются маркерами высокой вероятности развития ВСС. Кроме того, сам диагноз ИБС, по сути, является фактором риска ВСС и ее профилактика должна обсуждаться уже на ранних стадиях заболевания.
Интересна взаимосвязь стадии недостаточности кровообращения и вероятности развития ВСС. Так у пациентов с I-II функциональным классом недостаточности кровообращения по NYHA доля внезапных смертей в структуре общей кардиальной смертности составляет 50-80%, а у больных с III-IV функциональным классом смертность обусловлена в основном прогрессией сердечной недостаточности, а на ВСС приходится лишь около 30%. В работе R.Мeyburg [12] проведен анализ отбора пациентов, участвовавших в крупных исследованиях по оценке эффективности ИКД-терапии для первичной и вторичной профилактики ВСС. Им было установлено, что современный подход к выделению групп высокого риска, основанный на результатах таких исследований как AVID, MADIT-I, MADIT-II, CASH недостаточен и охватывает меньше половины пациентов, которые, в конечном счете, умирают внезапно. У основной же категории больных, умерших внезапно, эти факторы риска не выявлялись (см. табл. 2).
Таблица 2. Вероятность внезапной смерти в различных группах пациентов.
Эффективность имплантации кардиовертера-дефибрилятора в первичной профилактике у больных ХСН
Актуальность
В соответствии с действующими рекомендациями по сердечной недостаточности, всем пациентам с хронической сердечной недостаточностью (ХСН) и снижением фракции выброса ≤35%, несмотря на оптимальную медикаментозную терапию в течение как минимум 3-х месяцев, с целью первичной профилактики внезапной сердечной смерти необходима имплантация кардиовертера-дефибриллятора. В то же время обсуждается, что у некоторых категорий пациентов, например, у больных с неишемическим генезом сердечной недостаточности подобный подход оказывается неэффективным. В связи с чем целью обсуждающегося исследования стала оценка эффективности имплантируемого кардиовертера-дефибриллятора (ИКД) у пациентов с ХСН по данным продленного наблюдения за участниками исследования SCD-HeFT.
В данном исследовании анализировались сведения об участниках исследования SCD-HeFT, сравнившего эффективность ИКД, амиодарона и плацебо в отношении смерти от всех причин у пациентов с ХСН.
Средний период наблюдения за участниками составил 11 (10; 12.2) лет.
В соответствии с анализом intention-to-treat, установка ИКД снижала риск смерти от всех причин на 13%, по сравнению с плацебо (отношение рисков 0.87; 95% доверительный интервал 0.76-0.98; p=0.028).
В анализе подгрупп было продемонстрировано, что эффективность ИКД в отдаленном периоде зависела от этиологии ХСН и функционального класса по NYHA.
Так, у пациентов с ишемической ХСН ИКД снижал риск смерти от всех причин (отношение рисков 0.81; 95% доверительный интервал 0.69-0.95; p=0.009), тогда как у больных с неишемической причиной ХСН – нет (отношение рисков 0.97; 95% доверительный интервал 0.79-1.2; p=0.802).
При II функциональном классе классе по NYHA снижение риска смерти от всех причин составило 24% (отношение рисков 0.76; 95% доверительный интервал 0.65-0.9; p=0.001), тогда как при III функциональном классе оно не достигало статистической значимости (отношение рисков 1.06; 95% доверительный интервал 0.86-1.31; p=0.575).
Таким образом, 11-летнее наблюдение за участниками исследования SCD-HeFT продемонстрировало, что у пациентов с ХСН польза ИКД сохраняется и в таком отдаленном периоде, причем эффективность ИКД оказывается наибольшей в подгруппе пациентов с ишемическим генезом ХСН и II функциональным классом по NYHA на момент включение в исследование.
Poole J, et al. J Am Coll Cardiol. 2020;76(4):405-415.

Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
ПРИМЕНЕНИЕ ИМПЛАНТИРУЕМЫХ КАРДИОВЕРТЕРОВ-ДЕФИБРИЛЛЯТОРОВ ДЛЯ ПРОФИЛАКТИКИ ВНЕЗАПНОЙ СЕРДЕЧНОЙ СМЕРТИ


ventricular tachycardia, electrophysiological study, sudden cardiac death, ventricular fibrillation, multicentered trials, implanted cardioverters-defibrillators, prevention


Origins of sudden cardiac death and methods of its prevention are analyzed. The data of multicenter trials on assessment of the effectiveness of implanted cardioverters-defibrillators in prevention of sudden death are considered. The authors’ data on implantation of cardioverters-defibrillators and catheter ablation of ventricular tachycardias are given.


ВА-N36 от 25/11/2004, стр. 65-70 /.. В помощь практическому врачу


Под внезапной сердечной смертью (ВСС) понимают смерть развившуюся моментально или смерть наступившую в течение часа с момента возникновения острых изменений в клиническом статусе пациента [1]. В структуре общей смертности на долю ВСС приходится около 10% [2]. Согласно данным Национального центра медицинской статистики США в 1985 г. около 400000 смертей были классифицированы как внезапные у лиц старше 25 лет. В Российской Федерации официальные статистические данные по этому вопросу противоречивы в силу объективных и субъективных причин. Так в 2002 г., в такой государственной структуре как Министерство Обороны, по данным медицинских отчетов диагноз ВСС смерти фигурировал как причина смерти только у 36 человек. Принимая во внимание то, что средняя продолжительность жизни мужского населения в России гораздо ниже, чем в индустриально развитых странах и составляет 57 лет, можно предположить, что абсолютное число внезапных смертей в общей популяции будет велико.
Механизмами, лежащими в основе развития ВСС в подавляющем большинстве случаев являются желудочковая тахикардия (ЖТ) и фибрилляция желудочков (ФЖ) – 95%, а оставшиеся 5% приходятся на долю брадиаритмий и асистолии. Основной причиной ВСС является ишемическая болезнь сердца (ИБС). На ее долю приходится около 80% всех внезапных смертей. Интересны такие факты, что у 25% больных ИБС ВСС является первой клинической манифестацией болезни и 50% больных ИБС умирают внезапно [3]. К другим нозологическим формам, при которых ВСС является исходом течения заболевания, относятся дилятационная и гипертрофическая кардиомиопатии (ДКМП и ГКМП), аритмогенная дисплазия правого желудочка (АДПЖ), синдромы Бругада и удлиненного QT, аномалии развития коронарных артерий и прочие состояния.
По данным J.Ruskin (1998) основными причинами ВСС являются: ИБС, ДКМП, гипертрофия левого желудочка, ГКМП, приобретенные и врожденные пороки сердца, острый миокардит, АДПЖ, аномалии развития коронарных артерий, саркоидоз, амилоидоз, опухоли сердца, дивертикулы левого желудочка, синдром WPW, синдром удлиненного интервала QT, лекарственная проаритмия, кокаиновая интоксикация, выраженный электролитный дисбаланс и идиопатическая ЖТ.
В 1984 г. J.T.Bigger выделил предикторы ВСС и провел анализ вероятности ее развития в зависимости от конкретной клинической ситуации. Им было установлено, что указания на перенесенный острый инфаркт миокарда (ОИМ) в анамнезе, значение фракции выброса левого желудочка (ФВ) ниже 40%, эпизоды желудочковой тахикардии, синкопальные состояния и сердечный арест в анамнезе являются наиболее прогностически значимыми предикторами развития ВСС. На основании анализа полученных данных были выделены группы с высоким и умеренным риском развития ВСС (см. табл. 1).
Таблица 1. Риск развития внезапной сердечной смерти в течение года в группах пациентов.
Группа высокого риска
где, ОИМ – острый инфаркт миокарда, ФВ – фракция выброса, ЖЭ – частая желудочковая экстрасистолия, ЖТ – желудочковая тахикардия, ВСС – внезапная сердечная смерть.
В современной кардиологии основными методами профилактики ВСС являются: имплантация кардиовертера-дефибриллятора (ИКД), проведение постоянной медикаментозной антиаритмической терапии (ААТ), выполнение радиочастотной абляции (РЧА) с целью устранения желудочковых нарушений ритма, осуществление реваскуляризации коронарных артерий. История применения ИКД в клинической практике насчитывает не более тридцати лет и сегодня эффективность современных устройств при ФЖ и ЖТ приближается к 100%.
В 1970 г. M.Mirowski и M.Mower, потрясенные внезапной смертью своего коллеги, предложили концепцию создания имплантируемого прибора, который мог бы автоматически проводить неотложную терапию в случае развития жизнеугрожающих желудочковых тахиаритмий. Уже в 1980 г. M.Mirowski осуществил первую в мире успешную операцию по имплантации ИКД молодой женщине с рецидивирующими эпизодами сердечного ареста вследствие ФЖ. В последующем этот вид терапии стал одним из самых эффективных методов профилактики ВСС.
Современный ИКД представляет собой систему, состоящую из устройства, заключенного в небольшой титановый корпус и соединенных с ним одного или более электродов, расположенных в камерах сердца. Аппарат содержит источник питания (литиево-серебрянно-ваннадиевую батарею), преобразователь напряжения, резисторы, конденсатор, микропроцессор, системы анализа сердечного ритма, высвобождения разряда, базу данных электрограмм аритмических событий. В клинической практике применяются желудочковые и предсердные электроды с пассивной и активной фиксацией для проведения дефибрилляции, антитахикардической, антибрадикардической электрокардиостимуляции и ресинхронизирующей терапии. На сегодняшний день используются одно-, двух- и трехкамерные (бивентрикулярные) системы.
В основе детекции аритмий лежит анализ частоты собственного ритма, морфологии желудочкового сигнала, стабильность RR-интервала, соотношение характеристик предсердной и желудочковой активности (в двухкамерных системах). Указанные характеристики позволяют устройству дифференцировать желудочковые и наджелудочковые тахиаритмии.
В ИКД существуют так называемые зоны детекции быстрых и медленных ЖТ. В том случае, если частота аритмии попадает в первую зону, то происходит разряд дефибриллятора для купирования ФЖ или быстрой ЖТ. Во второй зоне возможно проведение различных видов антитахикардической желудочковой стимуляции для подавления аритмий. Параметры детекции и алгоритмы терапии для каждой зоны определяются в зависимости от характеристик ЖТ с помощью программатора. При последующем наблюдении, в зависимости от клинической ситуации, проводимой медикаментозной терапии эти значения могут корригироваться.
Алгоритм терапии устанавливается индивидуально, на основании переносимости больным тахикардии. При гемодинамически незначимой, относительно медленной ЖТ, могут быть эффективны burst (стимуляция короткими пачками импульсов с частотой на 10-30% превышающей частоту тахикардии) или ramp (стимуляция импульсами с постепенно увеличивающейся частотой, при которой каждый импульс укорачивает цикл стимуляции по сравнению с предыдущим) режимы антитахикардической стимуляции, а при их неэффективности – кардиоверсией. При развитии ФЖ или быстрой ЖТ первым шагом в терапии сразу является дефибрилляция. При этом мощность разряда должна на 10 Дж превышать интраоперационный порог дефибрилляции с последующим пошаговым увеличением агрессивности терапии в виде нарастания мощности разряда до максимальных значений (30 Дж), а также с изменением полярности в цепи дефибрилляции от корпуса ИКД к внутрисердечному электроду и наоборот [4].
ЭФФЕКТИВНОСТЬ ИКД ПРИ РАЗЛИЧНЫХ НОЗОЛОГИЧЕСКИХ ФОРМАХ, ДАННЫЕ МНОГОЦЕНТРОВЫХ ИССЛЕДОВАНИЙ
Вторичная профилактика ВСС
Эффективность ИКД для вторичной профилактики ВСС у больных ИБС была доказана несколькими крупными многоцентровыми исследованиями, проведенными в 90-х годах ХХ века. Исследование The Antiarrhythmics Versus Implantable Defibrillators – AVID (ААТ амиодароном в сравнение с дефибрилляторами) включало 1016 пациентов, имевших в анамнезе указания на один или более эпизодов ФЖ или устойчивую гемодинамически значимую ЖТ. Кроме того, у этих больных была снижена ФВ. В первой группе больные получали амиодарон, а пациентам второй группы имплантировался ИКД. Анализ полученных предварительных результатов привел к тому, что этическим комитетом было принято решение о досрочном завершении исследования.
Причиной досрочного завершения исследования стали данные, свидетельствующие о том, что в группе больных с ИКД смертность была на 29% ниже, чем в группе пациентов, получавших ААТ [5]. Интересен тот факт, что данное исследование состоялось через 13 лет после вышеупомянутой публикации T.J.Bigger, а критериями включения больных в протокол являлись хорошо известные положения, характеризующие группы пациентов с умеренным и высоким риском развития ВСС, которые были выделены еще в 1984 г.
В исследовании The Multicenter Automatic Defibrillator Implantation Trial – MADIT I (многоцентровое исследование имплантированных ИКД) приняло участие 196 пациентов ИБС, c неустойчивой ЖТ, ФВ левого желудочка менее 35% и индуцированной во время эндокардиального электрофизиологического исследования (ЭФИ) устойчивой и не купируемой новокаинамидом ЖТ или ФЖ. В первой группе пациентам проводилась медикаментозная ААТ, а во второй выполнялась имплантация ИКД. За 27 месяцев наблюдения в группе ИКД уменьшение общей смертности составило 54% [6].
При включении в протокол исследования The Multicenter Unsustained Tachycardia Trial – MUSTT (многоцентровое исследование пациентов с неустойчивой желудочковой тахикардией) критерии были схожи с предыдущим: указания на ОИМ в анамнезе, ФВ ниже 40%, спонтанная неустойчивая ЖТ и/или ЖТ индуцированная при эндокардиальном ЭФИ. Больные были разделены на три группы. Если у пациента в ходе эндокардиального ЭФИ верифицировалась ЖТ, то по его выбору ему проводилась либо ААТ, с последующими контрольными эндокардиальными ЭФИ, для оценки эффективности проводимого лечения, либо ему имплантировался ИКД или же никакая профилактика ВСС не проводилась. За пять лет наблюдения смертность в группе с ИКД составила 24%, в группе с ААТ – 55% и в группе без терапии – 48% [7].
Результаты вышеперечисленных исследований показали значительное снижение количества внезапных смертей в группах больных получавших терапию ИКД по сравнению с ААТ. Данный факт позволяет утверждать, что на сегодняшний день ИКД является средством выбора для проведения вторичной профилактики сердечного ареста у больных ИБС.
Первичная профилактика ВСС
Оценка эффективности первичной профилактики ВСС у пациентов ИБС с имплантированными ИКД проводилась в таких исследованиях как The Coronary Artery Bypass Graft Patch – CABG Patch (исследование пациентов перенесших аортокоронарное шунтирование). В нем приняло участие 900 пациентов с ФВ ниже 35%, у которых регистрировались поздние потенциалы на ЭКГ высокого разрешения и была выполнена процедура коронарной реваскуляризации методом аортокоронарного шунтирования (АКШ). Больные подразделялись на 2 группы. В первой проводилась имплантация ИКД с использованием эпикардиальных электродов, а во второй назначалась медикаментозная ААТ. За 32±16 месяцев наблюдения показатели общей смертности в обеих группах не практически не отличались. Интересен тот факт, что около 10% смертей в группе больных с ИКД были связаны с процедурой имплантации устройства, которая в тот период времени подразумевала выполнение торакотомии с использованием общей анестезией [8].
Исследование The Second Multicenter Automatic Defibrillator Implantation Trial – MADIT II (второе многоцентровое исследование имплантированных ИКД) включало 1232 пациента ИБС, с указанием на ОИМ в анамнезе и ФВ ниже 30%. Проводилась рандомизация на группы пациентов с ИКД и контрольную, в которой проводилась только базовая терапия ИБС и недостаточности кровообращения. За период наблюдения 20 месяцев смертность в группе ИКД составила 14,2%, а в контрольной группе 19,8% [9]. Эти данные предполагают значительное увеличение числа имплантаций ИКД в индустриально развитых странах. Так только в Германии ожидается трехкратное увеличение процедур имплантации. Хотя уже на сегодняшний день Германия занимает передовые позиции по числу имплантаций (120 устройств в год на 1 миллион населения).
Первичная и вторичная профилактика ВСС
В ряде исследований проводилась оценка как первичной, так и вторичной профилактики ВСС при патологии сердца, не связанной с поражением коронарных артерий. Эффективность ИКД у больных ДКМП проводилась в исследовании Cardiomyopathy Trial (CAT) в котором участвовало 104 пациента с ФВ ниже 30%. Результаты показали, что выживаемость среди пациентов, получавших ИКД-терапию и ее не получавших, не отличалась за 32 месячный период наблюдения. В протокол были включены как лица, пережившие сердечный арест , так и без него. Значимых различий в выживаемости среди этих групп больных не было. В работе M.Zecchin было продемонстрировано, что имплантация ИКД абсолютно показана тем больным ДКМП, у которых в анамнезе имеются указания на эпизод сердечного ареста. Более того было выявлено, что имплантация ИКД в случае сочетания сниженной ФВ (ниже 30%), увеличения конечно-диастолического диаметра левого желудочка более 70 мм, эпизодов неустойчивой ЖТ и длительного анамнеза заболевания, согласно современным данным, является эффективным методом как вторичной, так и первичной профилактики ВСС у больных с ДКМП. [2].
Эффективность ИКД для первичной и вторичной профилактики ВСС у 132 больных АДПЖ была продемонстрирована в исследовании DARVIN. Было показано, что в 50% случаев ИКД осуществлял терапию, причем существенных различий в аритмических событиях и эпизодах включения ИКД в группах пациентов, которым осуществлялась первичная и вторичная профилактика, не было. Кроме того, данные этого исследования позволили выделить факторы высокого риска развития жизнеугрожающих аритмий у пациентов с АДПЖ. Прежде всего, это лица пережившие сердечный арест, имеющие в анамнезе эпизоды гемодинамически нестабильной ЖТ, молодой возраст и вовлечение в процесс левых отделов сердца [10, 11].
Анализ результатов многочисленных работ с участием значительного числа пациентов с различной патологией миокарда показал, что предвестники, определенные в 1984 г. J.T.Bigger, на сегодняшний день остаются маркерами высокой вероятности развития ВСС. Кроме того, сам диагноз ИБС, по сути, является фактором риска ВСС и ее профилактика должна обсуждаться уже на ранних стадиях заболевания.
Интересна взаимосвязь стадии недостаточности кровообращения и вероятности развития ВСС. Так у пациентов с I-II функциональным классом недостаточности кровообращения по NYHA доля внезапных смертей в структуре общей кардиальной смертности составляет 50-80%, а у больных с III-IV функциональным классом смертность обусловлена в основном прогрессией сердечной недостаточности, а на ВСС приходится лишь около 30%. В работе R.Мeyburg [12] проведен анализ отбора пациентов, участвовавших в крупных исследованиях по оценке эффективности ИКД-терапии для первичной и вторичной профилактики ВСС. Им было установлено, что современный подход к выделению групп высокого риска, основанный на результатах таких исследований как AVID, MADIT-I, MADIT-II, CASH недостаточен и охватывает меньше половины пациентов, которые, в конечном счете, умирают внезапно. У основной же категории больных, умерших внезапно, эти факторы риска не выявлялись (см. табл. 2).
Таблица 2. Вероятность внезапной смерти в различных группах пациентов.
Имплантируемые дефибрилляторы
Каким пациентам могут помочь имплантируемые дефибрилляторы? Как работает такой дефибриллятор? Как изменяется распорядок дня пациента? Какие неотложные состояния могут возникнуть у пациентов с имплантируемыми дефибрилляторами? Рисунок 1
Каким пациентам могут помочь имплантируемые дефибрилляторы?
Как работает такой дефибриллятор?
Как изменяется распорядок дня пациента?
Какие неотложные состояния могут возникнуть у пациентов с имплантируемыми дефибрилляторами?
 |
| Рисунок 1. Сегодня в Великобритании пациентов с имплантированными дефибрилляторами чуть меньше 1000, но их число растет |
Внезапная остановка сердца — самая частая причина гибели людей. Если говорить о заболеваниях сердечно-сосудистой системы в целом, то смертность от внезапной остановки сердца составляет приблизительно 50%. Люди старше 60 лет в основном умирают по этой причине, после 45 подобная вероятность с каждым десятком лет удваивается (табл. 1).
У четверти пациентов острая сердечная недостаточность оказывается первым явным проявлением заболевания коронарных артерий, хотя предшествующий инфаркт миокарда обнаруживается в 70% аутопсий.
После внезапной остановки сердца, случившейся во внебольничных условиях, выживают немногие, но и у переживших ее при отсутствии соответствующего лечения с вероятностью 40% разовьется повторный инфаркт в течение ближайших двух лет. Хотя применение антиаритмических средств снижает эту вероятность, однако в течение ближайших трех лет остановка сердца все же наблюдается у 15% пациентов.
Разработка имплантируемых кардиовертерных дефибрилляторов (ИКД), определяющих патологические изменения сердечного ритма и прерывающих их электрическим путем, позволила создать новую методику лечения пациентов из группы риска развития серьезных нарушений сердечного ритма. Огромное количество таких больных и быстрое развитие ИКД-технологии привело к существенному увеличению числа пациентов с ИКД (рис. 1).
 |
| Рисунок 2. Последние модели ИКД состоят из маленького генератора, устанавливаемого субпекторально, и обычного внутривенного проводника, заканчивающегося в правом отделе сердца |
В 1995 году более 90000 людей во всем мире пользовались ИКД, из них на долю США приходились 20000. Количество имплантантов в Великобритании еще не достигло тясячной отметки, но неуклонно продолжает расти. В связи с этим важно, чтобы все врачи, а не только электрофизиологи и кардиологи, освоили основные принципы, касающиеся ИКД.
- Возможности ИКД
Поддерживающий пейсмейкер. ИКД работает как поддерживающий желудочковый пейсмейкер и программируется на ведение ритма желудочковых сокращений при падении частоты собственных сердечных сокращений ниже допустимого установленного уровня.
Эта способность очень важна по нескольким причинам. Во-первых, после прекращения желудочковой тахикардии часто развивается преходящая брадикардия или асистолия. Устройство воспринимает это и поддерживает необходимый ритм, пока не восстановится скорость собственных сердечных сокращений (рис. 3).
Персистирующие и устойчивые к терапии тахиаритмии могут переходить в агональную фазу брадикардии. ИКД контролирует и эту ситуацию, выполняя роль водителя ритма, хотя вероятность восстановления эффективной механической активности сердца все же невелика.
 |
| Рисунок 3. Послешоковый ритм. Представлены семь одновременных записей ЭКГ. После разряда может наблюдаться преходящая брадикардия или асистолия. ИКД ведет ритм (показано стрелками), когда скорость сердечных сокращений падает ниже заданного уровня |
И наконец, пациенты с ИКД зачастую страдают функциональной недостаточностью левого желудочка, при этом наиболее частая причина смерти связана с терминальной брадикардией. ИКД может быть настроен на поддержание скорости сердечных сокращений и предотвращение развития тяжелой брадикардии.
Антитахикардическое воздействие. Желудочковая тахикардия купируется либо с помощью кратковременной экстрастимуляции желудочков (исключения одного или нескольких желудочковых пиков), либо методом кратковременного искусственного ведения ритма.
Эту возможность имеют все современные ИКД, которые эффективно разрывают электрическую циркуляцию по типу повторного входа, приводящую к желудочковой тахикардии. Более того, в отличие от кардиоверсии и дефибрилляции, антитахикардическое воздействие обычно хорошо переносится пациентом.
Однако время от времени аппарат может усиливать тахикардию, затруднять ее остановку и способствовать возникновению фибрилляции желудочков, вызывая необходимость дефибрилляции. Это может считаться одним из недостатков метода.
В дальнейшем ИКД будут снабжены детекторами, определяющими желудочковые аритмии не только на основании частоты сердечных сокращений.
Низкоэнергетическая кардиоверсия. Низкоэнергетическая кардиоверсия (НЭК), основанная на тех же принципах, что и внешняя кардиоверсия, требует меньших энергетических затрат (
Таблица 1. Внезапная сердечная смерть: факты и цифры
Сильные магнитные или электрические поля могут мешать работе ИКД, поэтому пациенту необходимо держаться на расстоянии по меньшей мере 30 см от стереоприемников, магнитных пропускников в аэропортах, промышленного оборудования, такого как генераторы мощности и сварочные агрегаты, а также инструментов с батарейками без шнура, например дрелей и отверток.
- Сотовые телефоны и ИКД
Сотовые телефоны, подносимые ближе чем на 15 см к генератору, могут временно воздействовать на ИКД, поэтому пациенты должны держать телефон подальше от генератора и не носить трубку в нагрудном кармане.
И наконец, пациенты с ИКД в течение года после имплантации не могут иметь водительские права. Впоследствии пациент может восстановить водительские права, если в течение этого года ИКД ни разу не продуцировал дефибрилляционный разряд. В противном случае приходится ждать, пока не пройдет свободный от шоковых разрядов год. В течение месяца после любого перепрограммирования пациенты также не могут водить машину.
Кому имплантировать дефибрилляторы — эта проблема крайне сложна и сегодня еще далека от разрешения. Стоимость аппарата, предоперационного обследования, последующего технического обслуживания и наблюдения составляют около 20 000-25 000 фунтов стерлингов.
Конечно, затраты высоки, но они должны быть оправданы улучшением качества жизни.
Риск внезапной смерти от остановки сердца в популяции составляет 2 на 1000 человек ежегодно, поэтому скрининг всего населения нецелесообразен.
Следовательно, внимание нужно сосредоточить на пациентах с сердечными заболеваниями. Те, кто пережил остановку сердца, автоматически входят в группу риска. Однако поскольку большинство пациентов погибают, усиленное лечение выживших существенно не отразится на общей смертности.
Сегодня только начинает вырабатываться методика отбора пациентов с повышенным риском смерти от внезапной остановки сердца. Методы их выявления включают амбулаторное наблюдение, оценку функции левого желудочка, электрокардиографию, оценку частоты сердечных сокращений в покое и при нагрузке, а также рефлекторной чувствительности барорецепторов, и, наконец, формальное инвазивное электрофизиологическое обследование.
Литература
1. Mirowski M., et al. Termination of malignant ventricular arrhythmias with an implanted automatic defibrillator in human beings // New Engl. J. Med 1980; 303: 322-324.
2. Gilman J. K., et al. Predicting and preventing sudden cardiac death from cardiac causes. Circulation 1994; 90: 1083-1092.
3. A Task Force of the Working Groups on Cardiac Arrhythmias and Cardiac Pacing of the European Society of Cardiology. Guidelines for the use of implantable cardioverter difibrillators. // Eur Heart J 1992; 13: 1304-1310.
4. Pinski SL & Trohman RG. Implantable cardioverter-defibrillators: implications for non-electrophysiologist // Ann Intern Med 1995; 122: 770-777.
5. Greene H. L. Antiarrhythmic drugs versus implantable defibrillators: the need for a randomized controlled study // Am Heart J 1993; 127: 1171-1178.
История ИКД
В 1970 г. доктор Майкл Мировски впервые выдвинул идею имплантируемого устройства, способного определять желудочковую фибрилляцию и в ответ на это производить электрический разряд, дефибриллирующий сердце и восстанавливающий нормальный ритм.
Идея воплотилась в жизнь, и в 1980 г. в госпитале Джона Хопкинса была произведена первая удачная имплантация такого аппарата.
Устройство состояло из громоздкого импульсного генератора, накапливающего энергию для разряда. Из-за своих внушительных размеров и веса оно помещалось в подкожный мешок в верхней части живота.
Сердечный ритм контролировался трансвенозным электродом в правом желудочке или миокардиальными проводниками, закрепленными в левом желудочке. Смертность во время операции составляла 3-5% и в основном была обусловлена тяжестью предшествовавших сердечных нарушений.
Дальнейшее совершенствование аппарата, в особенности разработка меньших по размеру генераторов, имплантируемых субпекторально, и электродов, прямо по вене доходящих до сердца (рис. 2), существенно упростило имплантацию (см. “Процедура имплантации”) и снизило операционную смертность, которая составляет сегодня менее 1%.
ИКД против лекарственной терапии — взгляд в будущее
До появления ИКД основным направлением лечения пациентов с аритмиями, потенциально угрожающими жизни, была антиаритмическая терапия.
Сегодня, однако, установлено, что некоторые антиаритмические средства в свою очередь сами способны вызывать аритмию. Так, назначение пациентам с частыми желудочковыми экстрасистолиями, перенесшим инфаркт миокарда, таких препаратов, как флекаинид, энкаинид и морацизин, увеличивает риск внезапной остановки сердца.
В настоящее время проводятся несколько исследований, цель которых — определить, не лучше ли для пациентов с повышенным риском внезапной сердечной смерти заменить ИКД на привычную антиаритмическую терапию. Если преимущества ИКД подтвердятся, то, вероятно, придется пересмотреть всю схему лечения таких пациентов.
Процедура имплантации
 |
Операция проводится под общей анестезией с полным гемодинамическим мониторированием. ИКД последнего поколения содержат два внутрисердечных дефибриллирующих электрода в одном проводнике, который проводят через v. cephalica или v. subclavia, как и стандартный пейсмекерный проводник, в правую половину сердца.
Кончик проводника — его располагают на верхушке правого желудочка — содержит дистальный дефибрилляционный электрод (катод), а проксимальный электрод (анод) помещается в место впадения верхней полой вены в правое предсердие.
Разряд генерируется между двумя электродами. В последних моделях корпус генератора служит дополнительным электродом, так что разряд может охватывать область от правожелудочкового катода до корпуса генератора, что повышает его эффективность и снижает порог дефибрилляции.
Антикоагулянтная терапия: дилемма профилактики тромбоэмболии и геморрагических рисков
За последние 10 лет антикоагулянтная терапия прошла через ряд серьезных изменений. Новые рекомендации по использованию пероральных антикоагулянтов были хорошо приняты как медицинским сообществом, так и пациентами. Какие проблемы они решают?
Материал предназначен для работников здравоохранения
Одна из самых масштабных задач российского здравоохранения к 2024 году – снижение показателей смертности практически на 25%, в том числе и от сердечно-сосудистых заболеваний. Весомый вклад в смертность вносит фибрилляция предсердий, которая эпидемиологически описывается такими показателями как распространенность заболевания в популяции, доля пациентов, получающих антикоагулянтную терапию, и ее эффективность.
Несмотря на предпринимаемые усилия, результаты проведенных эпидемиологических моделирований сообщают о том, что за это время достичь запланированных показателей не представляется возможным. Например, в сравнении с Норвегией, в России в 2 раза больше пациентов с артериальной гипертензией, не получающих лечения, и в 2-3 больше тех, кто лечение получает, но не достигает целевых уровней АД. Оптимистичный взгляд на эту проблему заключается в том, что ее можно рассматривать и как «резерв» – в качестве простого и эффективного способа увеличения продолжительности жизни и уменьшения смертности. Аналогичные проблемы присутствуют и у пациентов с фибрилляцией предсердий.
.jpg) Бойцов С.А., генеральный директор ФГБУ «НМИЦ кардиологии», один из главных внештатных специалистов-кардиологов федерального уровня, в своем докладе указывает, что для повышения эффективности лечения сердечно-сосудистых заболеваний необходимо увеличение объемов диспансерного наблюдения на терапевтических участках, увеличение льгот, разработка способов дистанционного мониторинга АД и контроля достижения его целевых уровней для повышения приверженности к лечению, а также выполнение требований клинических рекомендаций и контроля качества.
Бойцов С.А., генеральный директор ФГБУ «НМИЦ кардиологии», один из главных внештатных специалистов-кардиологов федерального уровня, в своем докладе указывает, что для повышения эффективности лечения сердечно-сосудистых заболеваний необходимо увеличение объемов диспансерного наблюдения на терапевтических участках, увеличение льгот, разработка способов дистанционного мониторинга АД и контроля достижения его целевых уровней для повышения приверженности к лечению, а также выполнение требований клинических рекомендаций и контроля качества.
Российский национальный конгресс кардиологов начался спустя некоторое время после публикации новых рекомендаций Европейского общества кардиологов ESC 2020, положения которого стали центром внимания многих докладов. Выявление и лечение сопутствующих заболеваний – один из компонентов одномоментной триединой цели в лечении фибрилляции предсердий, сформулированной в этих рекомендациях. В простой аббревиатуре ABC зашифрованы Антикоагулянты, Больший контроль симптомов (Better symptom control) и Сердечно-сосудистые факторы риска с сопутствующими заболеваниями (Cardiovascular risk factors and concomitant diseases).
За последние 10 лет кардиология и, в частности, антикоагулянтная терапия прошли через ряд серьезных изменений: эпоха рекомендаций антагонистов витамина К сменилась на более предпочтительные прямые пероральные антикоагулянты (ПОАК). Новые рекомендации были хорошо приняты как медицинским сообществом, так и пациентами.
.jpg) Вечную дилемму антикоагулянтной терапии об уменьшении частоты тромбоэмболии и увеличения риска кровотечений прокомментировал Мареев Вячеслав Юрьевич, д.м.н., главный научный сотрудник МНОЦ, профессор ФФМ МГУ имени М.В Ломоносова, перефразировав знаменитую цитату из пьесы Гоголя «Женитьба»:
Вечную дилемму антикоагулянтной терапии об уменьшении частоты тромбоэмболии и увеличения риска кровотечений прокомментировал Мареев Вячеслав Юрьевич, д.м.н., главный научный сотрудник МНОЦ, профессор ФФМ МГУ имени М.В Ломоносова, перефразировав знаменитую цитату из пьесы Гоголя «Женитьба»:
«Если бы мне лекарство эффективное как варфарин, да безопасное как аспирин, да еще бы не соблюдать ни диет, ни правил приема, да, пожалуй, и не измерять ничего, мы бы тогда тотчас же решились. А теперь – иди подумай!».
Может ли современная фармакология предложить такой препарат? Да, считает Вячеслав Юрьевич. Новый прямой ингибитор фактора Xa, апиксабан, имеет высокий профиль безопасности. В сравнении с ацетилсалициловой кислотой, на каждые 1000 пациентов апиксабан вызывает только 2 дополнительных кровотечения, при этом у пациентов с ФП, получающих лечение в течение 1 года, он предотвратил бы инсульт или системную эмболию у 21 пациента, смерть 9 пациентов и госпитализацию по поводу сердечно-сосудистых заболеваний 33 пациентов.
При этом, говоря о геморрагических рисках, речь идет только о так называемых «досаждающих» кровотечениях: носовые в 68% случаев, десневые в 25% и подкожные в 7% без увеличения риска больших кровотечений и инсульта. К сожалению, эти события иногда являются необоснованной причиной отказа от терапии апиксабаном. В этом контексте необходимо помнить, что лечение пациентов с ФП без перерыва сопровождается частотой инсультов и системной эмболии только в 1,7% случаев, при временном перерыве в лечении – уже в 6,2%, а при длительной отмене – в 25,6%.
.jpg) Об «эффекте ножниц» слушателям симпозиума рассказала Кобалава Ж.Д., профессор, д.м.н., заведующая кафедрой внутренних болезней и клинической фармакологии РУДН. У пациентов с ФП с возрастом увеличивается риск инсульта, но при этом им реже назначаются эффективные препараты. Однако сопровождается ли увеличение возраста риском эмболических или геморрагических событий, требует дополнительной оценки.
Об «эффекте ножниц» слушателям симпозиума рассказала Кобалава Ж.Д., профессор, д.м.н., заведующая кафедрой внутренних болезней и клинической фармакологии РУДН. У пациентов с ФП с возрастом увеличивается риск инсульта, но при этом им реже назначаются эффективные препараты. Однако сопровождается ли увеличение возраста риском эмболических или геморрагических событий, требует дополнительной оценки.
Для объективизации этой оценки терапии был разработан показатель чистой клинической выгоды (NCB, net clinical benefit), который создает общий знаменатель у эффективности и безопасности препарата. Его расчет в основных клинических исследованиях ПОАК позволяет сделать вывод об апиксабане, как о наиболее предпочтительном антикоагулянте у определенных групп пациентов. По двумерной оценке эффективности и безопасности антитромботических препаратов большинство новых ПОАК находятся в области так называемого «идеального препарата» во всех категориях сравнения частоты тромбоэмболических осложнений с большими и внутричерепными кровотечениями, а также в сравнении с частотой смертельных исходов. При этом среди всех ПОАК, профиль, характеризующий NCB при комбинации тромбоэмболических осложнений с любым из вышеперечисленных критериев, был положительным только у апиксабана, в том числе и с желудочно-кишечными кровотечениями.
Хотя за последние годы существенно увеличилось число пациентов, принимающих новый класс препаратов, и уменьшилось число принимающих аспирин, пропорция пациентов, не получающих никакую антикоагулянтную терапию, осталась практически неизменной. К сожалению, принцип «non nocere» часто ведет к применению необоснованно низких доз препаратов или к полному отказу от лечения. В этом случае стоит помнить о высоких показателях чистой клинической выгоды апиксабана, особенно у таких «хрупких» групп как люди пожилого возраста и пациенты с нарушениями функции почек.
.jpg) В заключительной части симпозиума выступил профессор Peter R. Sinnaeve из Левенского университетского госпиталя, Бельгия. Он подробно ознакомил слушателей с результатами классических исследований, касающихся двойной и тройной антитромботической терапии, а также с европейскими рекомендациями ESC, в которых использование ПОАК ознаменовалось классом доказательности 1а.
В заключительной части симпозиума выступил профессор Peter R. Sinnaeve из Левенского университетского госпиталя, Бельгия. Он подробно ознакомил слушателей с результатами классических исследований, касающихся двойной и тройной антитромботической терапии, а также с европейскими рекомендациями ESC, в которых использование ПОАК ознаменовалось классом доказательности 1а.
В Левенском университетском госпитале находится довольно большое количество пациентов с фибрилляцией предсердий и ОКС, в том числе прошедших ЧКВ. Известно, что терапия этих состояний не является взаимозаменяемой, на одной чаше весов всегда находится риск тромбоза стента и повторного инсульта или инфаркта, на другой – риск серьезных кровотечений. Имеющиеся рекомендации зачастую могут быть противоречивы и недостаточно понятны. К счастью, в распоряжении кардиологов есть хорошая доказательная база, посвященная основным ПОАК, в виде исследований PIONEER-PCI (ривароксабан), RE-DUAL PCI (дабигатран), ENTRUST (эдоксабан) и AUGUSTUS (апиксабан). Самым крупным из них является AUGUSTUS, включающее 4600 пациентов. Помимо прочего, это единственное исследование, слепо оценивающее влияние аспирина на риск кровотечений и включающее пациентов с ОКС, которым не проводилось ЧКВ.
Основной вывод, который можно сделать из всех четырех исследований – превосходство двойной терапии над тройной, что также подтверждается новыми рекомендациями ESC. Еще одно заключение, следующее из результатов AUGUSTUS, касается продолжительности двойной терапии – у стабильных пациентов после первичного коронарного вмешательства может быть достаточно 6 месяцев двойной терапии, после чего возможен переход на монотерапию ПОАК.
Несмотря на многие неизученные вопросы, в кардиологии происходят важнейшие изменения, основанные на четких и поступательных шагах и осуществляемые в рамках доказательной медицины. Нет никаких сомнений в обоснованности выводов новых рекомендаций ECS 2020 года, подчеркивающих инновационную роль ПОАК в обеспечении как эффективной, так и безопасной антикоагулянтной терапии.


